Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аминокислоты
Содержание
- 1. Аминокислоты
- 2. Аминокислоты — органические амфотерные соединения, в состав
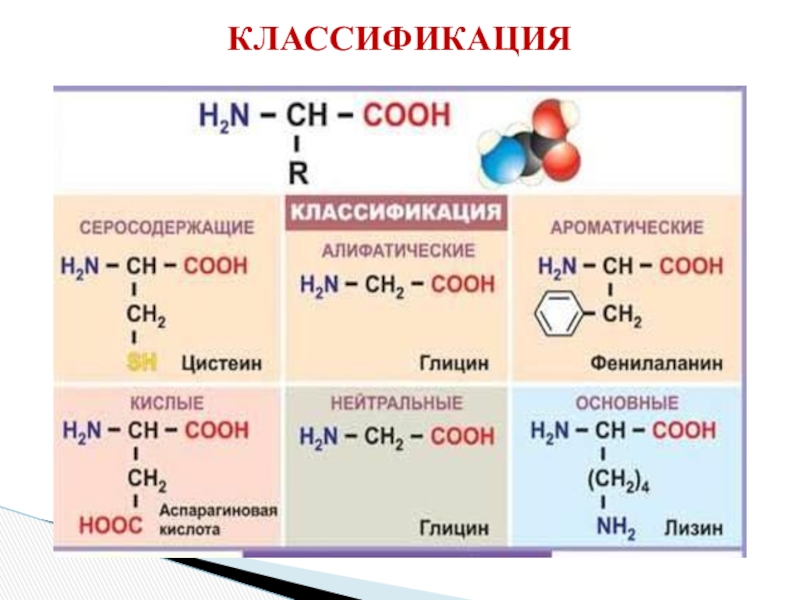
- 3. КЛАССИФИКАЦИЯ
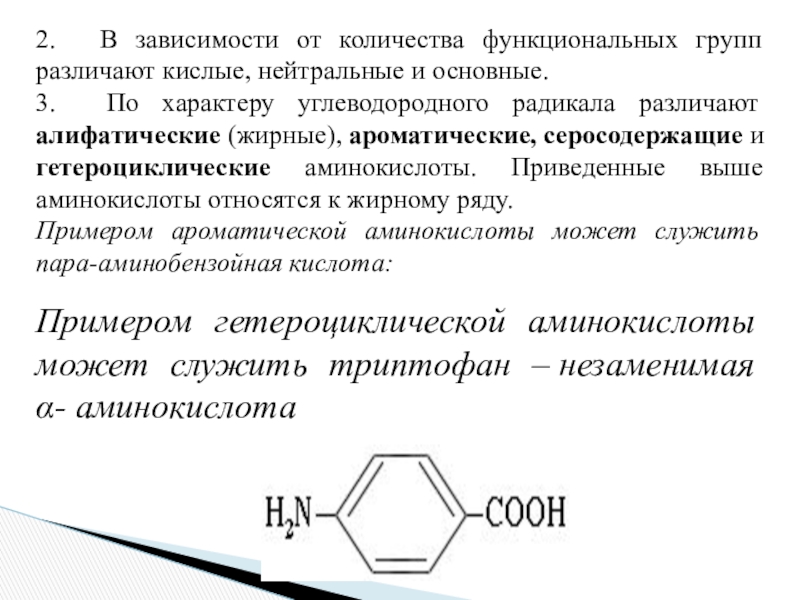
- 4. Аминокислоты классифицируют по структурным признакам. 1. В
- 5. 2. В зависимости от количества функциональных групп
- 6. НОМЕНКЛАТУРАПо систематической номенклатуре названия аминокислот образуются из
- 7. Часто используется также другой способ построения названий
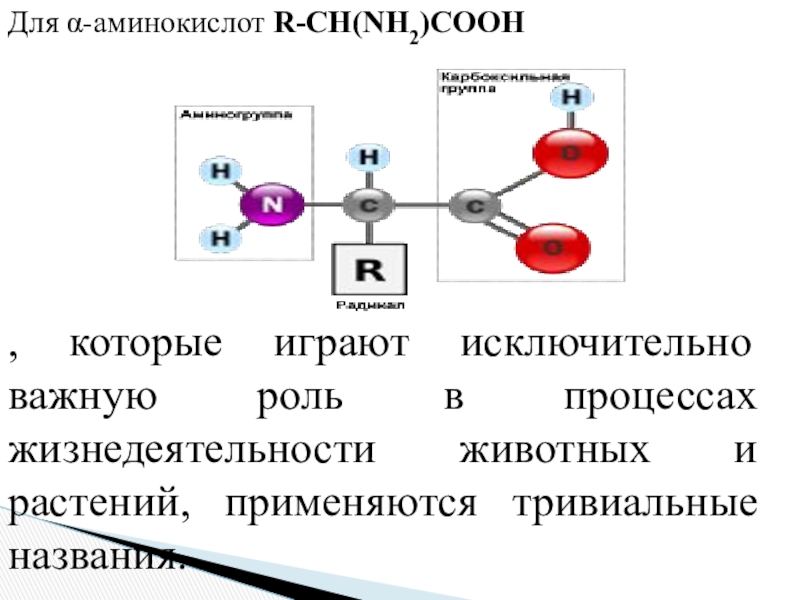
- 8. Для α-аминокислот R-CH(NH2)COOH, которые играют исключительно важную
- 9. Таблица. Некоторые важнейшие α-аминокислоты Если в молекуле аминокислоты
- 10. Пример: Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота:
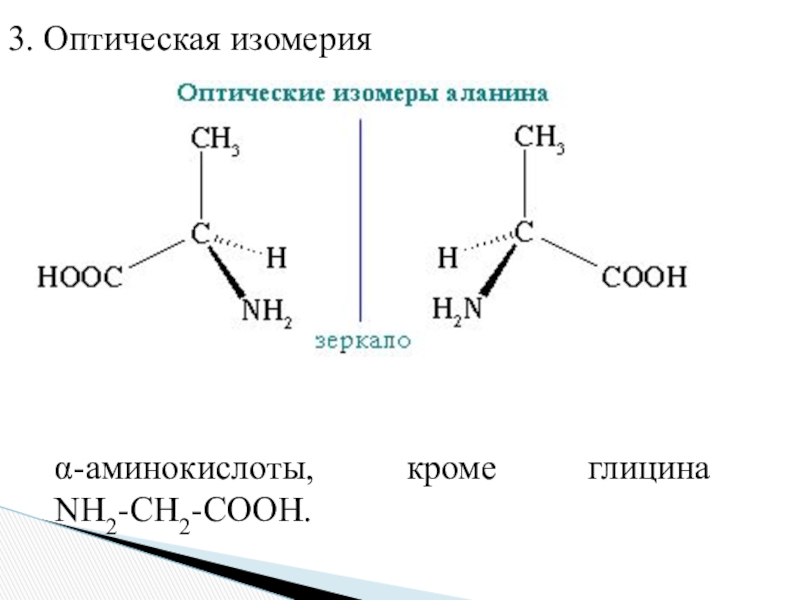
- 11. ИЗОМЕРИЯ1. Изомерия углеродного скелета2. Изомерия положения функциональных групп
- 12. 3. Оптическая изомерияα-аминокислоты, кроме глицина NН2-CH2-COOH.
- 13. ФИЗИЧЕСКИЕ СВОЙСТВА Аминокислоты представляют собой кристаллические вещества с
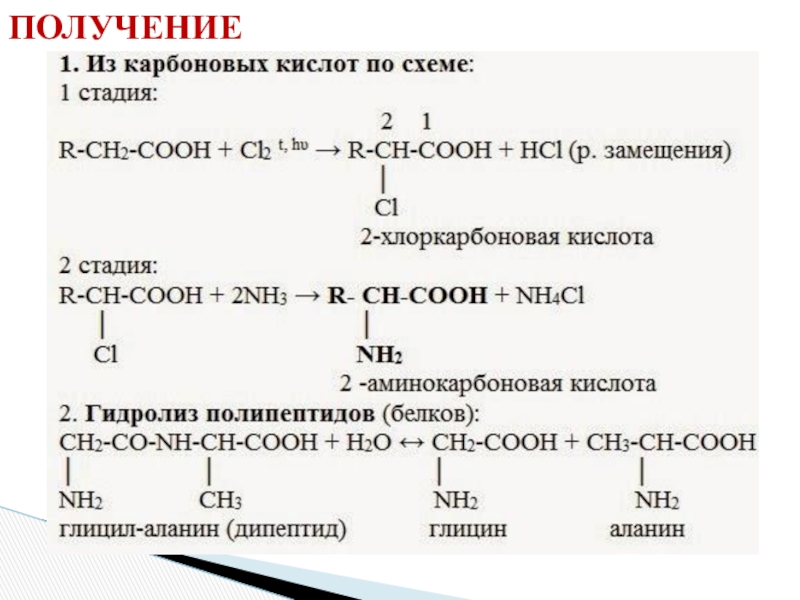
- 14. ПОЛУЧЕНИЕ
- 15. 3. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α - аминокислоты белков.
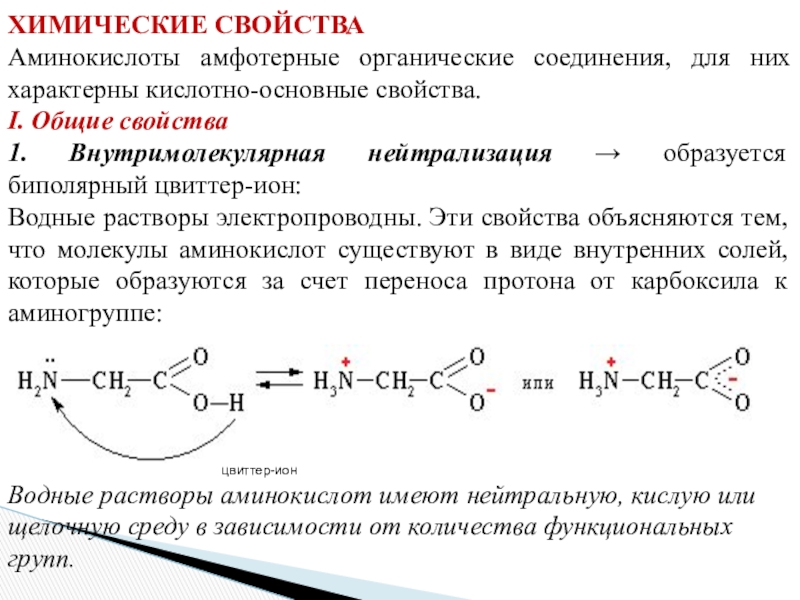
- 16. ХИМИЧЕСКИЕ СВОЙСТВА Аминокислоты амфотерные органические соединения, для них
- 17. 2. Поликонденсация → образуются полипептиды (белки):При взаимодействии двух α-аминокислот образуется дипептид.
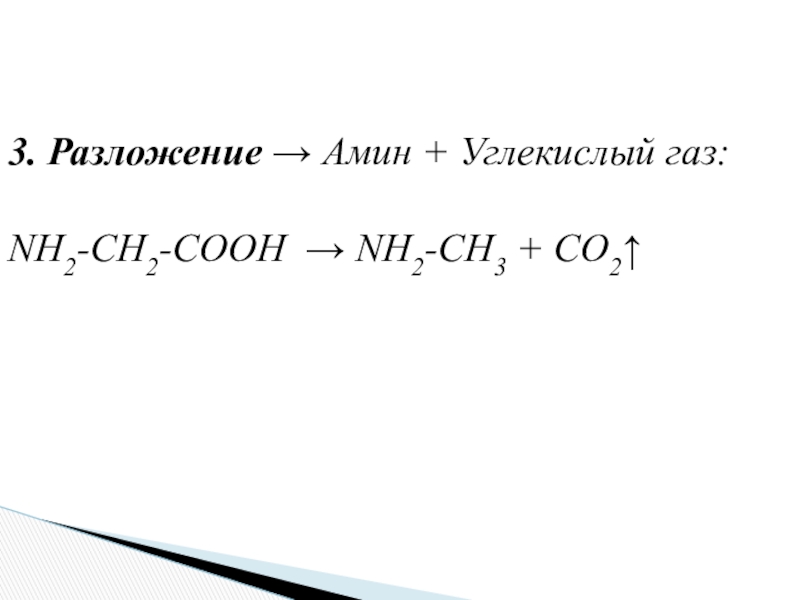
- 18. 3. Разложение → Амин + Углекислый газ:NH2-CH2-COOH → NH2-CH3 + CO2↑
- 19. II. Свойства карбоксильной группы (кислотность)1. С основаниями
- 20. 2. Со спиртами → образуются сложные эфиры
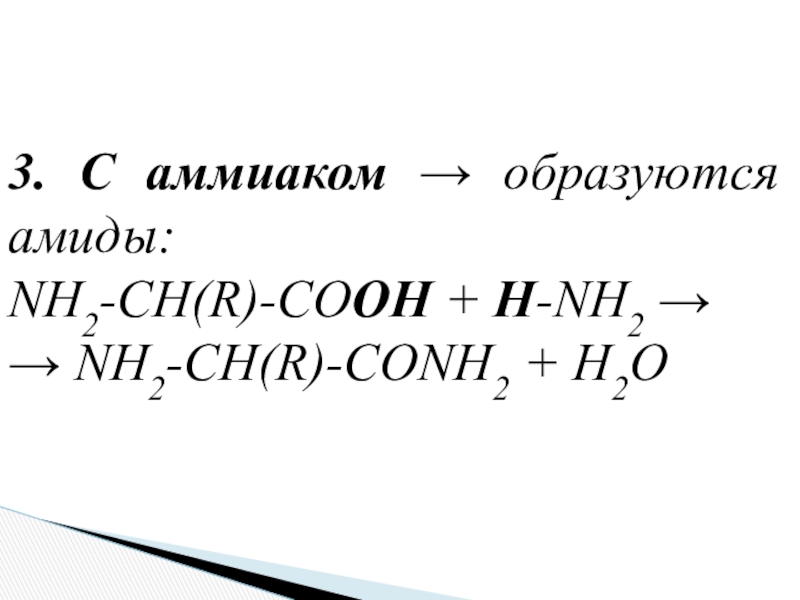
- 21. 3. С аммиаком → образуются амиды:NH2-CH(R)-COOH + H-NH2 → → NH2-CH(R)-CONH2 + H2O
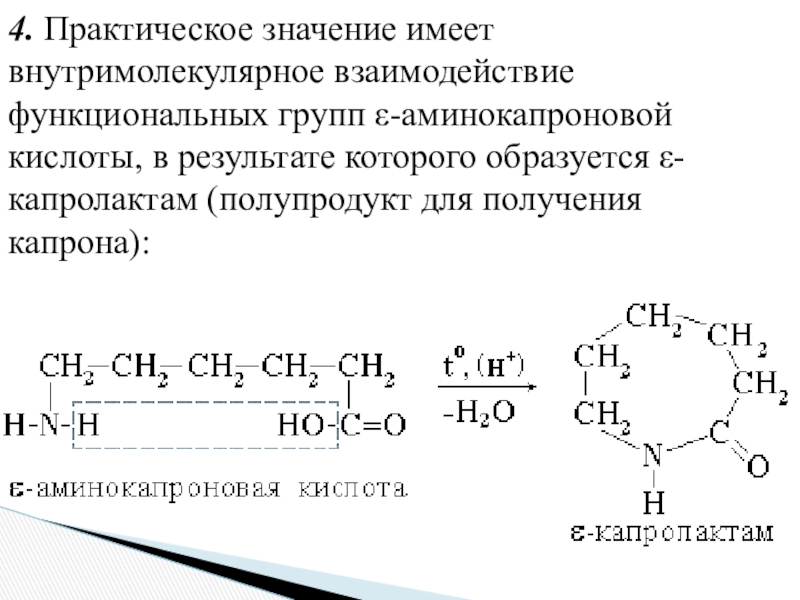
- 22. 4. Практическое значение имеет внутримолекулярное взаимодействие функциональных
- 23. III. Свойства аминогруппы (основность)1. С сильными кислотами
- 24. 2. С азотистой кислотой (подобно первичным аминам):NH2-CH(R)-COOH
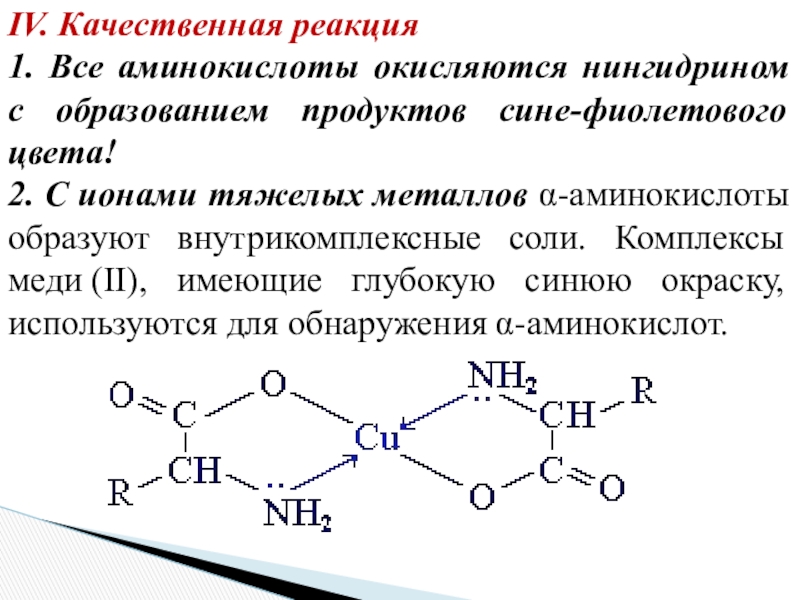
- 25. IV. Качественная реакция1. Все аминокислоты окисляются нингидрином
- 26. ПРИМЕНЕНИЕ 1) аминокислоты широко распространены в природе;2) молекулы аминокислот –
- 27. Благодарю за внимание!!!
- 28. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Аминокислоты — органические амфотерные соединения, в состав которых входят карбоксильные
группы – СООН и аминогруппы -NH2.
кислоты, в молекулах которых атом водорода в радикале замещен аминогруппой.Слайд 4Аминокислоты классифицируют по структурным признакам.
1. В зависимости от взаимного
расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-,
γ-, δ-, ε- и т. д.Слайд 52. В зависимости от количества функциональных групп различают кислые, нейтральные
и основные.
3. По характеру углеводородного радикала различают алифатические (жирные), ароматические,
серосодержащие и гетероциклические аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду. Примером ароматической аминокислоты может служить пара-аминобензойная кислота:
Примером гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота
Слайд 6НОМЕНКЛАТУРА
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот
прибавлением приставки амино- и указанием места расположения аминогруппы по отношению
к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы.Слайд 7Часто используется также другой способ построения названий аминокислот, согласно которому
к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием
положения аминогруппы буквой греческого алфавита.Пример:
Слайд 8Для α-аминокислот R-CH(NH2)COOH
, которые играют исключительно важную роль в процессах
жизнедеятельности животных и растений, применяются тривиальные названия.
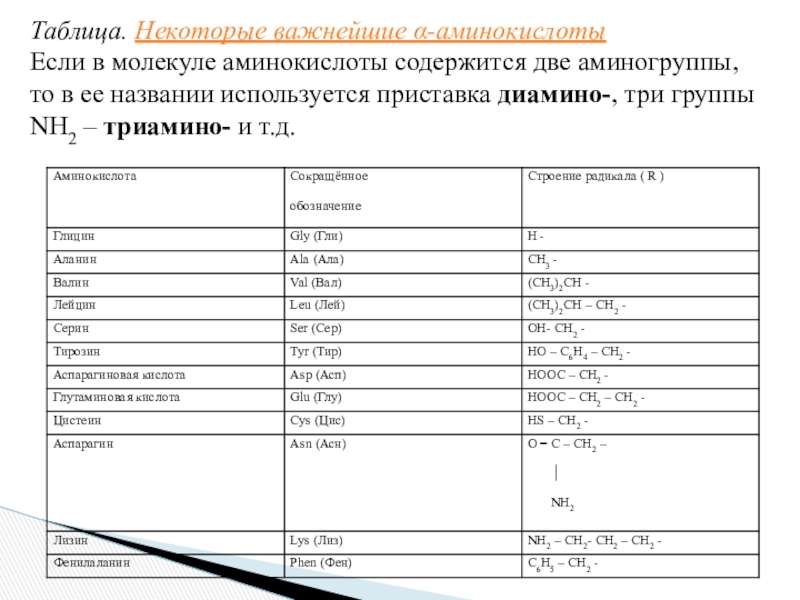
Слайд 9Таблица. Некоторые важнейшие α-аминокислоты
Если в молекуле аминокислоты содержится две аминогруппы,
то в ее названии используется приставка диамино-, три группы NH2
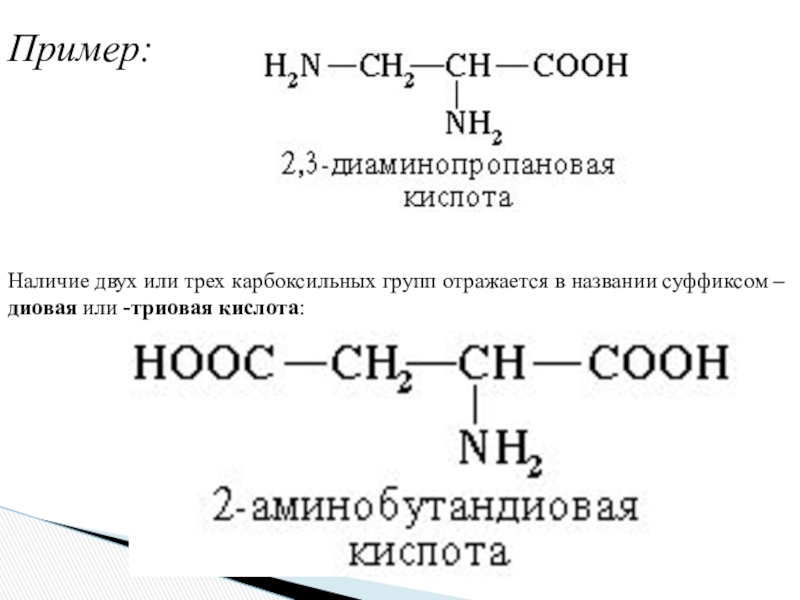
– триамино- и т.д.Слайд 10Пример:
Наличие двух или трех карбоксильных групп отражается в названии
суффиксом –диовая или -триовая кислота:
Слайд 13ФИЗИЧЕСКИЕ СВОЙСТВА
Аминокислоты представляют собой кристаллические вещества с высокими (выше 250°С)
температурами плавления, которые мало отличаются у индивидуальных аминокислот и поэтому
нехарактерны. Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в воде и нерастворимы в органических растворителях, чем они похожи на неорганические соединения. Многие аминокислоты обладают сладким вкусом.Слайд 153. Микробиологический синтез.
Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют
α - аминокислоты белков.
Слайд 16ХИМИЧЕСКИЕ СВОЙСТВА
Аминокислоты амфотерные органические соединения, для них характерны кислотно-основные свойства.
I.
Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные растворы электропроводны.
Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе: цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
Слайд 172. Поликонденсация → образуются полипептиды (белки):
При взаимодействии двух α-аминокислот образуется
дипептид.
Слайд 19II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH
+ NaOH →
→ NH2-CH2-COONa + H2O
NH2-CH2-COONa - натриевая соль
2-аминоуксусной кислотыСлайд 202. Со спиртами → образуются сложные эфиры – летучие вещества
(р. этерификации):
NH2-CH2-COOH + CH3OH HCl(газ)→
→
NH2-CH2-COOCH3 + H2ONH2-CH2-COOCH3 - метиловый эфир 2- аминоуксусной кислоты
Слайд 224. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты,
в результате которого образуется ε-капролактам (полупродукт для получения капрона):
Слайд 23III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 +
HCl →
→[HOOC-CH2-NH3]Cl
или HOOC-CH2 NH2*HCl
Слайд 242. С азотистой кислотой (подобно первичным аминам):
NH2-CH(R)-COOH + HNO2 →
→ HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Измерение объёма выделившегося азота позволяет определить
количество аминокислоты (метод Ван-Слайка) Слайд 25IV. Качественная реакция
1. Все аминокислоты окисляются нингидрином с образованием продуктов
сине-фиолетового цвета!
2. С ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли.
Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Слайд 26ПРИМЕНЕНИЕ
1) аминокислоты широко распространены в природе;
2) молекулы аминокислот – это те кирпичики,
из которых построены все растительные и животные белки; аминокислоты, необходимые
для построения белков организма, человек и животные получают в составе белков пищи;3) аминокислоты прописываются при сильном истощении, после тяжелых операций;
4) их используют для питания больных;
5) аминокислоты необходимы в качестве лечебного средства при некоторых болезнях (например, глутаминовая кислота используется при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты применяются в сельском хозяйстве для подкормки животных, что положительно влияет на их рост;
7) имеют техническое значение: аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна – капрон и энант.











![Аминокислоты III. Свойства аминогруппы (основность)1. С сильными кислотами → соли:HOOC-CH2-NH2 + HCl III. Свойства аминогруппы (основность)1. С сильными кислотами → соли:HOOC-CH2-NH2 + HCl → →[HOOC-CH2-NH3]Cl](/img/tmb/6/593955/ed4abef7533e40f2ef4d5672ea8789b9-800x.jpg)