Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АМИНЫ
Содержание
- 1. АМИНЫ
- 2. Понятие об аминахАмины — производные аммиака,
- 3. Понятие об аминах
- 4. Классификация аминов
- 5. Номенклатура аминовРАДИКАЛ + АМИН1. СН3 –
- 6. CH3CH2CH2–NH2 CH3–CH–CH3
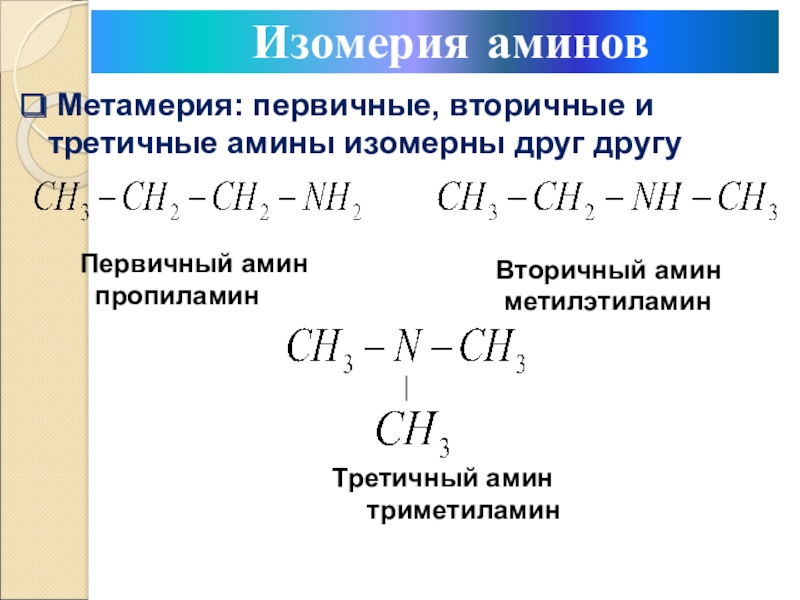
- 7. Метамерия: первичные, вторичные и третичные амины
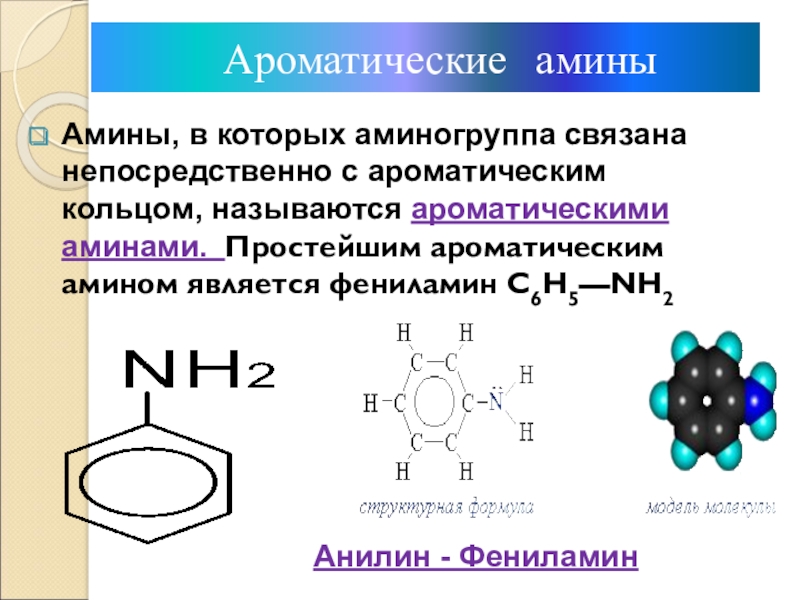
- 8. Амины, в которых аминогруппа связана непосредственно с
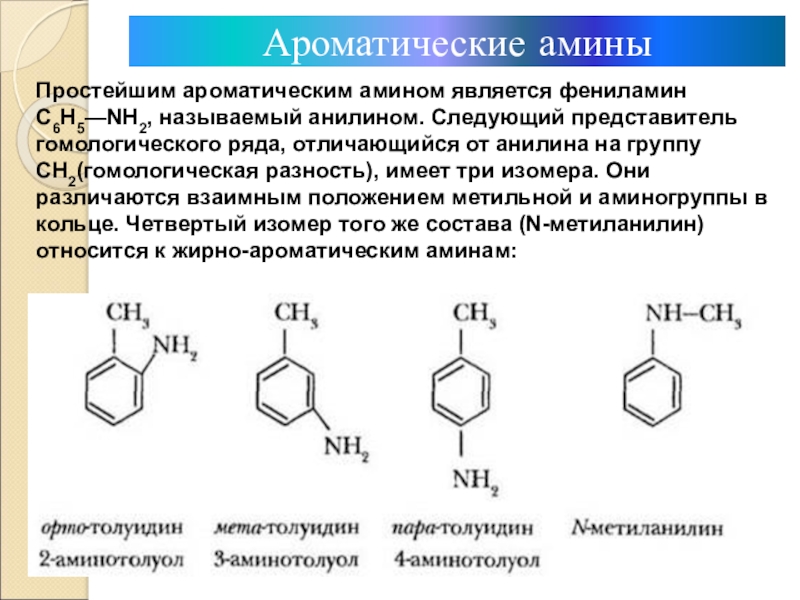
- 9. Ароматические аминыПростейшим ароматическим амином является фениламин С6Н5—NH2,
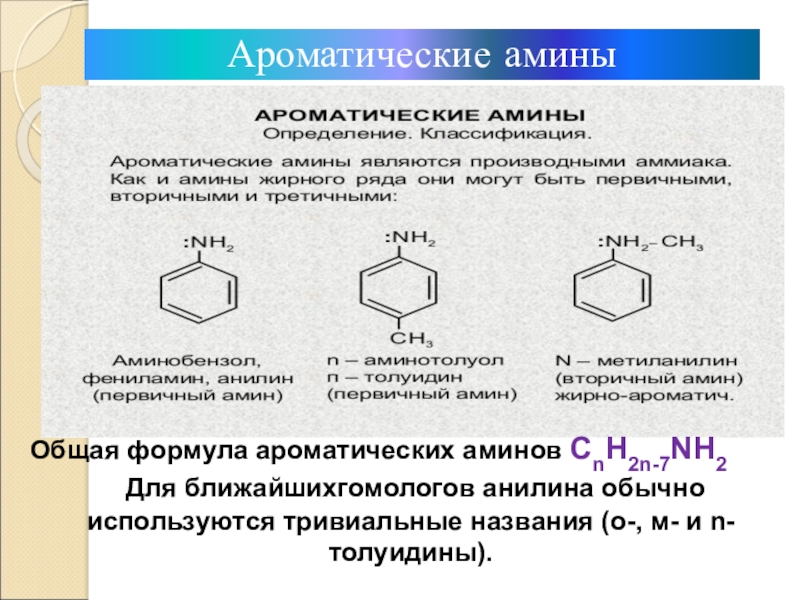
- 10. Ароматические аминыОбщая формула ароматических аминов СnН2n-7NH2 Для ближайшихгомологов анилина обычно используются тривиальные названия (о-, м- и n-толуидины).
- 11. Метиламин, диметиламин и триметиламин – газы; средние
- 12. Физические свойства анилинаАнилин – маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184˚С
- 13. В результате этой реакции образуется соль амина
- 14. При взаимодействии полученного первичного амина и галогенопроизводного и последующей обработке щелочью получают вторичный амин (диэтиламин):Получение
- 15. Повторение процедуры приводит к образованию третичного амина:Получение
- 16. Третичный амин может ещё раз вступить в
- 17. ПолучениеПолучение первичных аминов восстановлением нитросоединений – алифатических
- 18. В промышленности анилин (аминобензол) – получают восстановлением
- 19. Получение анилинаЗинин Николай Николаевич (1812 –
- 20. ион аммония
- 21. Атом
- 22. +H3NHCl=NH4Clхлорид аммонияC2H5NH2::+HCl=[C2H5NH3] Clхлорид этиламмонияNH2:H2SO4+=NH3SO42Сульфат фениламмония Химические свойства аминов
- 23. :CH3NH2>H3N>Основность ослабеваетNH3
- 24. На воздухе с образованием углекислого газа, воды и азота: Химические свойства аминов
- 25. Выступая в роли нуклеофилов (так получают вторичные и третичные амины): Химические свойства аминов
- 26. Химические свойства аминовОбразуя Амиды – важнейший класс органических соединений:этиламид уксусной кислотыметиламид уксусной кислоты
- 27. Химические свойства аминовАмид можно сразу получить из карбоновой кислоты:метиламид уксусной кислоты
- 28. Уменьшение электронной плотности на атоме азота приводит
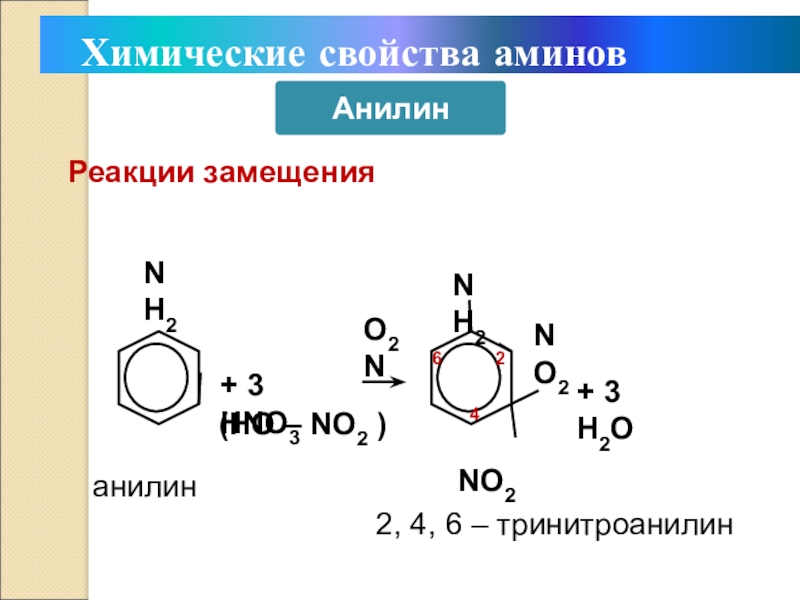
- 29. Реакции замещенияNH2+ 3 HNO3(HO – NO2 )NH2NO2NO2O2N+ 3 H2O2462, 4, 6 – тринитроанилинанилин Химические свойства аминовАнилин
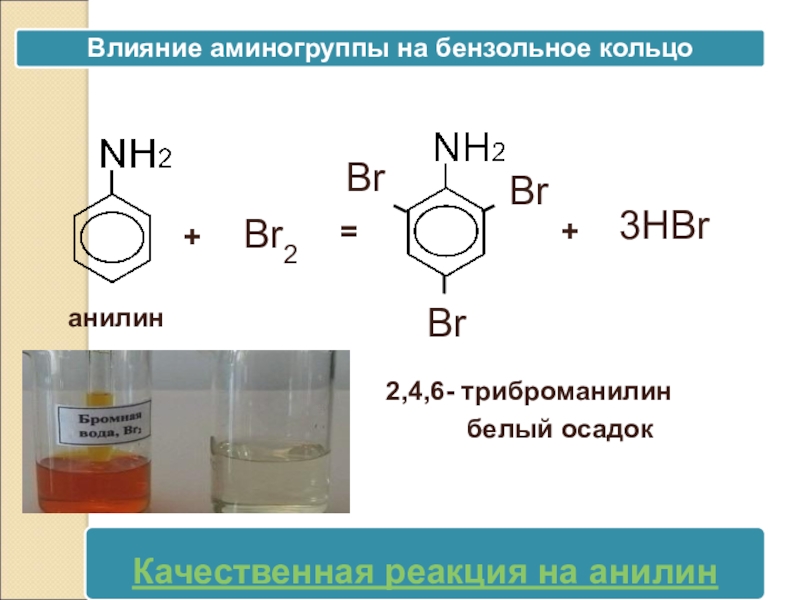
- 30. +Br2=BrBrBrанилин3HBr+2,4,6- триброманилин белый осадокбелый
- 31. С6Н5NH2 + H+Cl- → [С6Н5NH3]+Cl-хлорид фениламмония Реакция анилина с соляной кислотой
- 32. Применение аминовАмины широко применяются для получения лекарств, полимерных материалов.
- 33. Домашнее задание § 25,№ 4,8,9
- 34. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 Понятие об аминах
Амины — производные аммиака,
в молекулах которых
один или несколько атомов водорода замещены на углеводородный радикал
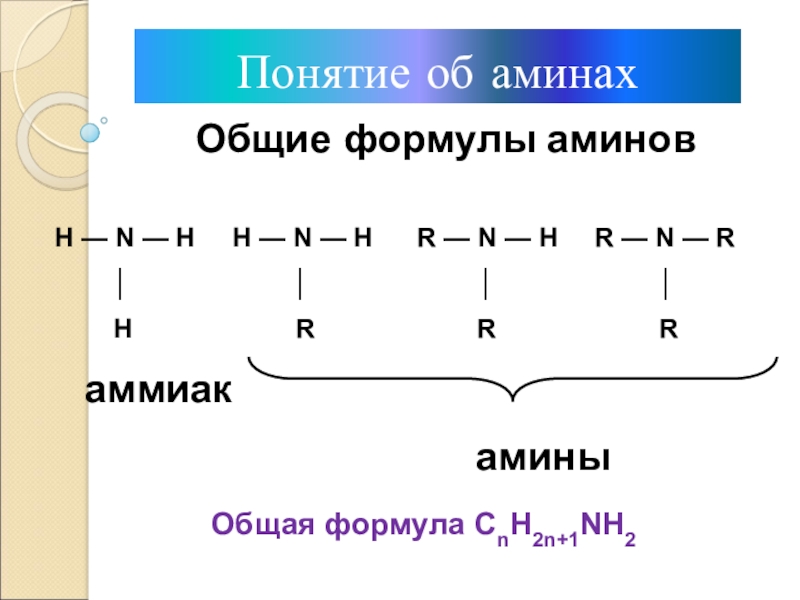
функциональная группа –NH2Слайд 3Понятие об аминах
Общие формулы аминов
Н — N — H
Н — N — H R — N — H R — N — R│ │ │ │
H R R R
аммиак
амины
Общая формула СnН2n+1NH2
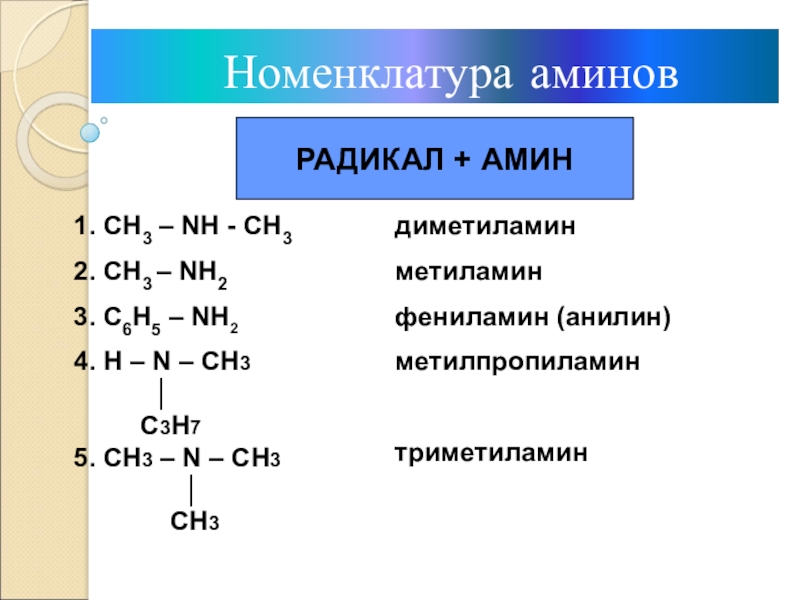
Слайд 5 Номенклатура аминов
РАДИКАЛ + АМИН
1. СН3 – NН - СН3
2. СН3 – NН2
3. С6Н5 – NН2
4. H
– N – CH3 │
С3Н7
5. CH3 – N – CH3
│
СН3
диметиламин
метиламин
фениламин (анилин)
метилпропиламин
триметиламин
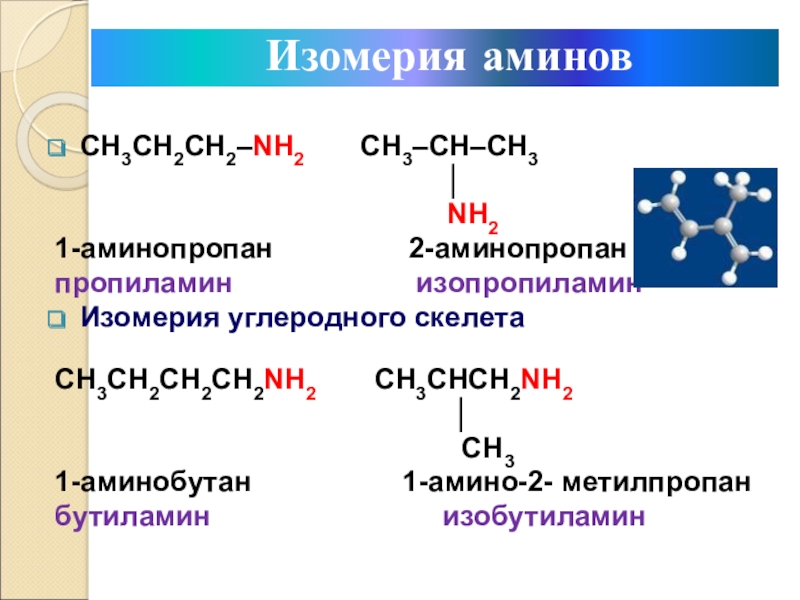
Слайд 6CH3CH2CH2–NH2 CH3–CH–CH3
│
NH2
1-аминопропан 2-аминопропан
пропиламин изопропиламин
Изомерия углеродного скелета
CH3CH2CH2CH2NH2 CH3CHCH2NH2
│
CH3
1-аминобутан 1-амино-2- метилпропан
бутиламин изобутиламин
Изомерия аминов
Слайд 7 Метамерия: первичные, вторичные и третичные амины изомерны друг другу
Первичный
амин
пропиламин
Вторичный амин
метилэтиламин
Третичный
аминтриметиламин
Изомерия аминов
Слайд 8Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются
ароматическими аминами. Простейшим ароматическим амином является фениламин С6Н5—NH2
Ароматические амины
Анилин
- ФениламинСлайд 9Ароматические амины
Простейшим ароматическим амином является фениламин С6Н5—NH2, называемый анилином. Следующий
представитель гомологического ряда, отличающийся от анилина на группу СН2(гомологическая разность),
имеет три изомера. Они различаются взаимным положением метильной и аминогруппы в кольце. Четвертый изомер того же состава (N-метиланилин) относится к жирно-ароматическим аминам:Слайд 10Ароматические амины
Общая формула ароматических аминов СnН2n-7NH2
Для ближайшихгомологов анилина обычно используются
тривиальные названия (о-, м- и n-толуидины).
Слайд 11Метиламин, диметиламин и триметиламин – газы;
средние члены алифатического ряда
– жидкости; высшие – твердые вещества.
Низшие амины хорошо растворимы
в воде и имеют резкий запах. Первичные и вторичные амины образуют водородные связи.С увеличением молекулярной массы увеличиваются t кип. и t пл.; уменьшается растворимость в воде.
Физические свойства
Слайд 12Физические свойства анилина
Анилин – маслянистая жидкость, ограниченно растворимая в воде,
кипящая при температуре 184˚С
Слайд 13В результате этой реакции образуется соль амина (гидробромид этиламмония), из
которой действием щёлочи можно выделить первичный амин (этиламин):
Получение аминов
из галогенопроизводных - аминированиеПолучение
Слайд 14При взаимодействии полученного первичного амина и галогенопроизводного и последующей обработке
щелочью получают вторичный амин (диэтиламин):
Получение
Слайд 16Третичный амин может ещё раз вступить в реакцию с бромэтаном.
При этом образуется четвертичная аммонийная соль, образованная бромид-ионом и катионом
тетраэтиламмония:Получение
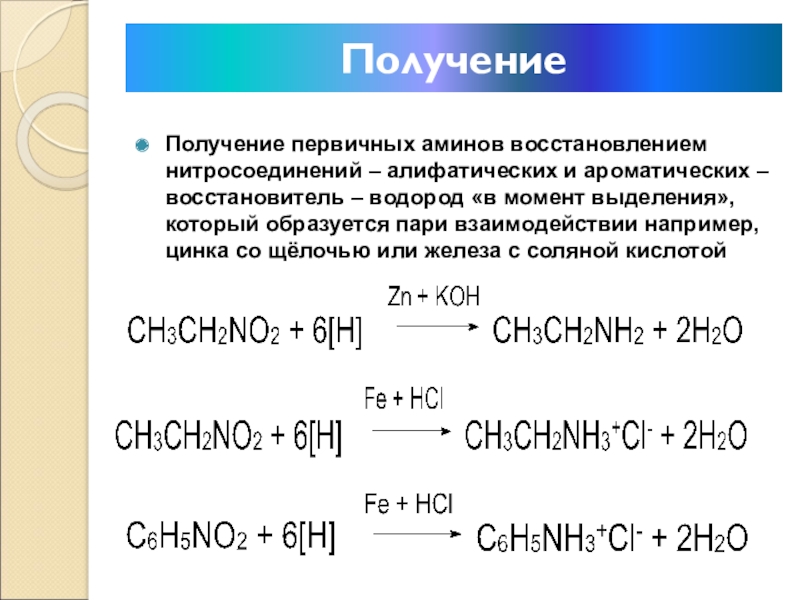
Слайд 17Получение
Получение первичных аминов восстановлением нитросоединений – алифатических и ароматических –
восстановитель – водород «в момент выделения», который образуется пари взаимодействии
например, цинка со щёлочью или железа с соляной кислотойСлайд 18В промышленности анилин (аминобензол) – получают восстановлением нитробензола, нагревая в
присутствии железа с водяным паром:
Способ получения анилина из нитробензола был
предложен русским химиком Н.Н. Зининым:Получение
Слайд 19 Получение анилина
Зинин Николай
Николаевич
(1812 – 1880)
Русский химик —
органик,
академик.
«Если бы Зинин не сделал ничего более, кроме превращения нитробензола
в анилин, то и тогда его имя осталось бы записанным золотыми буквами в истории химии»Слайд 20 ион аммония
ион тетраэтиламмония
Существуют ионы, которые являются продуктом формального замещения на углеводородный
радикал всех атомов водорода в ионе аммония. Химические свойства
Слайд 21 Атом азота аминогруппы за
счет неподеленной пары электронов может образовывать ковалентную связь по донорно
– акцепторному механизму, вступая в роли донора. В связи с этим амины способны присоединять катион водорода.ИОН АММОНИЯ
ИОН ЭТИЛАММОНИЯ
Химические свойства
Слайд 22+
H3N
HCl
=
NH4Cl
хлорид аммония
C2H5NH2
:
:
+
HCl
=
[C2H5NH3] Cl
хлорид этиламмония
NH2
:
H2SO4
+
=
NH3
SO4
2
Сульфат фениламмония
Химические свойства аминов
Слайд 25Выступая в роли нуклеофилов (так получают вторичные и третичные амины):
Химические свойства аминов
Слайд 26 Химические свойства аминов
Образуя Амиды – важнейший класс органических соединений:
этиламид
уксусной кислоты
метиламид уксусной кислоты
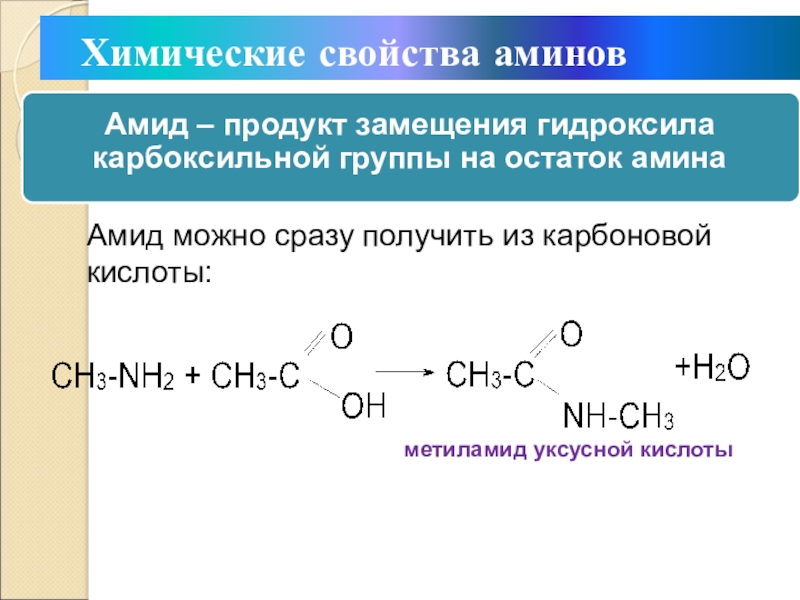
Слайд 27 Химические свойства аминов
Амид можно сразу получить из карбоновой кислоты:
метиламид
уксусной кислоты
Слайд 28Уменьшение электронной плотности на атоме азота приводит к снижению способности
отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с
сильными кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет.Аминогруппа - заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре).
Такое взаимное влияние атомов в молекуле анилина объясняется сопряжением p-электронов бензольного кольца с неподеленной электронной парой атома азота (+M-эффект аминогруппы):
Химические свойства аминов
Анилин













![АМИНЫ +H3NHCl=NH4Clхлорид аммонияC2H5NH2::+HCl=[C2H5NH3] Clхлорид этиламмонияNH2:H2SO4+=NH3SO42Сульфат фениламмония Химические свойства аминов +H3NHCl=NH4Clхлорид аммонияC2H5NH2::+HCl=[C2H5NH3] Clхлорид этиламмонияNH2:H2SO4+=NH3SO42Сульфат фениламмония Химические свойства аминов](/img/tmb/7/651472/929fb06a63cc5857a51e0c147f17fe72-800x.jpg)





![АМИНЫ С6Н5NH2 + H+Cl- → [С6Н5NH3]+Cl-хлорид фениламмония Реакция анилина с соляной кислотой С6Н5NH2 + H+Cl- → [С6Н5NH3]+Cl-хлорид фениламмония Реакция анилина с соляной кислотой](/img/tmb/7/651472/f70b571a3e00cc19fa22f72dd3de9fdf-800x.jpg)