Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аммиак
Содержание
- 1. Аммиак
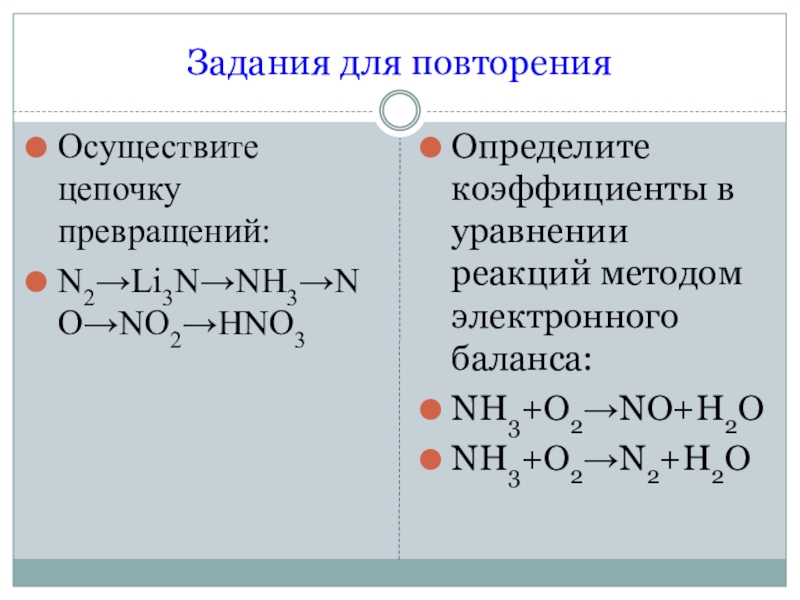
- 2. Задания для повторенияОсуществите цепочку превращений:N2→Li3N→NH3→NO→NO2→HNO3Определите коэффициенты в уравнении реакций методом электронного баланса:NH3+O2→NO+H2ONH3+O2→N2+H2O
- 3. NH3Эта история произошла во время I мировой войны.
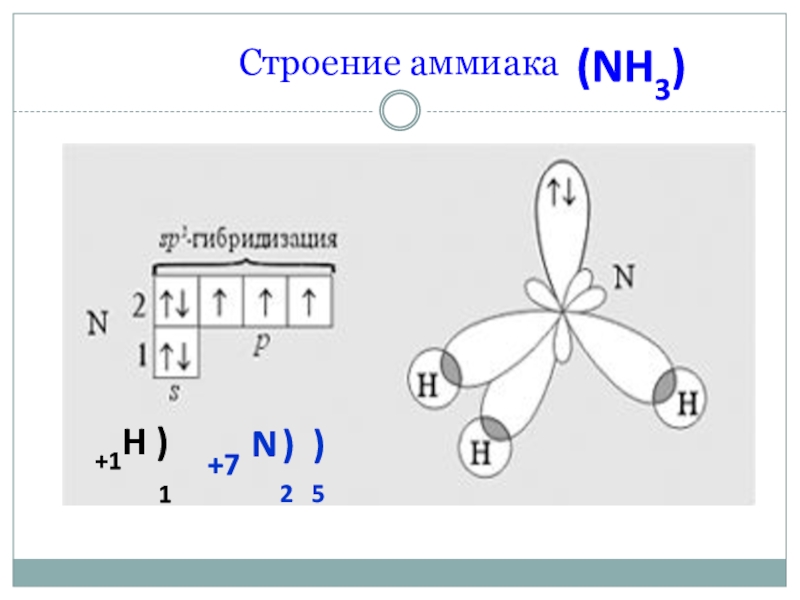
- 4. Строение аммиака+1H ) 1
- 5. Физические свойстваАммиак – это бесцветный газ с
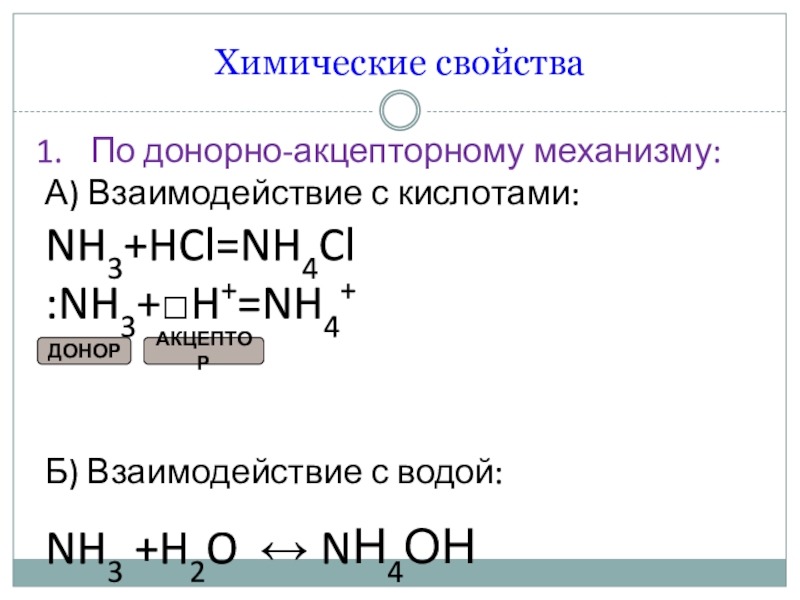
- 6. Химические свойстваПо донорно-акцепторному механизму:А) Взаимодействие с кислотами:NH3+HCl=NH4Cl:NH3+□H+=NH4+Б) Взаимодействие с водой:NH3 +H2O ↔ NН4ОНАКЦЕПТОРДОНОР
- 7. Химические свойства2) Взаимодействие с металлами:2NH3+Na=NaNH2+H23) ОВР:2NH3+O2=2H2O+N22NH3+3Br2=6HBr+N2
- 8. Получение аммиака1) Промышленный: синтез из азота и
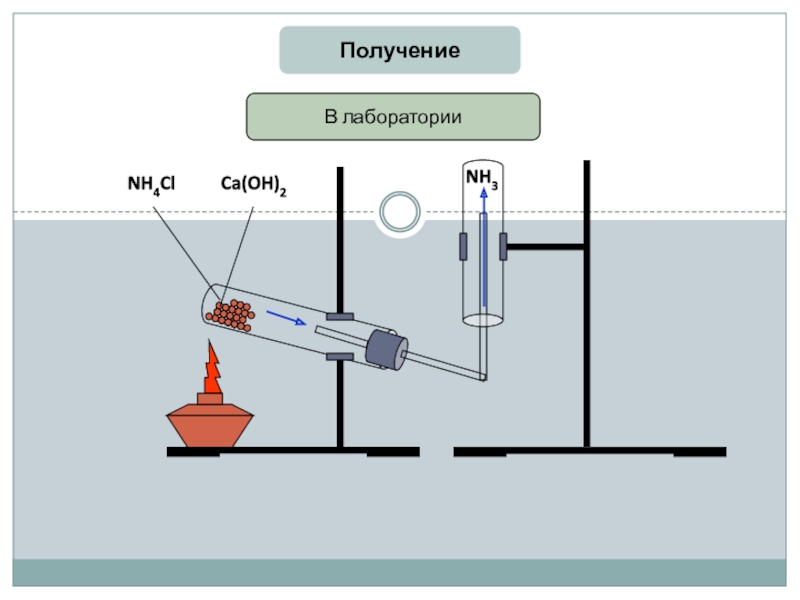
- 9. ПолучениеВ лабораторииNH4ClCa(OH)2NH3
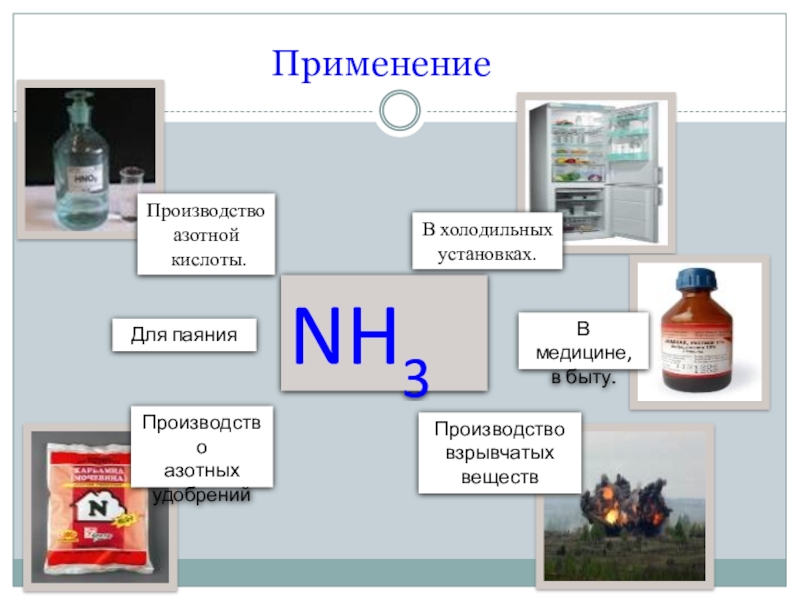
- 10. ПрименениеNH3Производство азотной кислоты.Производство азотных удобренийПроизводство взрывчатых веществВ холодильных установках.В медицине, в быту.Для паяния
- 11. Проверка знаний1.Какую степень окисления имеет азот в
- 12. Домашнее заданиеВыполнить задания презентации
- 13. Скачать презентанцию
Задания для повторенияОсуществите цепочку превращений:N2→Li3N→NH3→NO→NO2→HNO3Определите коэффициенты в уравнении реакций методом электронного баланса:NH3+O2→NO+H2ONH3+O2→N2+H2O
Слайды и текст этой презентации
Слайд 2Задания для повторения
Осуществите цепочку превращений:
N2→Li3N→NH3→NO→NO2→HNO3
Определите коэффициенты в уравнении реакций методом
электронного баланса:
Слайд 5Физические свойства
Аммиак – это бесцветный газ с резким запахом, в
2 раза легче воздуха.
Аммиак нельзя вдыхать продолжительное время, т.к. он
ядовит. Легко сжижается.
При соприкосновении с кожей возникает обморожение различной степени.
Тпл = -780С
Хорошо растворим в воде:
а) 25% раствор – водный аммиак (аммиачная вода)
Б) 10% раствор – нашатырный спирт.
Ткип = -33,50С
Слайд 6Химические свойства
По донорно-акцепторному механизму:
А) Взаимодействие с кислотами:
NH3+HCl=NH4Cl
:NH3+□H+=NH4+
Б) Взаимодействие с водой:
NH3
+H2O ↔ NН4ОН
АКЦЕПТОР
ДОНОР
Слайд 7Химические свойства
2) Взаимодействие с металлами:
2NH3+Na=NaNH2+H2
3) ОВР:
2NH3+O2=2H2O+N2
2NH3+3Br2=6HBr+N2
Слайд 8Получение аммиака
1) Промышленный: синтез из азота и водорода:
N2+3H2↔2NH3
2) Лабораторный:
Са(ОН)2+NH4Cl=CaCl2+NH3+2H2O
Слайд 10Применение
NH3
Производство азотной
кислоты.
Производство
азотных
удобрений
Производство
взрывчатых
веществ
В холодильных
установках.
В медицине,
в быту.
Для паяния
Слайд 11Проверка знаний
1.Какую степень окисления имеет азот в нитрате аммония?
2. Составьте
химические уравнения следующих превращений:
азот→аммиак→хлорид аммония
3.Дополнительное задание: Определите коэффициенты в следующей
схеме химической реакции, используя метод электронного баланса:Cu+NH3→N2+Cu+H2O