Слайд 1Аналитическая химия
(количественный анализ)
ГОУ ВПО «ИГХТУ»
Кафедра аналитической химии
Слайд 2Список литературы:
Базанов М.И., Кочергина Л.А., Чернявская Н.В. и др. Методические
указания и контрольные задания по аналитической химии и ФХМА для
студентов заочного факультета. ИГХТУ. Иваново. 2014. 102 с. (библ. № 481 или на сайте кафедры).
Васильев В.П. Аналитическая химия. Кн. 1. - М.: Высшая школа, 1989.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия, 1985.
Слайд 3Кочергина Л.А., Жуков Ю.А. Лабораторные работы по химическим методам анализа.
(Под ред. Васильева В.П.). Иваново, 1991. (библ. № 370) или
Кочергина Л.А., Черников В.В., Филимонов Д.А. Лабораторный практикум по химическим методам анализа (количественный анализ). ИГХТУ. Иваново. 2011 (на сайте кафедры)
Кочергина Л.А., Орлова Т.Д., Горболетова Г.Г. и др. Задания для экспресс-опроса студентов заочного факультета при изучении курса «Аналитическая химия». ИГХТУ. Иваново. 2009. (библ. № 483 или на сайте кафедры).
Слайд 4Аналитическая химия - наука о методах определения химического состава вещества
и его структуры.
Предметом аналитической химии является разработка методов анализа
и их практическое выполнение, а также широкое исследование теоретических основ аналитических методов.
Слайд 51. Качественный анализ.
2. Количественный анализ. P = f(c)
Р –
аналитический сигнал (измеряемое свойство).
а) Р –V(объем) – титриметрический анализ.
б) Р
– m (массы) – гравиметрический анализ.
Аналитическая химия
Слайд 6Титриметрический анализ
основан на точном измерении объема стандартного раствора, израсходованного на
реакцию с определяемым веществом.
Стандартным раствором называют раствор, концентрация которого известна
с высокой точностью (±0,1%).
Титрование – процесс постепенного прибавления титранта (стандартный раствор) к определяемому веществу для определения точки эквивалентности.
Точка эквивалентности – момент титрования, когда количество титранта химически эквивалентно количеству анализируемого вещества.
Слайд 7Эквивалент – реальная или условная частица, соответствующая одному протону или
другому одноразрядному иону в данной реакции.
Фактор эквивалентности показывает, какая доля
реальной или условной частицы соответствует одному протону или другому однозарядному иону в данной реакции.
Мэкв = fэкв ∙ М(А)
Na2CO3 + HCl = NaHCO3 + NaCl Na2CO3 + 2HCl = H2CO3 + 2NaCl
fэкв(Na2CO3) = 1 fэкв(Na2CO3) = ½
Мэкв = 1 ∙ М(Na2CO3) = 105,99 Мэкв = ½ ∙ М(Na2CO3) = 52,99
Слайд 8Основное правило титриметрических методов анализа
(закон эквивалентов)
В точке эквивалентности число моль
эквивалента титранта равно числу моль эквивалента определяемого вещества
n (титранта) =
n (определяемого вещества)
Слайд 9Способы выражения концентрации
Слайд 11Требования, предъявляемые к реакциям в титриметрическом анализе
Реакция должна протекать с
большой скоростью.
Константа равновесия должна быть велика, т.е. реакция должна протекать
полностью.
Должны отсутствовать побочные реакции.
Возможность фиксирования точки эквивалентности (т.э.).
Слайд 12Приемы титриметрического анализа
прямое титрование;
обратное титрование (титрование по
остатку);
титрование по замещению (титрование
заместителя).
Слайд 131. В методах прямого титрования определяемое вещество непосредственно реагирует с
титрантом.
Типичным примером прямого титрования является титрование щелочи кислотой.
n(NaOH) =
n(HCl)
c(NaOH) ∙ V(NaOH) = c(HCl) ∙ V(HCl)
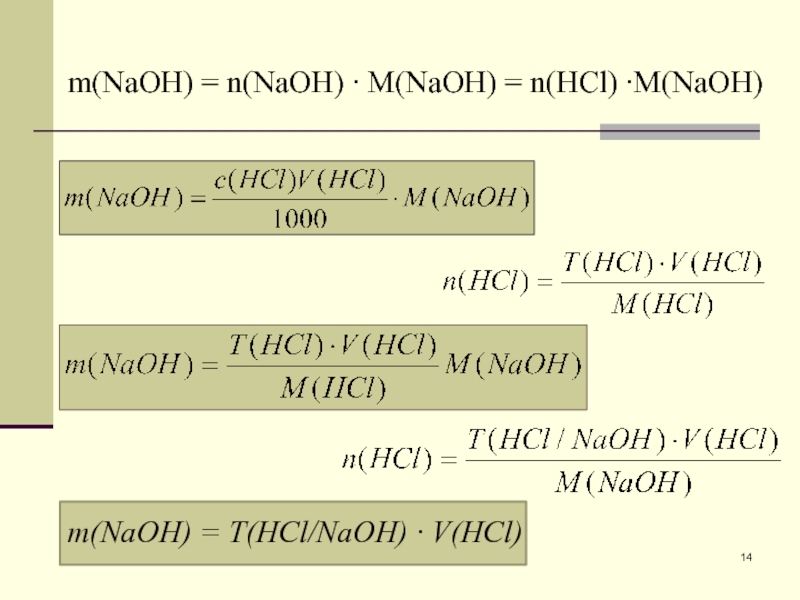
Слайд 14m(NaOH) = Т(HCl/NaOH) ∙ V(HCl)
m(NaOH) = n(NaOH) ∙ M(NaOH) =
n(HCl) ∙M(NaOH)
Слайд 152. В методах обратного титрования используется два титрованных рабочих раствора
— основной и вспомогательный.
Пример 1.
CaCO3 + 2HCl(изб – №1)
= CaCl2+ H2O + CO2 + (HClост)
HClост + NaOH №2 = NaCl + H2O
n(1/2CaCO3) = n(HCl) – n(NaOH)
Слайд 16Пример 2. Определение солей аммония и азота в органических соединениях
по Кьельдалю
а) Н2SO4 изб. + 2NH3 = (NH4)2SO4 + (Н2SO4
ост)
Н2SO4 ост + 2NaOH = Na2SO4 + 2 H2O
n(NH4+) = n(1/2Н2SO4 ) – n(NaOH)
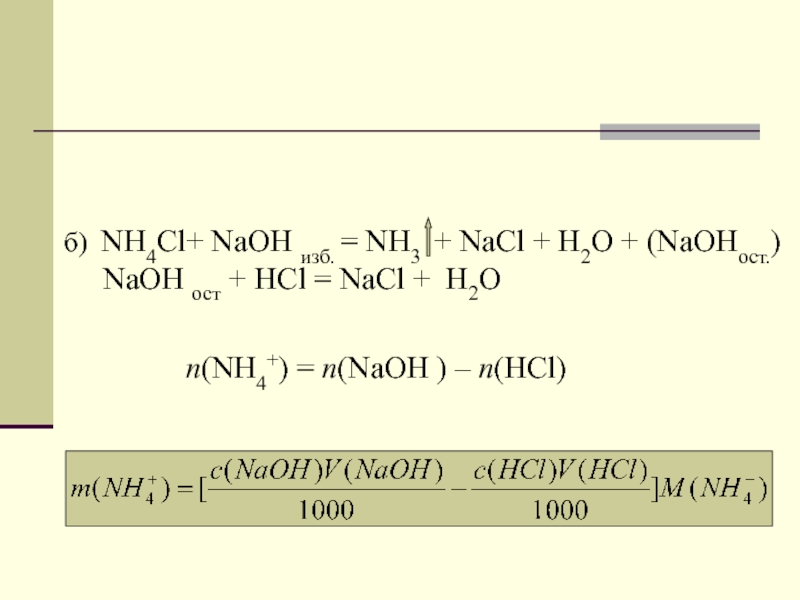
Слайд 17б) NH4Сl+ NaOH изб. = NH3 + NaCl + H2O
+ (NaOHост.)
NaOH ост + HCl = NaCl
+ H2O
n(NH4+) = n(NaOH ) – n(HCl)
Слайд 183. Tитрование заместителя или титрование по замещению
В этом методе
к определяемому веществу добавляют специальный реагент, вступающий с ним в
реакцию. Один из продуктов взаимодействия оттитровывается рабочим раствором.
Слайд 19Примеры:
При иодометрическом определении меди к анализируемому раствору добавляется заведомый избыток
KI и происходит реакция:
2Сu2+ + 4I- = 2CuI + I2
Выделившийся иод оттитровывают тиосульфатом: I2 + 2S2O42- = 2I- + S4O62-
2) Определение NH4+
4NH4+ + 6CH2O = 6(CH2)N4↓ + 4H+ + 6H2O
Образовавшуюся кислоту оттитровывают щелочью.
Слайд 203) Определение Ca:
СaC2O4 + H2SO4 = СaSO4 +
H2C2O4
5H2C2O4 + 2MnO4- + 6H+ =10CO2+ 2Mn2++ 8H2O
n(½CaC2O4) = n(½H2C2O4)
= n(1/5KMnO4)
Слайд 21Методы титриметрического анализа:
I.Кислотно-основное титрование
Н+ +ОН- = Н2О
II. Комплексометрическое титрование
Hg2+ +
2Cl- = HgCl2 (меркуриметрия)
M2+ + H2ЭДТА2- = МЭДТА2- + 2Н+
(комплексонометрия)
III. Осадительное титрование
Аg+ + Cl- = AgCl (аргентометрия)
Hg22++ 2Cl- = Hg2Cl2 (меркурометрия)
IV.Окислительно-восстановительное титрование (редоксиметрия)
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
Слайд 22I. Кислотно-основное титрование
Н+ +ОН- = Н2О
Титранты:
Сильные кислоты - HCl, HNO3,
Н2SO4
Сильные основания - NaOH, KOH
Определяемые вещества: кислоты, основания, соли.
В процессе
титрования происходит изменение рН
pН = - lg aH+ = - lg(H+] ∙ H+); pН - lgH+].
Кривая титрования - это графическая зависимость рН раствора от объема добавленного титранта (рН = f(Vтитранта)).
Слайд 23Индикаторы кислотно-основного титрования
Кислотно-основные индикаторы – это органические соединения сложной структуры,
которые изменяют свою окраску в зависимости от рН раствора.
Слайд 24HInd H+ + Ind-
кр
желт
Интервал pH, при котором индикатор изменяет
свою окраску, называется интервалом перехода индикатора.
Ионная теория
Слайд 25II. Комплексометрическое титрование
Меркуриметрия
Титрант – Hg(NO3)2
Определяемые вещества – Cl-, Br-, SCN-,
CN-
Индикаторы – нитропруссид натрия, дифенилкарбазид, дифенилкарбазон
Hg2+ + 2Г- HgГ2
-
константа устойчивости HgГ2
Слайд 26Простейшим комплексоном является иминодиуксусная кислота:
Для целей количественного анализа наиболее часто
в качестве титранта используется двухзамещенная натриевая соль этилендиаминтетраксусной кислоты –
комплексон III (трилон Б, ЭДТА):
2. Комплексонометрия (хелатометрия)
Основными титрантами являются комплексоны.
Комплексонами называют группу аминополикарбоновых кислот.
Слайд 27Метод комплексонометрии основан на образовании прочных комплексных соединений ионов металлов
с комплексоном III (комплексонатов металлов) в соотношении M:L = 1:1
по схеме:
M2+ + H2Edta2- = MEdta2- + 2H+
M3+ + H2Edta2- = MEdta- + 2H+
Слайд 28Металлохромные индикаторы
Применяются в методе комплексонометрии, представляют собой слабые органические кислоты,
которые образуют окрашенные комплексы с металлами, устойчивость которых ниже, чем
устойчивость соответствующих комплексонатов (мурексид, эриохром черный Т, ксиленовый оранжевый и др.).
Эриохром черный Т (Н3Ind):
рН 6 рН = 810 рН 11
красн голуб оранж
Zn2+ + NH3 + HInd2- = ZnInd- (кр-фиол) + NH4+
ZnInd- + NH3 + H2Y2- = ZnY2- + NH4+ + HInd2-(голуб)
При выборе индикатора необходимо учитывать правило:
Слайд 29Применение метода комплексонометрии
1. Прямое титрование
Zn2+ ; Ca 2+ ;
Ni 2+ ; Co 2+ ; Cd 2+ ; Mg
2+ и др. с аммонийным буфером и эриохромом черным Т.
Fe 3+ ; Zr 4+ - в кислой среде с ксиленовым оранжевым.
Прямое титрование использовать нельзя, если:
а) возможно образование гидроксидов металлов.
б) реакция комплексообразования протекает медленно.
в) нет подходящего металлохромного индикатора.
г) возможно блокирование индикатора.
Слайд 302. Косвенное титрование
а) обратное титрование
M2+ + H2Y2-(изб.)=MY2-+ 2H+ +
(H2Y2-(ост.))
H2Y2-(ост.)+ Zn2+=ZnY2-+ 2H+
n(M2+) = n(H2Y2-) – n(Zn2+)
Определяют: Hg2+, Al3+;
Cr3+ и др.
б) титрование по замещению
M2+ + MgY2- = MY2- + Mg2+
Mg2+ + H2Y2- = MgY2- + 2H+
n(M2+) = n(Mg2+) = n(H2Y2-)
Определяют: Hg 2+, Th4+; Cu 2+ и др.
Слайд 313. Косвенное определение анионов
SO42- + Ba2+(изб.)= BaSO4 + (Ba2+(ост.))
Ba2+(ост.) +
H2Y2- = BaY2- + 2H+
n(SO42-) = n(Ba2+) – n(H2Y2-)
Определяют :
SO4 2-, PO43- и др.
Слайд 32III. Осадительное титрование
Требования к реакциям осаждения:
1. Малая растворимость осадка.
2.
Высокая скорость образования осадков.
3. Явление адсорбции и окклюзии должно
быть минимальным.
4. Возможность фиксирования точки эквивалентности.
Слайд 33Аргентометрия
Титрант – AgNO3.
Ag+ + X- = AgX
ПРAgX=[Ag+][X-];
Определяемые ионы - X = Cl-,
Br-, I-, SCN-.
1. Безиндикаторные методы.
Метод равного помутнения (Гей-Люссака).
2. Метод Мора (индикатор K2CrO4).
Ag+ + Cl- = AgCl
Индикаторная реакция: CrO42- + 2Ag+ = Ag2CrO4
кирпично-красный
Условия: рН 6,510 осадок
рН 6,5 CrO42- + Н+ = НCrO4-
рН 10 Ag2O (черный осадок)
Слайд 343. Метод Фольгарда (тиоционатометрия)
Индикатор -
Обратное титрование (рабочие растворы-AgNO3, КSCN
или NH4SCN):
Cl- + Ag+(изб) AgCl + Ag+(ост)
Ag+(ост) + SCN-
AgSCN
Индикаторная реакция: Fe3+ + nSCN-(изб) =
n (Cl-)= n (Ag+) -n (SCN-)
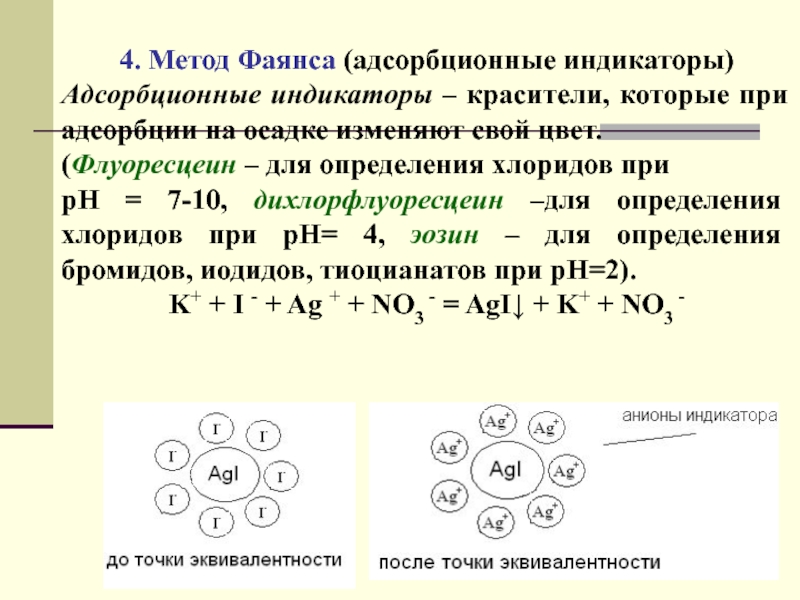
Слайд 354. Метод Фаянса (адсорбционные индикаторы)
Адсорбционные индикаторы – красители, которые при
адсорбции на осадке изменяют свой цвет.
(Флуоресцеин – для определения
хлоридов при
рН = 7-10, дихлорфлуоресцеин –для определения хлоридов при рН= 4, эозин – для определения бромидов, иодидов, тиоцианатов при рН=2).
K+ + I - + Ag + + NO3 - = AgI + K+ + NO3 -
Слайд 36IV. Окислительно-восстановительное титрование
Фактор эквивалентности – доля условной или реальной частицы,
которая соответствует 1 электрону в окислительно-восстановительной реакции.
fэкв(Fe2+) = 1
В
реакциях окисления-восстановления существует 2 редокс-пары.
Окислительно-восстановительная система характеризуется окислительно-восстановительным потенциалом.
Слайд 38Величина Е зависит от следующих факторов:
t;
Концентрация;
Величина рН;
От
реакций протекающих совместно:
Слайд 39Методы окислительно-восстановительного титрования
Перманганатометрия
KMnO4 (безиндикаторный);
Иодометрия
I2 , Na2S2O3 (индикатор - крахмал);
Хроматометрия
K2Cr2O7 (индикатор - дифениламин);
Броматометрия KBrO3 (индикаторы - метиловый оранжевый, метиловый красный).
Слайд 40Гравиметрический анализ
Гравиметрический метод анализа основан на измерении массы вещества, полученного
в результате химической реакции.
а) Метод отгонки.
Состоит в переводе одного
из компонентов в летучее соединение и его последующем удалении
б) Метод осаждения.
Состоит в выделении определяемого вещества в осадок в виде малорастворимого соединения.
Слайд 41Определение сульфата
гравиметрическая форма и форма осаждения
F – фактор перерасчета
Погрешность
метода не более 0,5%, масса определяемого вещества 0,011,00 гр., при
процентном отношении не менее 0,1%.






























![Аналитическая химия (количественный анализ) АргентометрияТитрант – AgNO3.Ag+ + X- = AgX ПРAgX=[Ag+][X-]; Определяемые АргентометрияТитрант – AgNO3.Ag+ + X- = AgX ПРAgX=[Ag+][X-]; Определяемые ионы - X](/img/thumbs/e98e28faef528d1114962b070d587b98-800x.jpg)