Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аналитическая химия Анионы I аналитической группы SO 4 -2 ; SO 3 -2 ; S 2 O 3
Содержание
- 1. Аналитическая химия Анионы I аналитической группы SO 4 -2 ; SO 3 -2 ; S 2 O 3
- 2. Действие группового реактива ВаСl2
- 3. Слайд 3
- 4. Na2S2O3 + BaCl2 = BaS2O3↓ + 2NaCl
- 5. Na2C2O4 + BaCl2 = BaC2O4↓ + 2NaCl
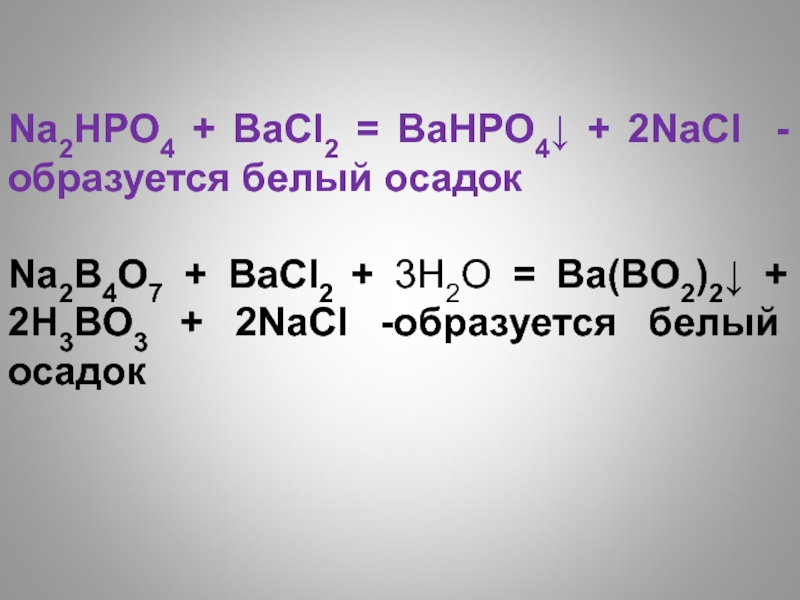
- 6. Na2HPO4 + BaCl2 = BaHPO4↓ + 2NaCl
- 7. Аналитические реакции на SO4 -2Реакция МКС с
- 8. 2.Реакция с солями свинца Pb(NO3)2 или ацетатом
- 9. Аналитические реакции на SO3-2Реакция с минеральными кислотами
- 10. 2.Реакция с окислителями: а) с перманганатом калия
- 11. в)с йодной или бромной водойNa2SO3 + J2
- 12. 3. Реакция с нитратом серебра АgNO3:Na2SO3 + АgNO3 =Аg2SO3↓ + 2NaNO3 – образуется белый осадок
- 13. 5. Реакция с соляной кислотой НСl:Na2SO3 +
- 14. Аналитические реакции на CO3-21.Реакция с раствором соляной
- 15. Аналитические реакции на НPO4-21.Реакция с нитратом серебра
- 16. 2.Реакция с магнезиальной смесью:
- 17. 3.Реакция с молибдатом аммония (NH4)2MоO4:Na3PO4 + 3NH4Cl
- 18. Аналитические реакции на S2O3-21.Реакция с соляной кислотой
- 19. 2AgNO3 + Na2S2O3 = Ag2S2O3↓ + 2NaNO3
- 20. 3. Реакция с йодом J2 :2Na2S2O3 +
- 21. Аналитические реакции на CrO4-21.Реакция с нитратом серебра
- 22. 2.Реакция с ацетатом свинца Pb(CH3COO)2K2CrO4 + Pb(CH3COO)2
- 23. 3.Реакция с пероксидом водорода H2O2 проводится в
- 24. 4. Реакция с соляной кислотой :
- 25. Аналитические реакции на C2O4-2Реакция с хлоридом кальция
- 26. 2.Реакция с перманганатом калия KMnO4:5(NH4)2C2O4 + 2KMnO4
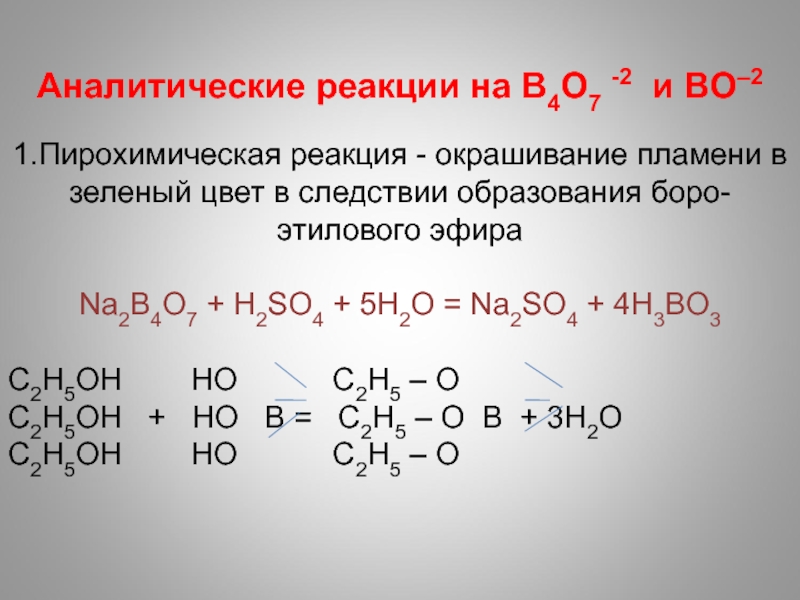
- 27. Аналитические реакции на B4O7 -2 и BO–2
- 28. Анионы II аналитической группыCl - ,Br - , J-, S2-
- 29. Действие группового реагента
- 30. Действие группового реагента 1.KCl + AgNO3 =
- 31. 2.KBr + AgNO3 = AgBr↓ + KNO3
- 32. 3.KJ + AgNO3 = AgJ↓ + KNO3
- 33. 4.Nа2S + 2AgNO3 = Ag2S↓ + 2NаNO3 – образуется осадок черного цвета.
- 34. Характерные аналитические реакции на анионы II аналитической группы
- 35. Аналитические реакции на Cl –:Реакция с окислителями
- 36. Аналитические реакции на Br - :1.Реакция с
- 37. Аналитические реакции на J2- :Реакция с окислителями
- 38. б) можно использовать окислители KMnO4, MnO2, и
- 39. 2. Реакция с раствором нитрата свинца:2KJ +
- 40. 3. Реакция с концентрированной серной кислотой Н2SO4
- 41. Аналитические реакции на S 2- Реакция с
- 42. 2. Реакция с окислителями с КМnО4 в
- 43. Характерные аналитические реакциина анионы III аналитической группы
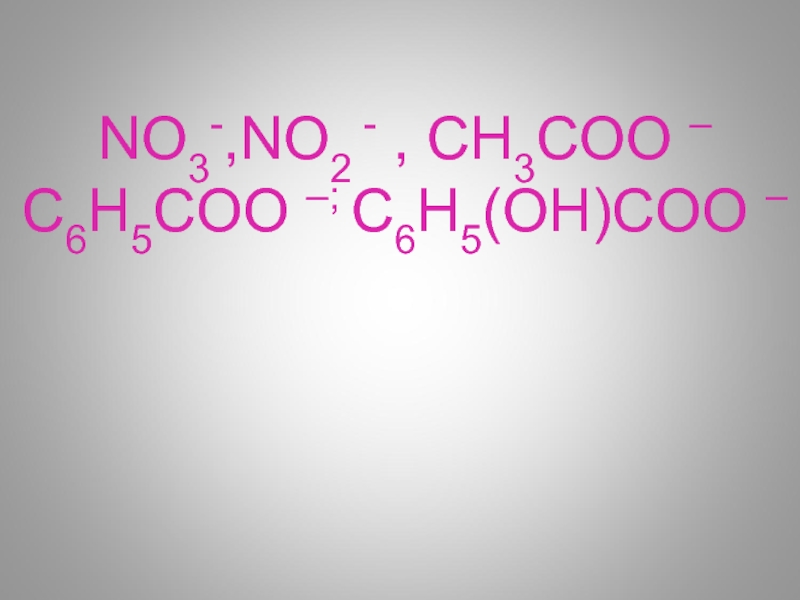
- 44. NO3-,NO2 - , СН3CОО –С6Н5CОО –; С6Н5(ОН)CОО –
- 45. Аналитические реакции на NO3- :1.Реакция с
- 46. 2.Реакция с медью и серной кислотой:2НNO3 +
- 47. 3.Реакция восстановления до аммиака:3NаNO3 + 8Аl +
- 48. 4.Реакция с дифениламином в кислой среде – характерное синее окрашивание
- 49. Аналитические реакции на NO2 - 1.Реакция
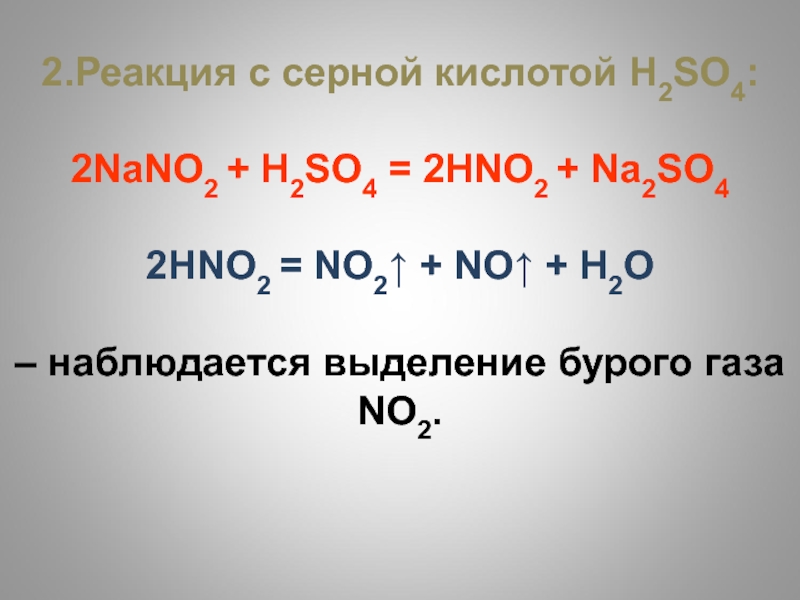
- 50. 2.Реакция с серной кислотой Н2SO4:2NаNО2 + Н2SO4
- 51. 3. Реакция с сульфатом железа FeSO4: 2NаNО2
- 52. Аналитические реакции на СН3CОО -1.Реакция с кислотами:СН3СООNа
- 53. 2.Реакция этерификации уксусной кислоты с этанолом:СН3СООН +
- 54. 3.Реакция с хлоридом железа FeСl3 :3СН3СООNа +
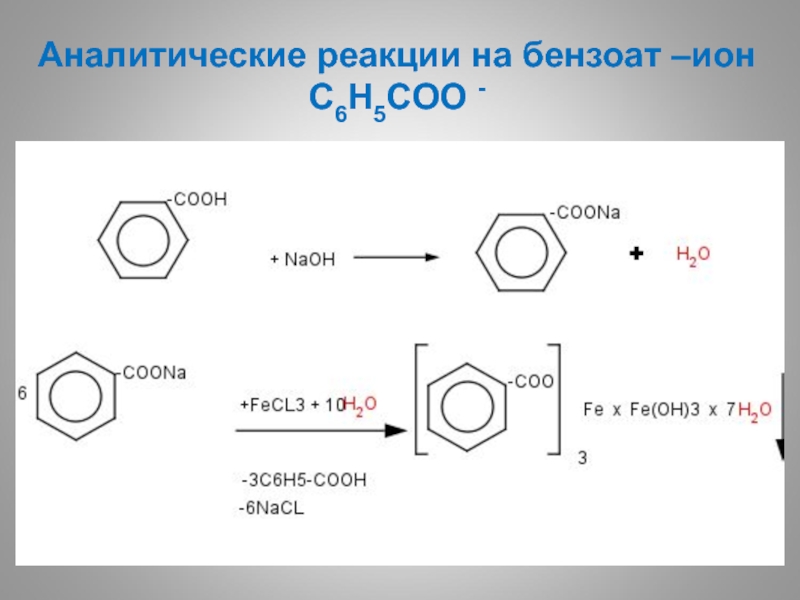
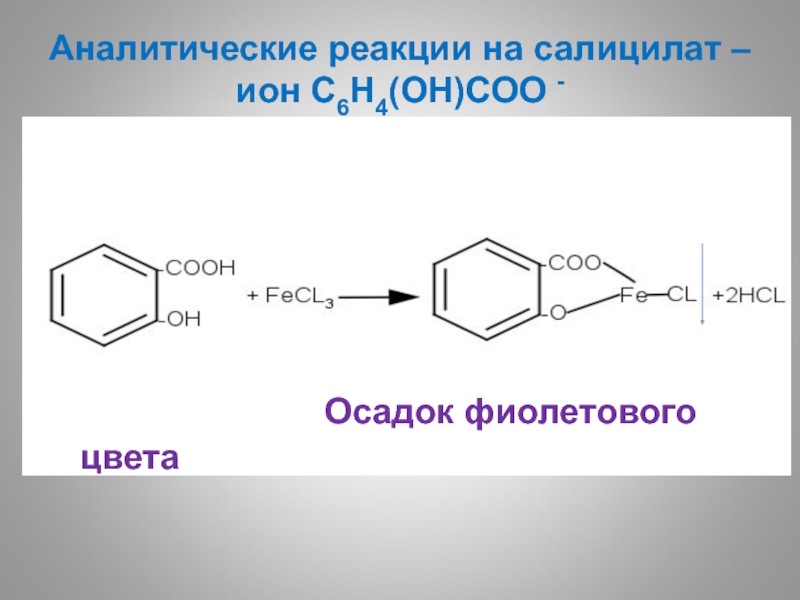
- 55. Аналитические реакции на бензоат –ион С6Н5CОО - Осадок телесного цвета
- 56. Аналитические реакции на салицилат – ион С6Н4(ОН)CОО
- 57. Скачать презентанцию
Действие группового реактива ВаСl2
Слайды и текст этой презентации
Слайд 1Аналитическая химия
Анионы I аналитической группы
SO4 -2; SO3-2; S2O3-2; CO3-2;
C2O4-2;
PO4-3; CrO4-2 ;
Слайд 3
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl - образуется
белый осадок
Na2SO3 + BaCl2 = BaSO3↓ + 2NaCl - образуется
белый осадок Слайд 4
Na2S2O3 + BaCl2 = BaS2O3↓ + 2NaCl - образуется белый
осадок
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl -
образуется белый осадок Слайд 5Na2C2O4 + BaCl2 = BaC2O4↓ + 2NaCl - образуется
белый осадок
Na2CrO4 + BaCl2 = BaCrO4↓ + 2NaCl
- образуется желтый осадокСлайд 6Na2HPO4 + BaCl2 = BaHPO4↓ + 2NaCl - образуется белый
осадок
Na2B4O7 + BaCl2 + 3H2O = Ba(BO2)2↓ + 2H3BO3
+ 2NaCl -образуется белый осадок Слайд 7
Аналитические реакции на SO4 -2
Реакция МКС с солями кальция Са(NО3)2:
Na2SO4
+ Са(NО3)2 = СаSO4↓ + 2Na NО3
– на предметном
стекле образуются характерные кристаллы гипса СаSO4 ٠5Н2О в виде игольчатых пучков.Слайд 8
2.Реакция с солями свинца Pb(NO3)2 или ацетатом свинца (CH3COO)2Pb:
Na2SO4 +
Pb(NO3)2 = PbSO4↓ + 2NaNO3 –
образуется белый осадок, растворимый
в ацетате аммония CH3COONH4:2PbSO4 + 2CH3COONH4 =
[Pb (CH3COO)2 ٠ PbSO4] + (NH4)2 SO4
Слайд 9
Аналитические реакции на SO3-2
Реакция с минеральными кислотами и сухими сульфитами,
например с HCl:
Na2SO3 + 2HCl = 2NaCl + H2SO3
H2SO3 =
SO2↑+ H2O - появляется резкий запах SO2↑(горящей серы)
Слайд 10
2.Реакция с окислителями:
а) с перманганатом калия KMnO4
5 Na2SO3 +
2KMnO4 + 8 H2SO4 = 2MnSO4 + K2SO4 + 5
Na 2SO4 + 8Н2О - наблюдается обесцвечивание раствора перманганата калияСлайд 11
в)с йодной или бромной водой
Na2SO3 + J2 + H2O =
Na2SO4 + 2HJ - наблюдается обесцвечивание
Na2SO3 + Br2 + H2O = Na2SO4 + 2HBr - наблюдается обесцвечивание
Определению мешают ионы S -2; NO3 -.
Слайд 12
3. Реакция с нитратом
серебра АgNO3:
Na2SO3 + АgNO3 =Аg2SO3↓ +
2NaNO3
– образуется белый осадок
Слайд 13
5. Реакция с соляной кислотой НСl:
Na2SO3 + 2HCl = 2NaCl
+ H2SO3
H2SO3 = SO2↑+ H2O
Резкий запах
Слайд 14Аналитические реакции на CO3-2
1.Реакция с раствором соляной кислоты:
Na2CO3 +
2 HCl = 2NaCl + H2O + CO2↑
CO2 + Ca(OH)2
= CaCO3↓ + H2O – наблюдается помутнение раствора, реакции
Слайд 15
Аналитические реакции на НPO4-2
1.Реакция с нитратом серебра АgNO3:
3AgNO3 + Na2HPO4
= Ag3PO4↓ +
HNO3 + 2NaNO3
- образуется жёлтый
осадок, растворимый в HNO3Слайд 16
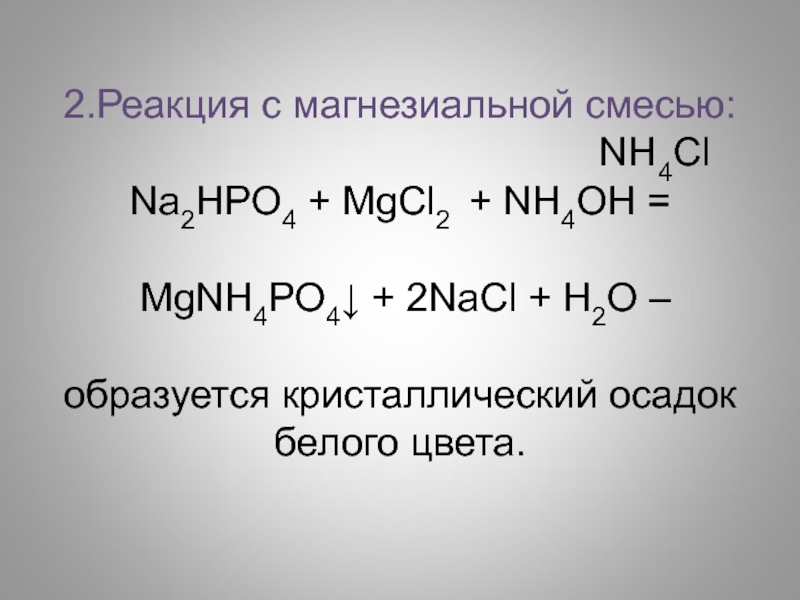
2.Реакция с магнезиальной смесью:
NH4Cl
Na2HPO4 + МgCl2 + NH4ОН =
МgNH4PO4↓ + 2NaCl + H2O –
образуется кристаллический осадок белого цвета.
Слайд 17
3.Реакция с молибдатом аммония (NH4)2MоO4:
Na3PO4 + 3NH4Cl + 12(NH4)2MоO4 +
24HNO3 = (NH4)3H4[P(Mо2O7)6 ]↓ +
10 H2O + 24NH4NO3 +
2NaCl – образуется жёлтый кристаллический осадок фосформолибдата
аммония, который растворяется в щелочах при нагревании.
Слайд 18
Аналитические реакции на S2O3-2
1.Реакция с соляной кислотой HCl:
Na2S2O3 + 2HCl
= 2NaCl + H2S2O3
H2S2O3 = H2O + S↓ + SO2
↑- наблюдается помутнение раствора в следствии выделения свободной серы и образования сернистого газа с резким запахом. В разбавленных кислотах реакция идет медленно 2-10 минут.
Слайд 192AgNO3 + Na2S2O3 = Ag2S2O3↓ + 2NaNO3 – белый осадок,
который распадается с образованием:
Ag2S2O3 = Ag2SO3 +S↓
- желтый осадокAg2SO3 + S + H2O = Ag2S↓ + H2SO4 - черный осадок
Слайд 20
3. Реакция с йодом J2 :
2Na2S2O3 + J2 = Na2S4O6
+ 2NaJ –
наблюдается обесцвечивание раствора йода. Реакция проводят в
присутствии крахмала.Слайд 21
Аналитические реакции на CrO4-2
1.Реакция с нитратом серебра АgNO3:
K2CrO4 + 2AgNO3
= 2KNO3 + Ag2CrO4↓ -
образуется осадок красно-бурого цвета, растворимый
в HNO3Слайд 22
2.Реакция с ацетатом свинца Pb(CH3COO)2
K2CrO4 + Pb(CH3COO)2 = PbCrO4↓ +
2CH3COOK –
образуется осадок ярко- желтого цвета, растворимый в щелочах
HNO3, не растворим в CH3COOНСлайд 23
3.Реакция с пероксидом водорода H2O2 проводится в присутствии хлороформа или
эфира:
2K2CrO4 + 2HCl = K2Cr2O7 + H2O + 2KCl –
образуется раствор оранжевого цвета:
K2Cr2O7 + 4H2O2 + 2HCl = 2H2CrO6 + 2KCl + 3H2O
– образуется надхромовая кислота , которая окрашивает хлороформный или эфирный слой в синий цвет
Слайд 24
4. Реакция с соляной кислотой :
2K2CrO4 + 2HCl = K2Cr2O7 + H2O + 2KCl –
образуется раствор оранжевого цвета:
Слайд 25
Аналитические реакции на C2O4-2
Реакция с хлоридом кальция CaCl2:
CaCl2 + (NH4)2C2O4
= CaC2O4↓ + 2NH4Cl -
образуется белый, мелкокристаллический осадок, растворимый
минерал. кислотахСлайд 26
2.Реакция с перманганатом калия KMnO4:
5(NH4)2C2O4 + 2KMnO4 + 8H2SO4 =
2MnSO4 + K2SO4 + 5(NH4)2SO4 +
10CO2↑+ 8H2O -
происходит
обесцвечивание раствора KMnO4 Слайд 27
Аналитические реакции на B4O7 -2 и BO–2
1.Пирохимическая реакция -
окрашивание пламени в зеленый цвет в следствии образования боро-этилового эфира
Na2B4O7
+ H2SO4 + 5H2O = Na2SO4 + 4H3BO3C2H5OH HO C2H5 – O
C2H5OH + HO В = C2H5 – O В + 3Н2О
C2H5OH HO C2H5 – O
Слайд 30Действие группового реагента
1.KCl + AgNO3 = AgCl↓ + KNO3
–
образуется белый творожистый осадок, который на свету темнеет в
следствии образования микрокристаллов свободного серебра. Осадок растворяется в избытке гидроксида аммония NH4ОН:AgCl + 2NH4ОН = Ag[( NH3)2]Cl + 2Н2О
Слайд 31
2.KBr + AgNO3 = AgBr↓ + KNO3 –
образуется осадок
желтоватого цвета, который растворяется в тиосульфате натрия с образованием бесцветного
комплексного соединения:AgBr + Na2S2O3 = [ AgS2O3 ]Na + NaBr
Не растворяется в азотной кислоте, частично растворяется в аммиаке.
Слайд 32
3.KJ + AgNO3 = AgJ↓ + KNO3
- образуется осадок
ярко - желтого цвета.
Не растворяется в азотной кислоте и
аммиаке.Слайд 35
Аналитические реакции на Cl –:
Реакция с окислителями КМnО4 в кислой
среде:
10KCl + 2КМnО4 + 8Н2SO4 = 5Cl2↓ + 2 МnSО4
+ 6К2SO4 + 8Н2О - обесцвечивание раствора КМnО4 и появление резкого запаха газообразного хлора.
Слайд 36Аналитические реакции на Br - :
1.Реакция с окислителями (с хлорной
водой) в присутствии хлороформа или бензола:
Cl2 + 2KBr =
Br2↓ + 2KCl - хлороформовый или бензольный слой окрашивается в жёлто - оранжевый цвет.
Слайд 37
Аналитические реакции на J2- :
Реакция с окислителями (с хлорной водой)
в присутствии хлороформа или бензола:
а) Cl2 + 2KJ =
J2↓ + 2KCl - хлороформовый или бензольный слой окрашивается
в фиолетовый цвет.
Слайд 38
б) можно использовать окислители KMnO4, MnO2, и т.д.:
10KJ + 2КМnО4
+ 8Н2SO4 = 5J2↓ + 2 МnSО4 + 6К2SO4 +
8Н2ОСлайд 39
2. Реакция с раствором нитрата свинца:
2KJ + Рb(NО3)2 = РbJ2↓
+ 2КNО3
- образуется осадок желтого цвета
Слайд 40
3. Реакция с концентрированной серной кислотой Н2SO4 (фармакопейная):
2НJ + Н2SO4
= J2 ↑+ SO2↑ +2 Н2О
– при нагревании образуются
фиолетовые пары йода.Слайд 41
Аналитические реакции на S 2-
Реакция с серной кислотой H2SO4:
Na2S
+ H2SO4 = H2S↑ + Na2SO4
- появляется неприятный
запах сероводорода (тухлых яиц) , почернение фильтровальной бумажки, смоченной Pb (CH3COO)2 Pb (CH3COO)2 + H2S = PbS↓ + 2CH3COOH
Слайд 42
2. Реакция с окислителями
с КМnО4 в кислой среде:
5H2S +
2КМnО4 + 3Н2SO4 = 5S↓ + 2МnSО4 + К2SO4 +
8Н2О- обесцвечивание раствора КМnО4 и его помутнение в следствии образования свободной серы.
Слайд 45
Аналитические реакции на NO3- :
1.Реакция с сульфатом железа (II)
FeSO4:
2НNO3 + 6FeSO4 + 3Н2SO4 = 3Fe2(SO4)3 + 4Н2О +
2NO↑FeSO4 + NO = [Fe (NO)SO4]
– в сильнокислой среде железо (II) восстанавливает нитрат-ион до NO, который образует нестойкий нитрозильный комплекс коричневого цвета.
Слайд 46
2.Реакция с медью и серной кислотой:
2НNO3 + 3Сu + 3Н2SO4
= 3СuSO4 + 2NO↑ + 4Н2О
– при нагревании смеси
наблюдается выделение бурого газа диоксида азота NO2:2NO + О2 = 2NO2↑
Слайд 47
3.Реакция восстановления до аммиака:
3NаNO3 + 8Аl + 5NаОН + 2Н2О
= 3NН3↑ + 8NаАlО2
–образование аммиака можно заметить по резкому
запаху или по покраснению влажной фенолфталеиновой бумажки или по посинению красной лакмусовой бумажки.Слайд 49
Аналитические реакции на NO2 -
1.Реакция с иодидом калия
КJ в присутствии хлороформа или бензола:
2КNО2 + 2КJ + 2Н2SO4
= 2К2SO4 + 2NO↑ + J2↑ + 2Н2О – образуется фиолетовое окрашивание хлороформового слоя в следствии выделения J2 или по характерному синему окрашиванию при добавлении крахмала.
Слайд 50
2.Реакция с серной кислотой Н2SO4:
2NаNО2 + Н2SO4 = 2НNО2 +
Nа2SO4
2НNО2 = NO2↑ + NO↑ + Н2О
– наблюдается выделение
бурого газа NO2.Слайд 51
3. Реакция с сульфатом железа FeSO4:
2NаNО2 + 2FeSO4 +
2Н2SO4 = Nа2SO4 + Fe2(SO4)3 + 2NO↑ + 2Н2О
FeSO4 +
NO = [Fe NO] SO4 – образуется бурое кольцо.
Слайд 52
Аналитические реакции на СН3CОО -
1.Реакция с кислотами:
СН3СООNа + НСl =
СН3СООН + NаСl
– появляется характерный запах уксусной кислоты.
Слайд 53
2.Реакция этерификации уксусной кислоты с этанолом:
СН3СООН + С2Н5ОН = СН3СООС2Н5
+ Н2О
– образуется этиловый эфир уксусной кислоты , появляется
запах антоновских яблок (содержимое влить в холодную воду).Слайд 54
3.Реакция с хлоридом железа FeСl3 :
3СН3СООNа + FeСl3 = (СН3СОО)3Fe
+ 3NаСl
появляется красно-бурое окрашивание, которое вследствие разбавления водой
и нагревании переходит в основную соль в виде красно-бурых хлопьев:
(СН3СОО)3Fe + 2Н2О =Fe(ОН)2СН3СОО + 2СН3СООН














![Аналитическая химия
Анионы I аналитической группы
SO 4 -2 ; SO 3 -2 ; S 2 O 3 3.Реакция с молибдатом аммония (NH4)2MоO4:Na3PO4 + 3NH4Cl + 12(NH4)2MоO4 + 24HNO3 3.Реакция с молибдатом аммония (NH4)2MоO4:Na3PO4 + 3NH4Cl + 12(NH4)2MоO4 + 24HNO3 = (NH4)3H4[P(Mо2O7)6 ]↓ + 10 H2O](/img/thumbs/0d67545574621604aafefdd7d34a5144-800x.jpg)