Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азотсодержащие органические вещества
Содержание
- 1. Азотсодержащие органические вещества
- 2. Амины это производные аммиака (NH3), в молекуле
- 3. Примеры аминов Н – N – H
- 4. Классификация аминовПо количеству радикалов 1) Первичные
- 5. Классификация аминовПо характеру радикалов:1) предельные2) непредельные3) ароматические4) смешанные
- 6. Предельные первичные аминыэто органические вещества, состоящие из
- 7. Физические свойстваС1 – С4– газы с запахом
- 8. Химические свойства 1) Горение
- 9. Вывод: Амины – органические основанияПолучение аминов
- 10. Применение аминов
- 11. 1. Краски, лаки
- 12. 2. Лекарства
- 13. 3. Резина
- 14. 4. Химическая промышленность
- 15. Анилин(фениламин) - это ароматический амин, состоящий из
- 16. История создания1840 г. – Ю.Ф.Фрицше обнаружил, что
- 17. СтроениеC6H5NH2 - анилин
- 18. Физические свойстваАнилин - бесцветная маслянистая жидкость.При окислении
- 19. ПолучениеВ промышленности (восстановление нитробензола атомарным водородом металлами
- 20. Химические свойства 1. Горение4 С6Н5NH2 + 31
- 21. Химические свойства3. Реакции по бензольному кольцу – бромирование (выпадает белый осадок)
- 22. Химические свойстваНитрование:C6H5NH2+NaNO2+2HCl [C6H5-NN]+Cl- +NaCl + 2H2Oхлорид
- 23. ПрименениеВ настоящий момент в мире основная часть
- 24. ПрименениеОсновная область применения анилина – синтез красителей
- 25. 1. Красители
- 26. 2. Пластмассы
- 27. 3. Синтетические каучуки
- 28. 4. Ядохимикаты
- 29. 5. Лекарственные препараты
- 30. 6. Взрывчатые вещества
- 31. СПАСИБО ЗА ВНИМАНИЕ
- 32. Скачать презентанцию
Амины это производные аммиака (NH3), в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
Слайды и текст этой презентации
Слайд 1Радионов Виктор Петрович
учитель химии и биологии
МОУ «Школа №9 г.Тореза»
Азотсодержащие
органические
вещества
Слайд 2Амины
это производные аммиака (NH3), в молекуле которого один, два
или три атома водорода замещены на углеводородные радикалы.
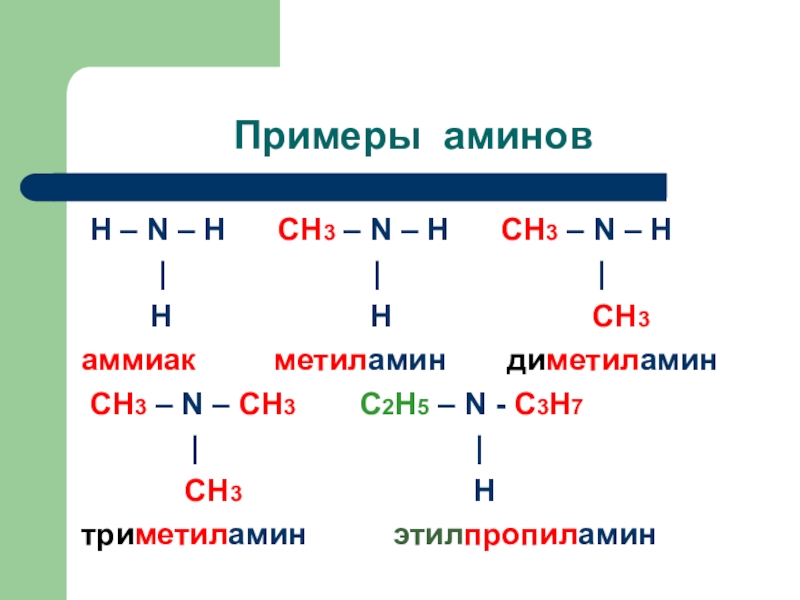
Слайд 3Примеры аминов
Н – N – H CH3
– N – H CH3 – N –
H| | |
H H CH3
аммиак метиламин диметиламин
CH3 – N – СH3 С2Н5 – N - C3H7
| |
СH3 H
триметиламин этилпропиламин
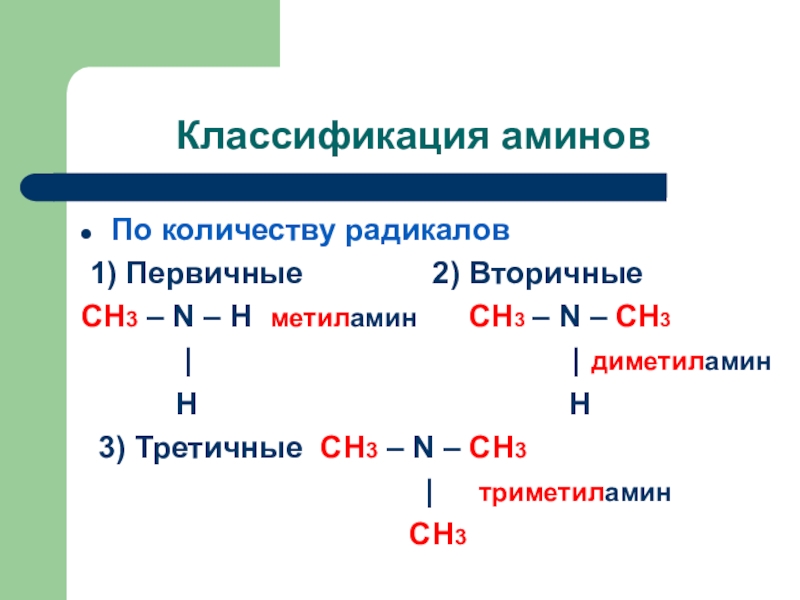
Слайд 4Классификация аминов
По количеству радикалов
1) Первичные
2) Вторичные
CH3 – N – H метиламин
CH3 – N – СH3 | | диметиламин
Н Н
3) Третичные CH3 – N – СH3
| триметиламин
СН3
Слайд 5Классификация аминов
По характеру радикалов:
1) предельные
2) непредельные
3) ароматические
4) смешанные
Слайд 6Предельные первичные амины
это органические вещества, состоящие из предельного радикала и
аминогруппы –NH2
R - NH2 общая формула
СН3 – NH2 - метиламин C2H5 - NH2 - этиламин
C3H7 - NH2 - пропиламин
C4H9 - NH2 - бутиламин
Слайд 7Физические свойства
С1 – С4– газы с запахом аммиака, хорошо растворимы
в воде.
С5 - С9 – жидкости с запахом испорченной рыбы,
в воде не растворяются.С10 … - твердые вещества.
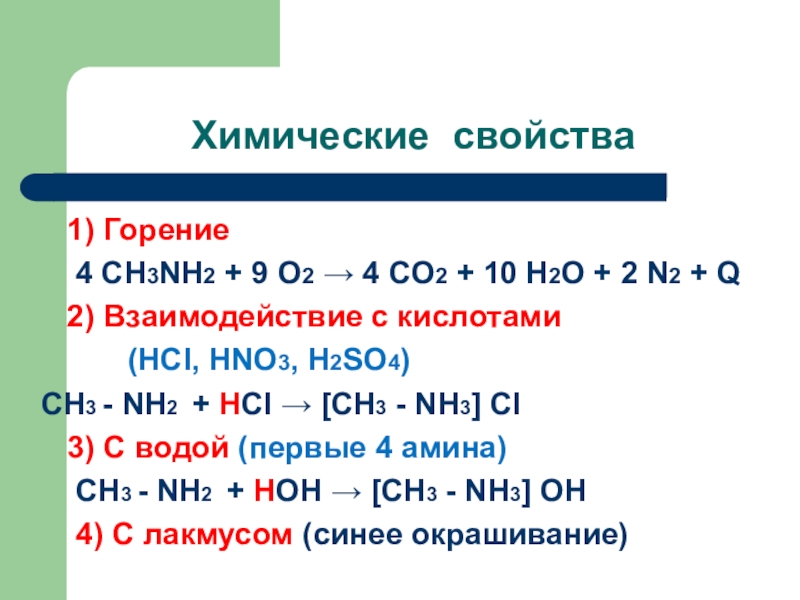
Слайд 8Химические свойства
1) Горение
4 СН3NH2 +
9 O2 → 4 CO2 + 10 H2O + 2
N2 + Q2) Взаимодействие с кислотами
(HCI, HNO3, H2SO4)
СН3 - NH2 + HCI → [СН3 - NH3] CI
3) С водой (первые 4 амина)
СН3 - NH2 + HОН → [СН3 - NH3] ОН
4) С лакмусом (синее окрашивание)
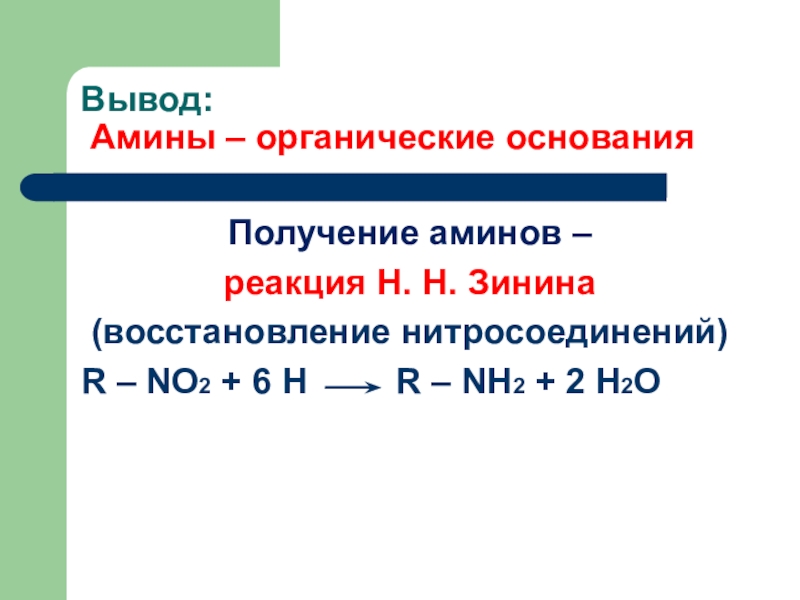
Слайд 9Вывод:
Амины – органические основания
Получение аминов –
реакция Н. Н. Зинина
(восстановление
нитросоединений)
R – NO2 + 6 H
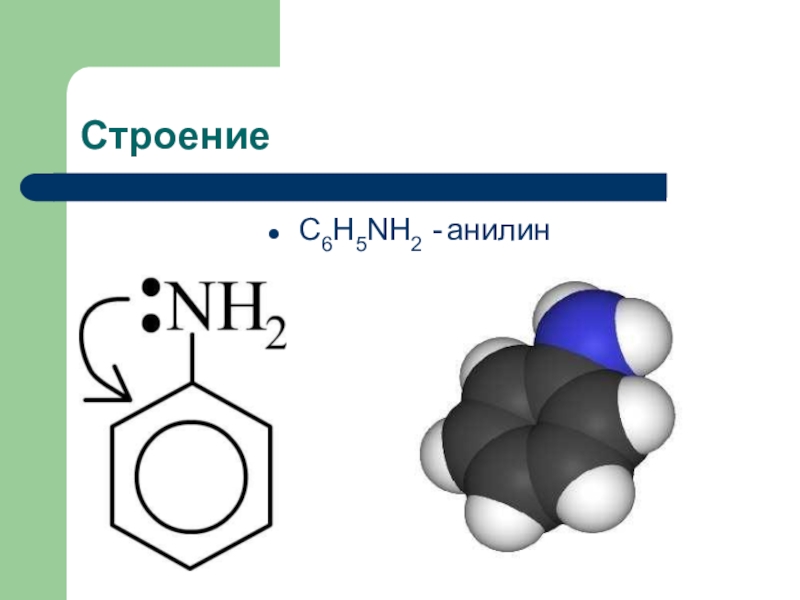
R – NH2 + 2 H2O Слайд 15Анилин(фениламин)
- это ароматический амин, состоящий из бензольного кольца и
аминогруппы
- NH2
─ NH2 или С6Н5 - NH2 Слайд 16История создания
1840 г. – Ю.Ф.Фрицше обнаружил, что при нагревании с
щелочью синяя окраска индиго исчезает и образуется вязкая масса коричневого
цвета. Очистив это в-во, Фрицше получил быстро желтеющую на воздухе маслянистую жидкость и назвал её анилином.Примерно в то же время О.Унфердорбен нагреванием кристаллического индиго получил продукт, который он назвал кристаллином.
Фридлиб Фердинанд Рунге в продуктах перегонки каменноугольной смолы открыл в-во, названное им кианолом.
Н.Н.Зинин в 1841 году открыл способ восстановления нитробензола до соответствующего ароматического амина – бензидама.
1843 г. – Гофман установил, что бензидам, кианол, кристаллин и анилин – одно и то же соединение. Остановились на анилине.
Слайд 18Физические свойства
Анилин - бесцветная маслянистая жидкость.
При окислении на воздухе становится
светло-коричневого цвета.
Немного тяжелее воды, малорастворим в ней.
Хорошо растворяется в этаноле
и бензоле.Температура кипения + 174 С.
Проявляет слабые основные свойства.
Ядовит. Канцероген.
Слайд 19Получение
В промышленности
(восстановление нитробензола атомарным водородом металлами в кислой среде)
– реакция Н. Н. Зинина
C6H5NO2 + 3H2 250-300C,Ni,Cu C6H5NH2 +
2H2Oнитробензол
C6H5NO2 + 6H Fe,HCl,H2O C6H5NH2 + 2H2O (Зинин, 1842)
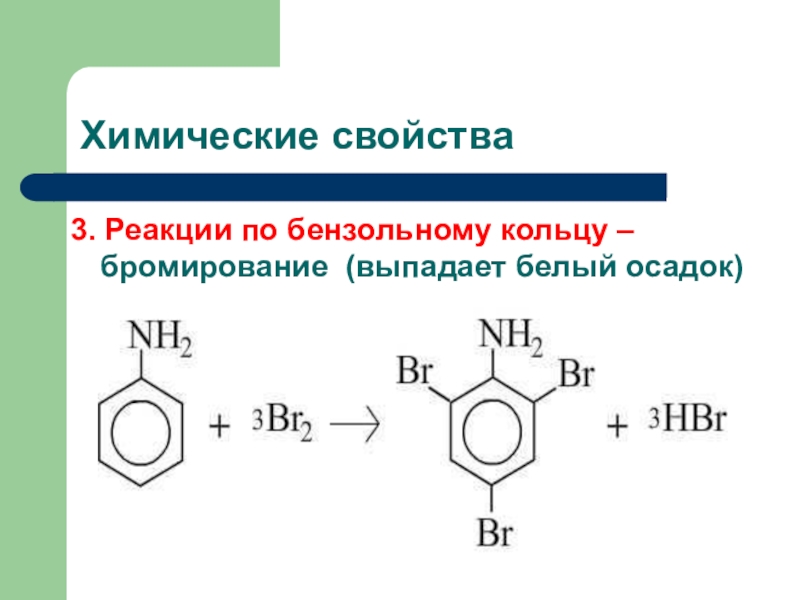
Слайд 20Химические свойства
1. Горение
4 С6Н5NH2 + 31 O2 → 24
CO2 + 14 H2O + 2 N2
2. Реакции по аминогруппе
- NH2 - реакции с сильными кислотамиС6Н5NH2 + HCI → [С6Н5NH3] CI
Анилин не изменяет окраску лакмуса, т.к. его основные свойства выражены слабее, чем у аммиака и аминов.
Слайд 22Химические свойства
Нитрование:
C6H5NH2+NaNO2+2HCl [C6H5-NN]+Cl- +NaCl + 2H2O
хлорид диазония
Диазосоединения можно выделить
в виде кристаллических, легко взрывающихся веществ. Благодаря способности диазониевой группы
легко замещаться на другие функциональные группы, эти соединения широко используются в органически синтезах. При взаимодействии водного р-ра анилина с CaClO2 появляется интенсивное фиолетовое окрашивание.
Слайд 23Применение
В настоящий момент в мире основная часть (85%) производимого анилина
используется для производства метилдиизоционатов (MDI), используемых затем для производства полиуретанов.
Анилин также используется при производстве искусственных каучуков (9%), гербицидов (2%) и красителей (2%).В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины потребителей в среднесрочной перспективе.
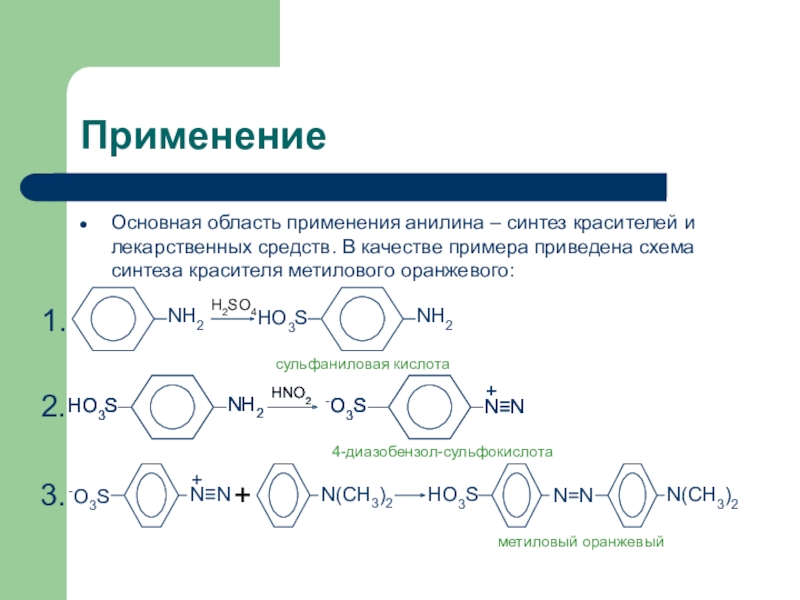
Слайд 24Применение
Основная область применения анилина – синтез красителей и лекарственных средств.
В качестве примера приведена схема синтеза красителя метилового оранжевого:
H2SO4
NH2
сульфаниловая кислота
4-диазобензол-сульфокислота
+
N(CH3)2
HO3S
метиловый
оранжевый1.
2.
3.














![Азотсодержащие органические вещества Химические свойстваНитрование:C6H5NH2+NaNO2+2HCl [C6H5-NN]+Cl- +NaCl + 2H2Oхлорид диазонияДиазосоединения можно выделить в виде Химические свойстваНитрование:C6H5NH2+NaNO2+2HCl [C6H5-NN]+Cl- +NaCl + 2H2Oхлорид диазонияДиазосоединения можно выделить в виде кристаллических, легко взрывающихся веществ. Благодаря](/img/tmb/6/593586/3ca59c855c726d1aaf61115054bb9294-800x.jpg)