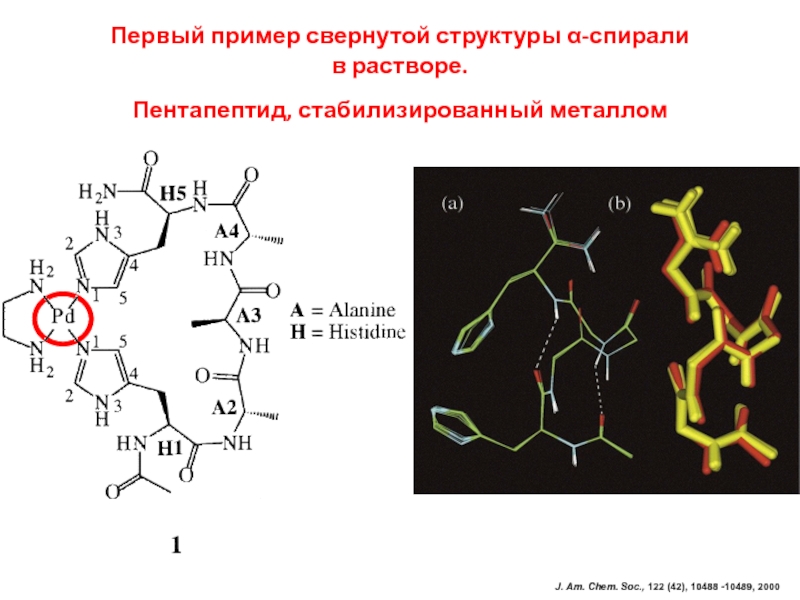
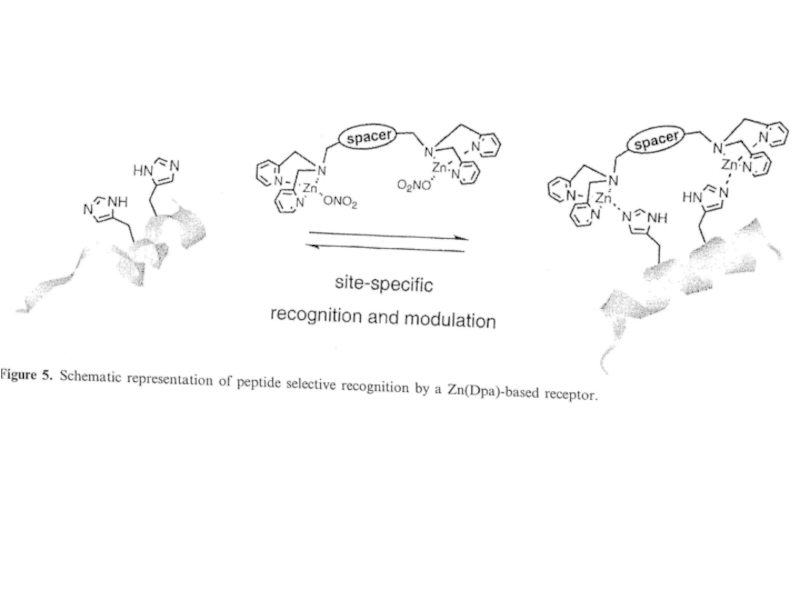
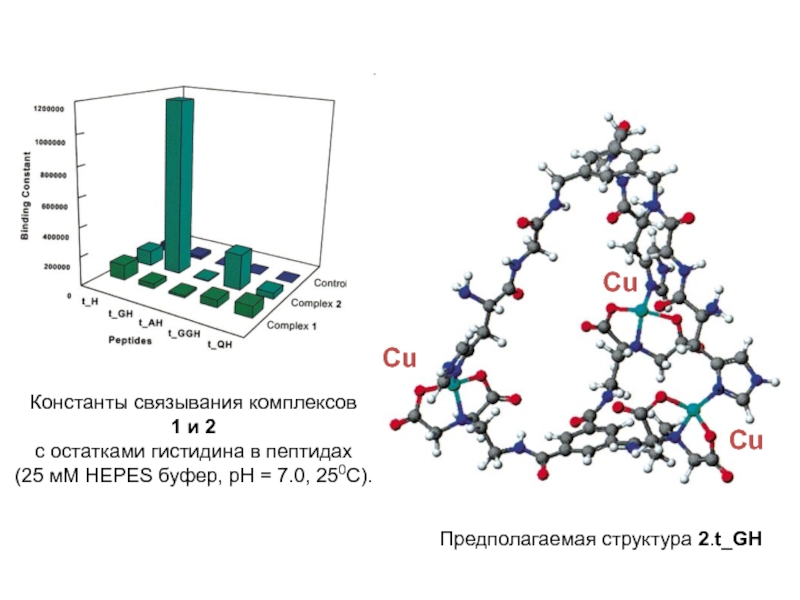
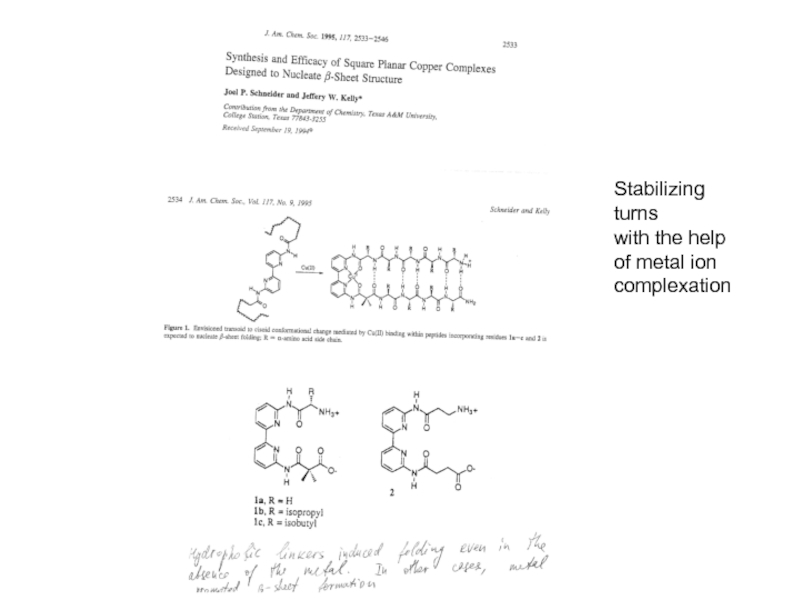
регулирует уровень сахара в крови)
Транспортные белки
(гемоглобин доставляет O2 в ткани)
Структурные
белки(коллаген является компонентом соединительных тканей)
Сократительные белки
(актин и миозин содержатся в мускулах)
Запасные белки
(ферритин депонирует Fe в селезенке)
Scaffolding proteins & modules:
(доставляют белки к необходимому участку)
Экзотические белки
(белки-антифризы у рыб)
БИОЛОГИЧЕСКИЕ ФУНКЦИИ БЕЛКОВ