Слайд 3Распространенность и минералы
Be – 48 место; 3BeO.Al2O3.6SiO2 (берилл)
Mg – 7
место; KCl.MgCl2.6H2O (карналлит), MgCO3.CaCO3 (доломит)
Ca – 3 место; CaCO3 (кальцит),
CaF2 (флюорит), CaSO4.2H2O (гипс)
Sr – 19 место; SrCO3 (стронцианит)
Ba – 17 место; BaCO3(витерит), BaSO4(барит)
Ra – радиоактивен; в урановых рудах
Слайд 4Открытие элементов
Be – 1798 г.; фр. Воклен, от минерала бирилл
Mg
– 1808г, анг. Дэви,
Ca - 1808г, анг. Дэви, лат.
calx –известь
Sr - 1808г, анг. Дэви, место где стронцианит
Ba - 1808г, анг. Дэви, гр. «барис» тяжелый
Ra – 1898 г., супруги Кюри, лат. «радиус» - луч
Слайд 5Получение
Be – электролиз расплава Ba[BeF4]
BeF2 + Mg = MgF2 +
Be
Mg – электролиз расплава MgCl2
Sr, Ba – электролиз расплава
MCl2 или BaO
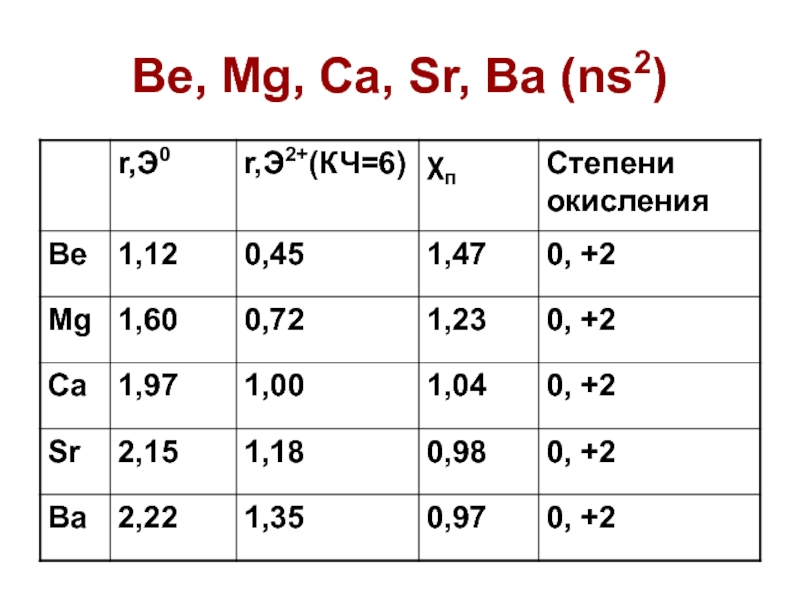
Слайд 6Основные свойства
Степень окисления ТОЛЬКО 2+
Очень маленький радиус катиона бериллия и
магния. Ca, Sr, Ba – щелочно-земельные металлы.
Диагональное сродство: Be и
Al. Be – ковалентные соединения.
Увеличение основных свойств M(OH)2: Be(OH)2 – амф., Ca(OH)2 – ср. силы.
Слайд 7Св-ва простых веществ
M + 2H2O = M(OH)2 + H2 (Be
– нет; Mg – при нагревании)
M + X2 = MX2
M
+ S = MS
2M + O2 = 2MO
BaO + 1/2O2 = BaO2 при 500оС
M + 2HCl = MCl2 + H2
Слайд 8Св-ва простых веществ
Ве – амфотерные св-ва:
Be + 2NaOH + 2H2O
= Na2[Be(OH)4] + H2
Be + 4NH4F = (NH4)2[BeF4] + 2NH3
+ H2 (в р-ре)
Mg + 2NH4Cl = MgCl2 + 2NH3 + H2 (при Т в р-ре)
Слайд 9M(OH)2
Be(OH)2 – амфотерный, полимер с мостиками ОН, подвержен старению
Mg(OH)2 –
основание средней силы
Ca(OH)2, Sr(OH)2, Ba(OH)2 – сильные основания (щелочи) –
мало растворимы в воде
Be(OH)2↓ + 2NaOH = Na2[Be(OH)4] гидроксобериллат
Mg(OH)2↓ + 2NaOH = Na2[Mg(OH)4] (100оС, конц.)
Mg2+ + NH3 +H2O = Mg(OH)2↓ + NH4+
Равновесие сдвинуто влево при изб. NH4+
Слайд 10Гидриды
Be + H2 = нет реакции
MCl2 + 2LiH = 2LiCl
+ MH2 (M = Be, Mg)
Mg + H2 = MgH2
(при Р)
(C2H5)2Mg = MgH2 + 2C2H4 (пиролиз)
BeH2 и MgH2 – ковалентные гидриды (полимеры с мостиками Н)
MH2 (M = Ca, Sr, Ba) – ионные гидриды
M + H2 = MH2 (при Т)
MH2 + 2H2O = M(OH)2 + 2H2
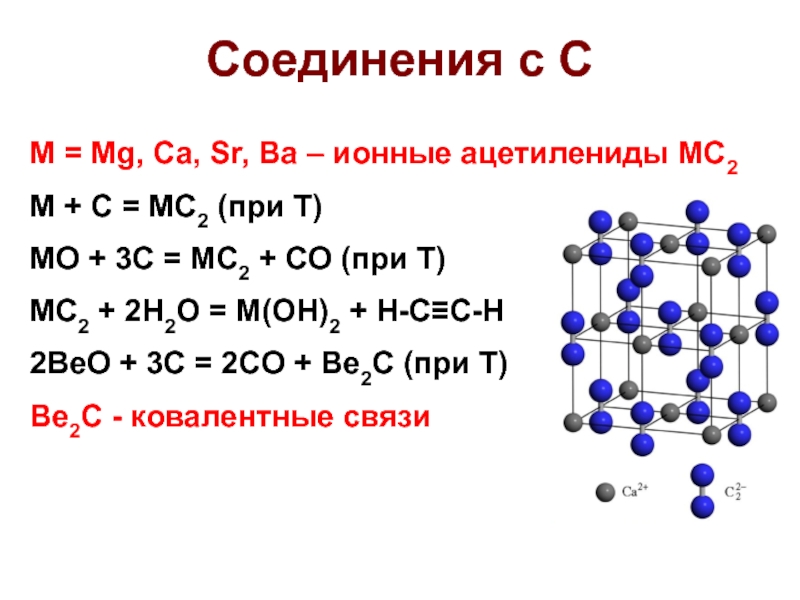
Слайд 11Соединения с C
M = Mg, Ca, Sr, Ba – ионные
ацетилениды MC2
M + C = MC2 (при Т)
MO + 3C
= MC2 + CO (при Т)
MC2 + 2H2O = M(OH)2 + H-C≡C-H
2BeO + 3C = 2CO + Be2C (при Т)
Be2C - ковалентные связи
Слайд 12Соединения с N
M = Mg, Ca, Sr, Ba образуют M3N2
ионные нитриды
Be3N2 – ковалентное соединение
3M + N2 = M3N2 (при
Т)
M3N2 + 6H2O = 3M(OH)2 + 2NH3
Слайд 13Комплексы
Ве – очень хороший комплексообразователь, особенно с О-лигандами КЧ =
4
[Be(OH)4]2-, [BeF4]2-
4Be(OH)2 + 6CH3COOH = [Be4O(CH3COO)6] +7H2O
[Mg(H2O)(edta)]2- (КЧ = 7)


![Be_Mg_Ca_Sr_Ba ПолучениеBe – электролиз расплава Ba[BeF4]BeF2 + Mg = MgF2 + Be ПолучениеBe – электролиз расплава Ba[BeF4]BeF2 + Mg = MgF2 + Be Mg – электролиз расплава MgCl2Sr, Ba](/img/thumbs/24fc969e02600eb8d9ad4082e07d822f-800x.jpg)


![Be_Mg_Ca_Sr_Ba Св-ва простых веществВе – амфотерные св-ва:Be + 2NaOH + 2H2O = Св-ва простых веществВе – амфотерные св-ва:Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2Be + 4NH4F =](/img/tmb/3/255724/d1f5b481587a5cd445d7ff4fd1a3f7ec-800x.jpg)



![Be_Mg_Ca_Sr_Ba КомплексыВе – очень хороший комплексообразователь, особенно с О-лигандами КЧ = 4[Be(OH)4]2-, КомплексыВе – очень хороший комплексообразователь, особенно с О-лигандами КЧ = 4[Be(OH)4]2-, [BeF4]2-4Be(OH)2 + 6CH3COOH = [Be4O(CH3COO)6] +7H2O[Mg(H2O)(edta)]2-](/img/thumbs/cd7d90ad8fc21319d465e967571b8bc7-800x.jpg)