Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биогенді элементтер
Содержание
- 1. Биогенді элементтер
- 2. В.И.Вернадский:” Организмде жүретін күрделі өзгерістерді түсіну үшін
- 3. Тірі ағзаларда 70 астам элемент табылған.Тірі ағзаның
- 4. Жіктелуі:Функционалдық қызметі бойынша:органогендер организмде 97,4% (С, Н,
- 5. ЖІКТЕЛУІ Организмдегі концентрациясы бойынша:1.Макроэлементтер (оттек, сутек, көміртек,
- 6. СУТЕК Сутегі бірінші топттың негізгі топшасының элементі.
- 7. Табиғатта таралуы. Сутегі Жерде бос күйінде тек
- 8. Алынуы. 1. Өндірісте сутегін табиғи газдан алады.
- 9. Физикалық қасиеттері. Сутегі – ең жеңіл газ.
- 10. Химиялық қасиеттері. Сутегінің химиялық қасиеттері оның атомында
- 11. ТОТЫҚСЫЗДАНДЫРҒЫШ қасиет көрсететін реакциялары.1. Оттегімен әрекеттесіп су
- 12. Қолданылуы. Сутегінің негізгі қолданылатын саласы – химиялық
- 13. Су оның қасиеттеріСудың кермектілігіСуды тазарту жолдары
- 14. Су – сутек оксиді –
- 15. Дистильденген су — айдау арқылы тазартылған су, ол
- 16. Судың физикалық қасиеттері
- 17. Таза су – мөлдір, исі және дәмі
- 18. Слайд 18
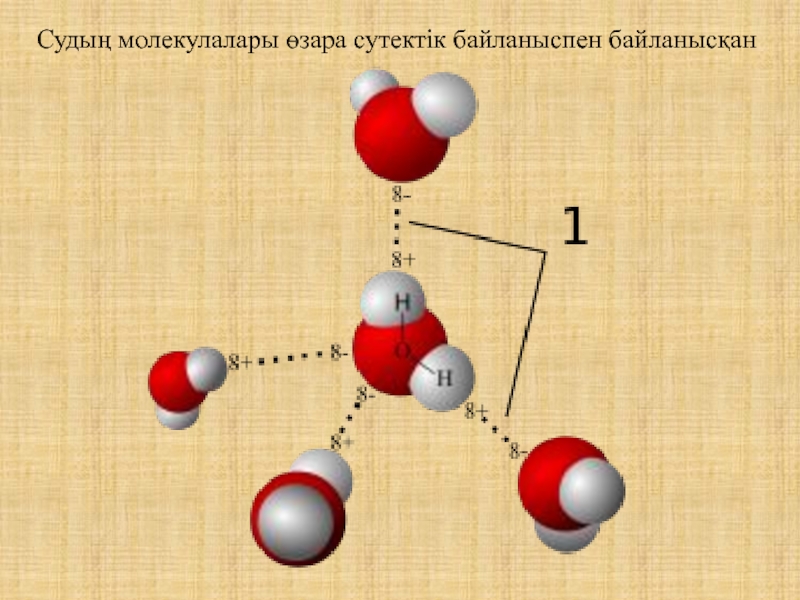
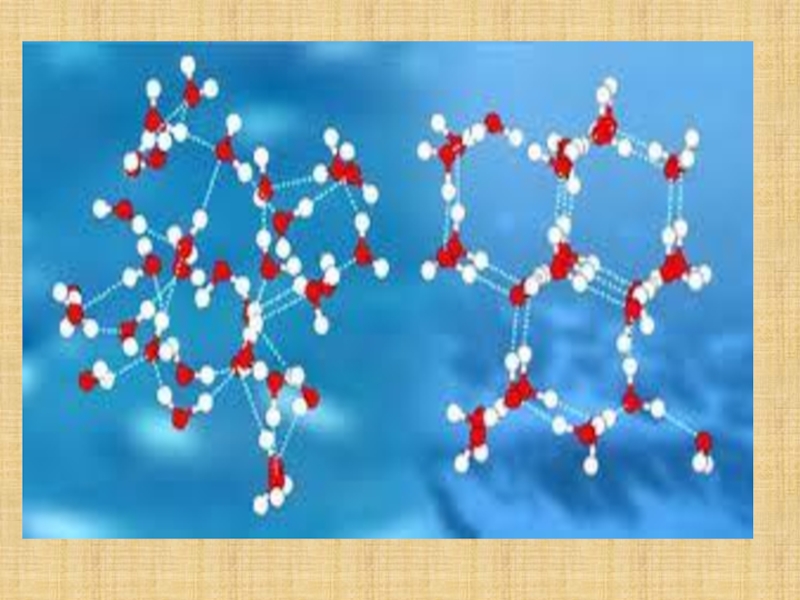
- 19. Судың молекулалары өзара сутектік байланыспен байланысқан
- 20. Слайд 20
- 21. Судың химиялық қасиеттері
- 22. Су – өте реакцияға қабілетті зат. Қалыпты
- 23. Су жақсы еріткіш, онда тұздар ерігенде көптеген
- 24. Ауыр су
- 25. Құрамында ауыр сутегі изотопы (Д-дейтерий) бар суды
- 26. Ауыр су қатысқан химиялық реакциялардың барлығы, жай
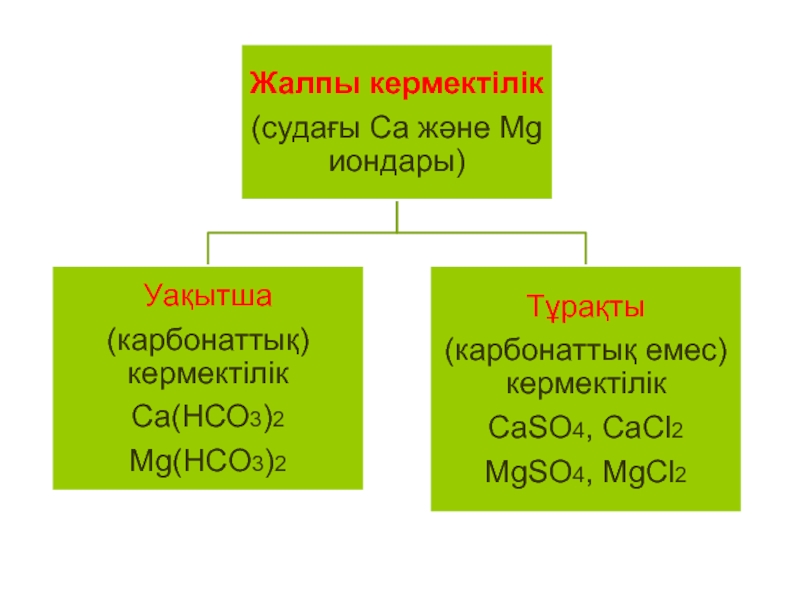
- 27. Судың кермектілігі және оны жоюдың жолдары
- 28. Кермек су ішуге,кір жууға жарамсыз.Кермек сумен жұмыс
- 29. Слайд 29
- 30. Халықаралық қабылданған стандарт бойынша судың жалпы кермектігі
- 31. Жаплы кермектілік бойынша судың сапасы анықталады: K12 ммоль/л – өте кермек болып бөлінеді.
- 32. УАҚЫТША (КАРБОНАТТЫҚ) КЕРМЕКТІЛІКСудағы кальций және магний катиондарының
- 33. Зертханада уақытша кермектілік ацидиметриялық титрлеу әдісімен анықталады. Ацидиметриялық
- 34. ТҰРАҚТЫ (КАРБОНАТТЫҚ ЕМЕС) КЕРМЕКТІЛІК
- 35. Тұрақты кермектілікті жою кезінде уақытша кермектілік те
- 36. Су ресурстарын қорғау
- 37. Жалпы планетарлық деңгейде су сарқылмайтын ресурстарға жатады.
- 38. Су ресурстарына және ондағы тіршілік
- 39. Басқа ластаушылардан: металдарды (сынап, қорғасын, мыс, марганец,
- 40. Суды тазалаудың жаңа технологиялары
- 41. Ресурстарды тиімді пайдаланудың негізгі бағыттарының бірі -
- 42. Биохимиялық тазалау - аэробты және анаэробты биохимиялық
- 43. Суды залалсыздандыру - судың ауру тудырғыш микроорганизмдерден
- 44. . Судың физикалық, химиялық және биологиялық қасиеттерінің өзгеруі
- 45. Скачать презентанцию
В.И.Вернадский:” Организмде жүретін күрделі өзгерістерді түсіну үшін оның барлық тіршіліктің негізі-жер қыртысымен байланысы барын зерттеу қажет”.А.П.Виноградов (1933ж): “Периодтық жүйедегі белгілі элементтердің адам және жануарлар организмінде бар екендігі анықталып отырғанда, олардың физиологиялық
Слайды и текст этой презентации
Слайд 2В.И.Вернадский:” Организмде жүретін күрделі өзгерістерді түсіну үшін оның барлық тіршіліктің
негізі-жер қыртысымен байланысы барын зерттеу қажет”.
элементтердің адам және жануарлар организмінде бар екендігі анықталып отырғанда, олардың физиологиялық мәнін естен шығаруға болмайды ”.Слайд 3Тірі ағзаларда 70 астам элемент табылған.
Тірі ағзаның клеткаларының және мүшелерінің
қалыптасуына, өсіп-жетілуіне, дамуына қажет элементтерді биогенді элементтер деп атаймыз.
30 элементтің
биогенділігі дәлелденген.Слайд 4Жіктелуі:
Функционалдық қызметі бойынша:
органогендер организмде 97,4% (С, Н, О, N, Р,
S);
электролитттік қызмет атқаратын элементтер (Na, К, Ca, Mg, Сl). Берілген
металл иондары организмдегі бар металдың 99% құрайды;микроэлементтер – ферменттердің, гормондардың орталығындағы биологиялық активті атомдар (ауыспалы металдар).
Слайд 5ЖІКТЕЛУІ
Организмдегі концентрациясы бойынша:
1.Макроэлементтер (оттек, сутек, көміртек, азот, фосфор, күкірт,
кальций, магний, натрий және хлор); ағзадағы мөлшері 0,01% - дан
жоғары болады.2. Микроэлементтердің (йод, мыс, мышьяк, фтор, бром, стронций, барий, кобальт) ағзадағы мөлшері 0,01%-0,001%.
3. Ультрамикроэлементтер - сынап, алтын, уран, торий, радий және т.б. Олардың ағзадағы мөлшері өте төмен.
Слайд 6СУТЕК
Сутегі бірінші топттың негізгі топшасының элементі.
Сутегінің 3 изотопы
белгілі:
протий 1Н
дейтерий 2Н
тритий 3Н
Протий және дейтерий тұрақты, тритий
– радиоактивті. Табиғи қосылыстарда дейтерий және протийдің атомдары сандарының қатынасы 1:6800.
Тритий табиғатта өте аз мөлшерде кездеседі.
Слайд 7Табиғатта таралуы
. Сутегі Жерде бос күйінде тек жанартаулардың газдарында, мұнай
скважиналарында басқа газдармен кездеседі. Бірақ бос күйінде аз мөлшері ғана
кездеседі. Ал қосылыстар күйінде сутегі кең таралған. Ол судың құрамында, тірі организмдер, мұнай, көмір, табиғи газдар, минералдарда кездеседі.Сутегі – космостың ең тараған элементі. Ол Күннің жарты массасын құрайды және көптеген басқа жұлдыздардың құрамында кездеседі. Жұлдыздарда сутегі атомдарының ядролары гелий атомының ядроларына айналады. Бұл процесс энергия бөлінуімен жүреді де, негізгі энергия көзі болады.
Слайд 8Алынуы.
1. Өндірісте сутегін табиғи газдан алады. Бұл газды (негізі
метан) катализатор қатысында 800-9000С-та су буымен және оттегімен араластырады.
2СН4
+ О2 + 2Н2О = 6Н2 + 2СО22. Мұнай өңдегенде түзілетін газдардан немесе кокс газдарынан алуға болады.
3. Лабораторияда КОН немесе NaOH ерітінділерінің электролизі арқылы алады.
4. Лабораторияда тұз қышқылына мырышпен әсер етіп те алады.
Zn + 2HCl = ZnCl2 + H2
Слайд 9Физикалық қасиеттері.
Сутегі – ең жеңіл газ. Ауадан 14,5 есе
жеңіл. -2400С-та сұйылады. Суда аз ериді, ал бірақ кейбір металдарда,
платина, палладий, никельде жақсы ериді.Слайд 10Химиялық қасиеттері.
Сутегінің химиялық қасиеттері оның атомында 1 ғана электрон
болуына байланысты. Сутегі атомы осы 1 басқа элементке оңай береді
(яғни, тотықсыздандырғыш), ал сонымен бірге 1 электронды қосып та ала алады. Бірінші жағдайда ол катионға, ал екінші жағдайда анионға айналады.Н – е- →Н+
Н + е- → Н-
Қалыпты температурада сутегінің активтілігі төмен. Температура артқан сайын сутегі атомдарының арасындағы байланыс әлсіреп, химиялық активтілігі артады.
Слайд 11ТОТЫҚСЫЗДАНДЫРҒЫШ қасиет көрсететін реакциялары.
1. Оттегімен әрекеттесіп су түзеді. Реакция 600-700
0С-та оңай жүреді. Сутегінің ауамен қоспалары қопарылыс беріп жанады, ал
таза сутегі – аз ғана дыбыспен жанады. 2 көлем сутегімен 1 көлем оттегі араласқанда қопарылыс береді.2Н2 + О2 →2Н2О
2. Жоғары температурада металдарды оксидтерінен тотықсыздандырады.
CuO + H2 = Cu + H2O
3. ТОТЫҚТЫРҒЫШ қасиеті.
Металдармен әрекеттесіп гидридтер түзеді.
2Na + H2 → 2NaH
Гидридтер тұз тәрізді қосылыстар. Сумен оңай гидролизденеді.
CaH2 + 2H2O = Ca(OH)2 + 2H2
Слайд 12Қолданылуы.
Сутегінің негізгі қолданылатын саласы – химиялық өнеркәсіп. Сутегі аммиак,
метанол синтезінде, сұйық майларды гидрлеуде қолданылады.
Тас көмірді 450-5000С-та жоғары
қысым астында сутегімен өңдеу арқылы сұйылтады. Түзілетін сұйық мұнайға ұқсас өнімнен бензин, керосин және жағар майларды алады.Ең жеңіл газ ретінде сутегін стратостаттарды толтыру үшін қолданған. Бірақ ол қопарылыс беруі мүмкін. Сондықтан оны қауіпсіз гелиймен алмастырады.
Сутегін экологиялық қауіпсіз отын ретінде ішкі жану двигательдерінде қолдану мүмкіндігі қарастырылуда.
Атомарлы сутегін металдарды пісіру үшін қолданады.
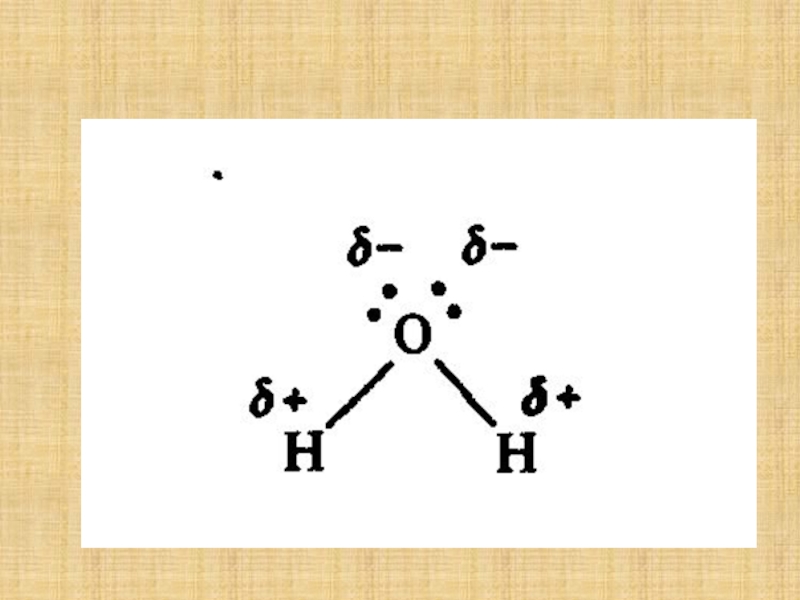
Слайд 14 Су – сутек оксиді – ең көп таралған
және ең маңызды заттардың бірі. Жер бетінде құрлықпен салыстырғанда судын
алып тұрған беті 2,5 есе көп. Табиғатта таза су жоқ, оның құрамында әруақытта қоспалар болады. Таза суды айдау әдістері арқылы алады. Айдалған суды дистилденген су деп атайды. Cудың құрамы (масса бойынша): 11,19 % сутегі және 88,81% оттегі.Слайд 15 Дистильденген су — айдау арқылы тазартылған су, ол кұрамы бойынша жаңбыр
суына жақын болады. Дистильденген су арнайы зерттеу жұмыстарында, дәрі-дәрмек өндірісінде
және автокөліктердің аккумуляторларына электролиттер дайындауда қолданылады.Өмір бойына ластанған суға тап болған адам оны ішу үшін суды қандай тәсілмен сүзу керек екендігін ойластыра бастады. Бұдан шығу жолын судың өзі көрсетті. Судың жоғары температура кезінде буға айналу қасиеті бар. Осындай тәсілмен судың құрамында бар көптеген өзге бөлшектерден бөлу шешілді. Бұндай суды тазалау үрдісі дистиляция, ал құралдың өзі дистилятор деп аталды.
Слайд 17 Таза су – мөлдір, исі және дәмі жоқ. Оның тығыздығынын
ең жоғарғы мәні 40С – та болады (1 г/см3).
Мұздың
тығыздығы сұйық судың тығыздығынан төмен, сондықтан мұз судың бетіне қалқып шығады. Су 00С – та қатады және қысым 101325 Па болғанда 1000С – та қайнайды.
Ол жылуды және электрді өте нашар өткізеді.
Су – жақсы еріткіш.
Слайд 22Су – өте реакцияға қабілетті зат. Қалыпты жағдайда ол негіздік
және қышқылдық оксидтердін көпшілігімен және де сілтілік, сілтілік жер –
металдармен әрекеттеседі. Мәселен:H2O + K2O = 2KOH
H2O + SO3 = H2SO4
2H2O + 2Rb = 2RbOH + H2
2H2O + Ca = Ca(OH)2 + H2
Слайд 23Су жақсы еріткіш, онда тұздар ерігенде көптеген қосылыстар – гидраттар
(кристалогидраттар) түзеді. Мысалы:
H2O + NaOH = NaOH * H2O
H2O
+ H2SO4= H2SO4* H2O10H2O + Na2CO3 = Na2CO3 *10H2O
5H2O + CuSO4 = CuSO4 *5H2O
Слайд 25 Құрамында ауыр сутегі изотопы (Д-дейтерий) бар суды ауыр су деп
атайды (Д2О формуласымен өрнектеледі).
Өзінің физикалық қасиеттері бойынша жай судан
өзгеше екендігі төмендегі салыстырудан көрініп тұр:Д2О H2O
Молекулалык масса 20 18
200С -та тыгыздығы, г/см3 1,1050 0,9982
Қату температурасы 0С 3,8 0
Қайнау температурасы 0С 101,4 100
Слайд 26Ауыр су қатысқан химиялық реакциялардың барлығы, жай суға қарағанда, әлдеқайда
жай жүреді. Сондықтан ол жай суды көп уақыт электролиздегенде электролизерде
жинақталады. Ауыр су ядролық реакторларда нейтрондарды баяулатқыш ретінде қолданылады.Слайд 28Кермек су ішуге,кір жууға жарамсыз.Кермек сумен жұмыс істейтін бу қазандарының
қабырғаларына қақ тұрып қалады да,қабырғаларының біркелкі қызбауынан кейде қопарылыс болады
және жылу өткізуінің азаюынан мұндай қазандар отынды көп керек етеді.Сондықтан кермек суларды әр түрлі әдістермен тұшытады.Слайд 30Халықаралық қабылданған стандарт бойынша судың жалпы кермектігі көлемі 1 л
судағы Ca2+ және Mg2+ иондарының миллиммоль эквиваленттерінің санымен анықталады (ммоль/л):
Слайд 31Жаплы кермектілік бойынша судың сапасы анықталады:
K
дейін өте жұмсақ;
K=1,5- 4 ммоль/л - жұмсақ
K= 4 – 8
ммоль/л – жұмсақтығы орташа,K= 8 – 12 ммоль/л – кермек,
K>12 ммоль/л – өте кермек болып бөлінеді.
Слайд 32УАҚЫТША (КАРБОНАТТЫҚ) КЕРМЕКТІЛІК
Судағы кальций және магний катиондарының гидрокарбонаттар тұздар туғызады.
Уақытша кермектілікті суды қайнату арқылы жоюға болады:
1. Суды қайнату нәтижесінде
қақ пайда болады:Ca(HCO3)2→ CaCO3↓ +H2O + CO2↑
Mg(HCO3)2→ MgCO3↓ +H2O + CO2↑
2. Суға соданы не ізбес суын қосу арқылы жоюға болады:
Ca(OH)2 + Ca(HCO3)2 →2CaCO3 ↓ +2 H2O
Ca(HCO3)2 + Na2CO3→2CaCO3 ↓ +2NaHCO3
t
t
t
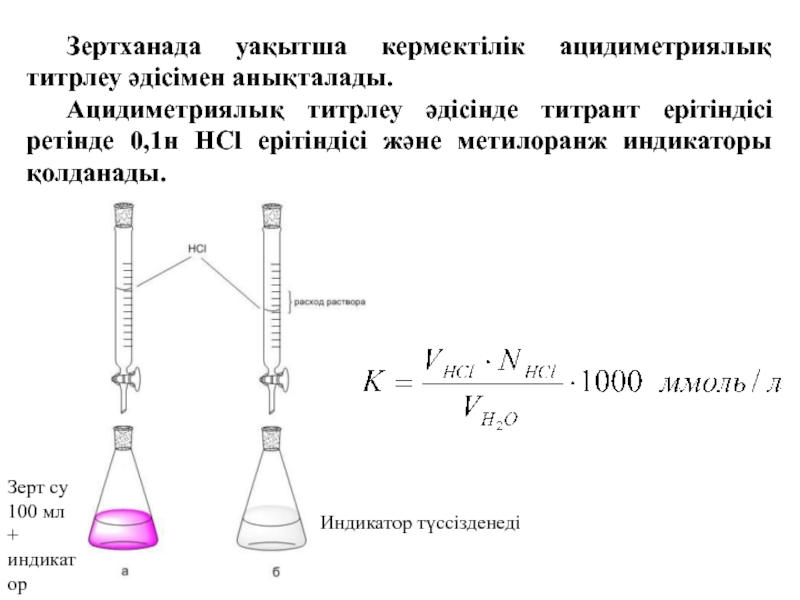
Слайд 33 Зертханада уақытша кермектілік ацидиметриялық титрлеу әдісімен анықталады.
Ацидиметриялық титрлеу әдісінде титрант
ерітіндісі ретінде 0,1н HCl ерітіндісі және метилоранж индикаторы қолданады.
Зерт су
100
мл+ индикатор
Индикатор түссізденеді
Слайд 34ТҰРАҚТЫ (КАРБОНАТТЫҚ ЕМЕС) КЕРМЕКТІЛІК
Тұрақты кермектілікті
судағы кальций және магнийдің сульфат пен хлорид тұздары туғызады.
Тұрақты кермектілікті жою үшін суға сода немесе натрий фосфатын қосады: CaSO4+ Na2CO3 = CaCO3 +Na2SO4
3CaCl2 + 2Na3PO4 = Ca3(PO4)2 + 6NaCl
Слайд 35Тұрақты кермектілікті жою кезінде уақытша кермектілік те мынадай реакциялар бойынша
бірге жойылады:
Ca(HCO3)2 + Na2CO3 = CaCO3
+ 2NaHCO33Mg(HCO3)2 + 2Na3PO4 = Mg3(PO4)2 + 6NaHCO3
Слайд 37 Жалпы планетарлық деңгейде су сарқылмайтын ресурстарға жатады. Өйткені оның жалпы
планетадағы мөлшері мұхит, атмосфера және құрлықта үнемі жүріп отыратын су
айналымы нәтижесінде толықтырылып отырады.Су планетамыздың 70,8% бөлігін алып жатыр. Бүкіл су қорының 97% Әлемдік мұхиттың үлесіне тиеді.
Тұщы сулардың көпшілігі (70%) қар және мұздықтар түрінде.
Жер асты сулардың еншісіне тұшы су қорларының 23% тиеді.
Слайд 38
Су ресурстарына және ондағы тіршілік иелеріне теріс
әсер ететін заттардың бірі, өнеркәсіп орындарынан бөлінетін улы органикалық заттар.
Мұндай улы заттар өнеркәсіп орындарында, транспортта, коммуналдық-тұрмыстық шаруашылықта кеңінен қолданылуда. Ағын сулардағы бұл заттардың мөлшері әдетте 5-15 мг/л-ді құрайды. Ал осы заттардың шекті мөлшері бар болғаны 0,1 мг/л-ді құрайды.Слайд 39 Басқа ластаушылардан: металдарды (сынап, қорғасын, мыс, марганец, қалайы, мырыш, хром),
радиоактивті элементтерді, ауыл шаруашылығы егіс алқаптарынан және мал шаруашылығы фермаларынан
түсетін улы химикаттарды атауға болады.Металдардың ішінен су қоры үшін ең қауіптісі сынап, қорғасын және олардың қосылыстары.
Слайд 41 Ресурстарды тиімді пайдаланудың негізгі бағыттарының бірі - қайта өңдеп пайдалану,
тазалаудың жаңа технологияларын қолдану, ұйымдастыру шаралары. Суды қайталап (екінші рет)
пайдалану өнеркәсіп орындарында әртүрлі технологиялық процестерде қолданылады.Қазіргі таңда суды тазалаудың жаңа:
физикалық,
химиялық,
биотехнологиялық әдістері қолданылады.
Слайд 42 Биохимиялық тазалау - аэробты және анаэробты биохимиялық тазалаудан тұрады.
Аэробты
биохимиялық тазалау - өндірістік және тұрмыстық пайдаланылған сулардың микроорганизмдер әсерінен
тотығуы нәтижесінде (оттегінің қатысуымен) органикалық заттарын минералдау.Анаэробты биохимиялық тазалау оттегінің жоқ немесе жеткіліксіз жағдайында жүреді. Бұл жағдайда судағы оттегінің көзі ретінде құрамында оттегі бар аниондар қызмет етеді.
Слайд 43 Суды залалсыздандыру - судың ауру тудырғыш микроорганизмдерден (оба, тырысқақ, іш
сүзегі, жұқпалы гепатит т.б.) тазалануы.
Көптеген жылдар бойы ішетін суды
хлордың көмегімен залалсыздандырып келді. Алайда, полихлорлы бифенилдердің улы екені, олар көбіне майлардың құрамында кездесетіні белгілі болды. Тотыға отырып, олар өте улы диоксинді түзеді . Қазіргі кезде суды озонмен, ультракүлгінмен, ультрадыбыспен өңдейді.