Слайд 1Биохимия
Регуляция метаболизма
Слайд 2Основные определения
Живая клетка - открытая система, постоянно обменивающаяся с внешней
средой веществами и энергией.
В многоклеточном организме клетка реагирует не
только на изменение окружающей среды, но и на функциональную активность соседних клеток. При этом она стремится сохранить неизменным свой внутренний состав. Это состояние называют стационарным или клеточным гомеостазом.
В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие.
Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма.
Слайд 3Основные определения
Среди всех метаболических путей, протекающих в организме, выделяют противоположно
направленные процессы: катаболизм и анаболизм.
Катаболизм - распад сложных веществ до
простых с высвобождением энергии.
Анаболизм - синтез из простых более сложных веществ.
Метаболические пути согласованы между собой по месту, времени и интенсивности протекания. Эта согласованность протекания всех процессов обеспечивается сложными и многообразными механизмами регуляции.
Слайд 4Организация метаболических путей в клетке
Большинство ферментов имеет внутриклеточную локализацию и
распределены в организме неравномерно.
Все ферменты одного метаболического пути, как
правило, находятся в одном отделе клетки.
Так, в ядре находятся ферменты, связанные с синтезом молекул ДНК и РНК, в цитоплазме - ферменты гликолиза, в лизосомах - гидролитические ферменты, т.д. Такая субклеточная локализация ферментов способствует упорядоченности биохимических процессов и увеличивает скорость обмена веществ.
Особенно разделение метаболических путей важно для противоположно направленных катаболических и анаболических процессов. Если бы такого разделения не существовало, образовывались бы бесполезные с функциональной и энергетической точки зрения пути.
Слайд 5Организация метаболических путей в клетке
В метаболических путях продукт первой ферментативной
реакции служит субстратом второй и так далее до формирования конечного
продукта. Промежуточные продукты метаболического пути могут высвобождаться из последовательности реакций и использоваться в других метаболических путях, т.е. метаболические пути связаны между собой промежуточными продуктами.
В ряде случаев пространственная организация ферментов настолько сильно выражена, что продукт реакции ни при каких условиях не может быть вычленен из метаболического пути и обязательно служит субстратом следующей реакции. Такая организация метаболического пути носит название мультиферментного комплекса и возникает в результате структурно-функциональной организации ферментов.
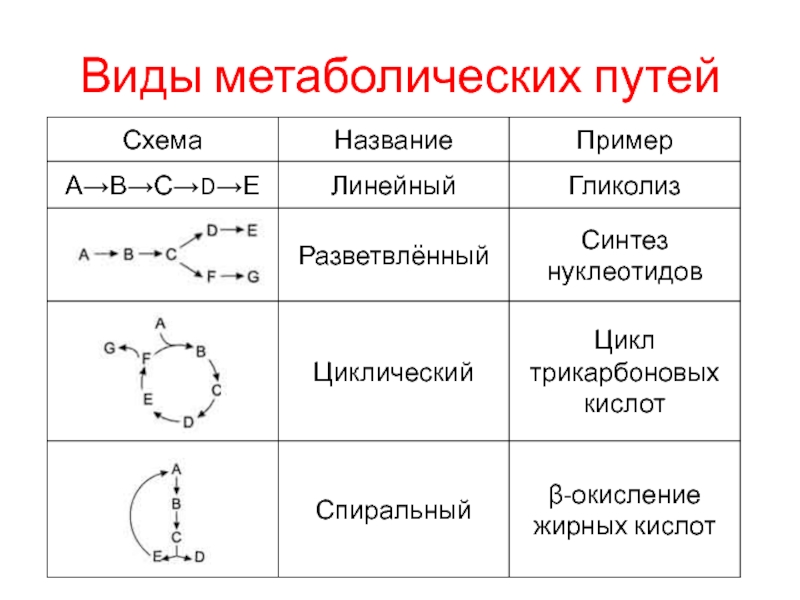
Слайд 6Виды метаболических путей
Структура метаболических путей в клетке крайне разнообразна:
В случае,
когда субстрат в результате ряда ферментативных процессов превращается в один
продукт, такой путь носит название линейного метаболического пути.
Часто встречаются разветвлённые метаболические пути, приводящие к синтезу различных конечных продуктов в зависимости от потребности клетки.
Слайд 8Организация метаболических путей в организме
Ферментный состав различных клеток неодинаков. Ферменты,
выполняющие функцию жизнеобеспечения клетки, находятся во всех клетках организма. Но
в процессе дифференцировки клеток происходит изменение ферментного состава клеток. Так, фермент аргиназа, участвующий в синтезе мочевины, находится только в клетках печени, а кислая фосфатаза, участвующая в гидролизе моноэфиров ортофосфорной кислоты, - в клетках простаты. Это так называемые органоспецифичные ферменты.
Органоспецифичных ферментов, выполняющих соответствующие функции в этих клетках, находится больше, чем в других клетках.
Слайд 9Регуляция метаболических путей
Все химические реакции в клетке протекают при участии
ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути, достаточно
регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути - регуляторные ферменты; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, лимитирующие реакции или реакции в месте переключения метаболического пути (точки ветвления).
Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
изменением количества молекул фермента;
доступностью молекул субстрата и кофермента;
изменением каталитической активности молекулы фермента.
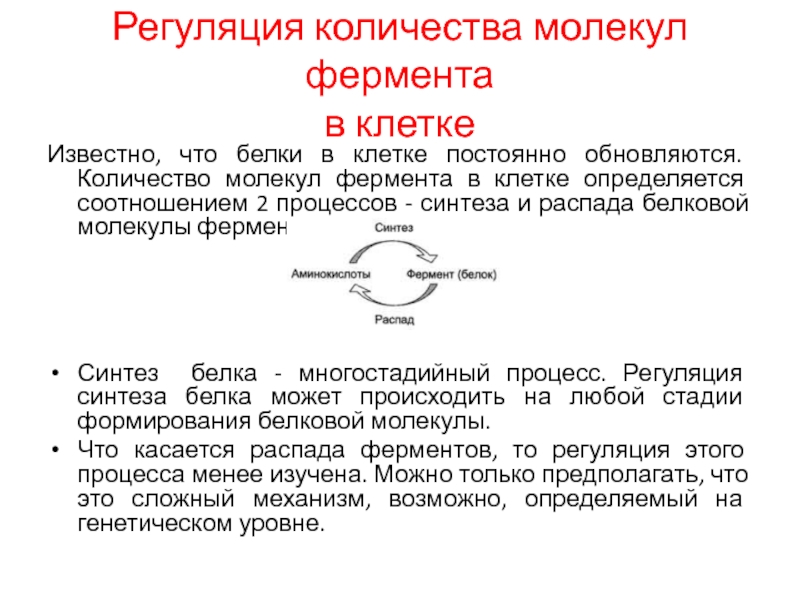
Слайд 10Регуляция количества молекул фермента
в клетке
Известно, что белки в клетке постоянно
обновляются. Количество молекул фермента в клетке определяется соотношением 2 процессов
- синтеза и распада белковой молекулы фермента:
Синтез белка - многостадийный процесс. Регуляция синтеза белка может происходить на любой стадии формирования белковой молекулы.
Что касается распада ферментов, то регуляция этого процесса менее изучена. Можно только предполагать, что это сложный механизм, возможно, определяемый на генетическом уровне.
Слайд 11Регуляция доступностью молекул субстрата
и коферментов
Важный параметр, контролирующий протекание метаболического пути,
- наличие субстратов, и главным образом - наличие первого субстрата.
Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути.
Другой параметр, лимитирующий протекание метаболического пути, - наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т.е. превращение в окисленную форму.
Слайд 12Регуляция активности фермента
Важнейшее значение в изменении скорости метаболических путей играет
регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического
пути. Это высокоэффективный и быстрый способ регуляции метаболизма.
Основные способы регуляции активности ферментов:
аллостерическая регуляция;
регуляция с помощью белок-белковых взаимодействий;
регуляция путём фосфорилирования/дефосфорилирования молекулы фермента;
регуляция частичным (ограниченным) протеолизом.
Слайд 13Аллостерическая регуляция
Аллостерическими ферментами называют ферменты, активность которых регулируется не только
количеством молекул субстрата, но и другими веществами, называемыми эффекторами.
Участвующие
в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют.
Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки.
Слайд 14Аллостерическая регуляция
Аллостерическая регуляция имеет большое значение в следующих ситуациях:
при анаболических
процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами
позволяют осуществлять регуляцию синтеза этих соединений;
при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии;
для координации анаболических и катаболических путей;
для координации параллельно протекающих и взаимосвязанных метаболических путей. Конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
Слайд 15Регуляция с помощью белок-белковых взаимодействий
Некоторые ферменты изменяют свою каталитическую активность
в результате белок-белковых взаимодействий. Существует 2 механизма активации ферментов с
помощью белок-белковых взаимодействий:
активация ферментов в результате присоединения регуляторных белков;
изменение каталитической активности ферментов вследствие ассоциации или диссоциации протомеров фермента.
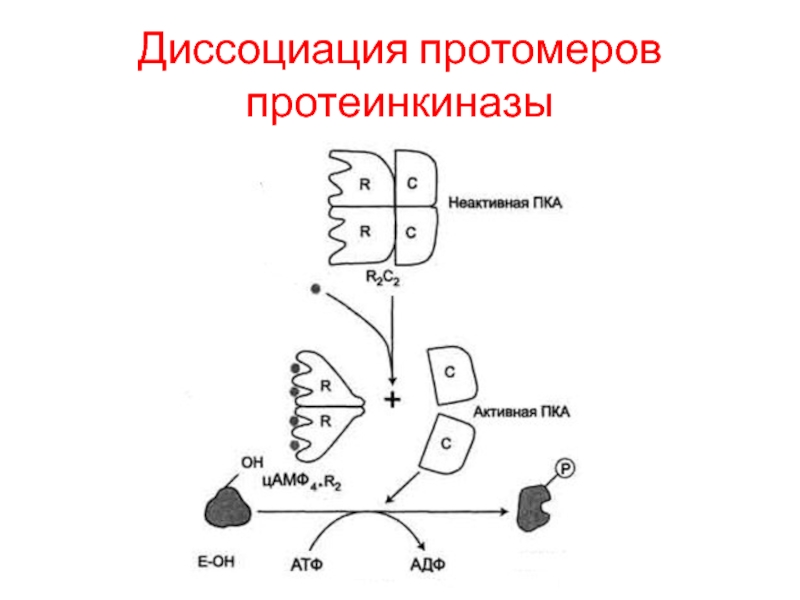
Слайд 16Изменение активности фермента его диссоциацией
Протеинкиназа А (цАМФ-зависимая, цАМФ – циклический АденозинМоноФосфат)
состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и
2 каталитических (С). Такой тетрамер не обладает каталитической активностью.
Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конфор-мации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы.
Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц Протеинкиназы А с образованием неактивного комплекса.
Слайд 17Диссоциация протомеров протеинкиназы
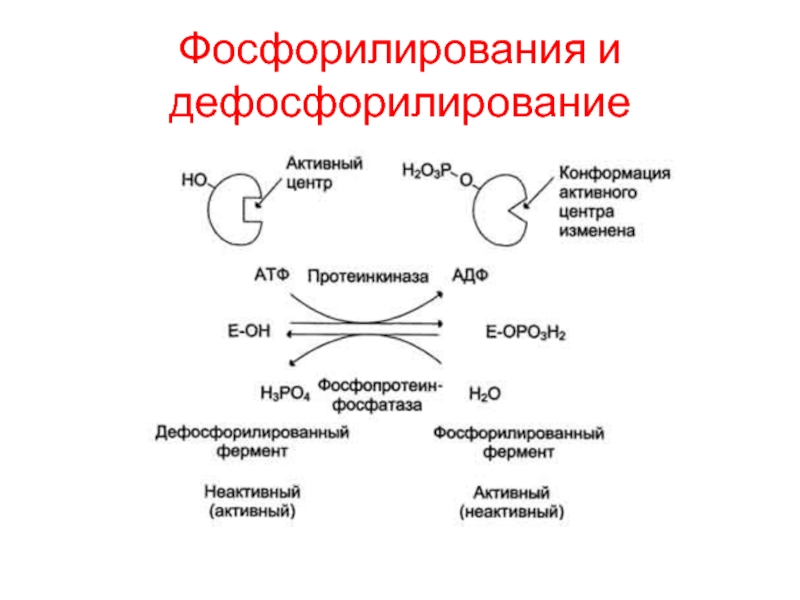
Слайд 18Фосфорилирования и дефосфорилирование
Быстрый и широко распространённый способ химической модификации ферментов
- фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами,
а дефосфорилирование - фосфопротеинфосфатазами.
Присоединение остатка фосфорной кислоты приводит к изменению его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.
Изменение активности фермента, вызванное фосфорилированием, обратимо. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды.
Слайд 19Фосфорилирования и дефосфорилирование
Слайд 20Частичный протеолиз
Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в
плазме крови), синтезируются в виде неактивных предшественников и активируются только
в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.
Частичный протеолиз - пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы.