Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биосинтез и распад пуриновых и пиримидиновых азотистых оснований
Содержание
- 1. Биосинтез и распад пуриновых и пиримидиновых азотистых оснований
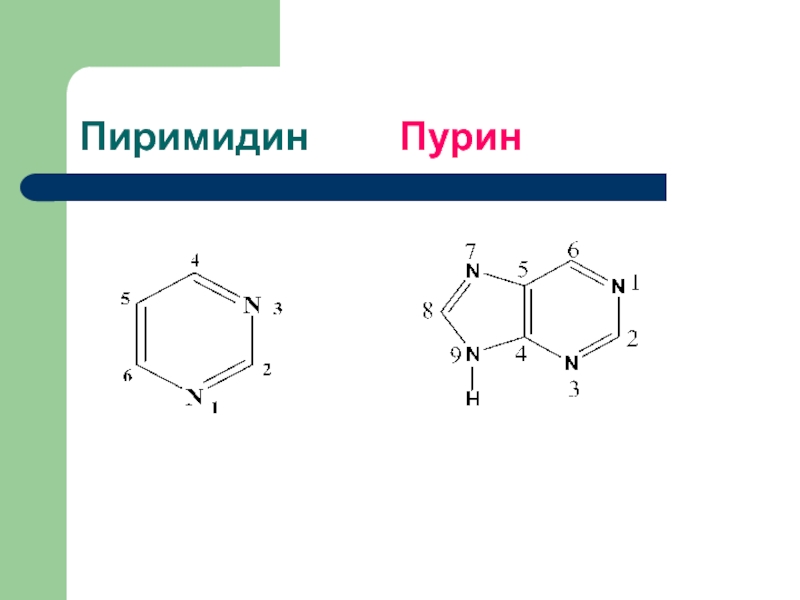
- 2. Пиримидин Пурин
- 3. Азотистые основания как органические соединенияАзотистые основания –
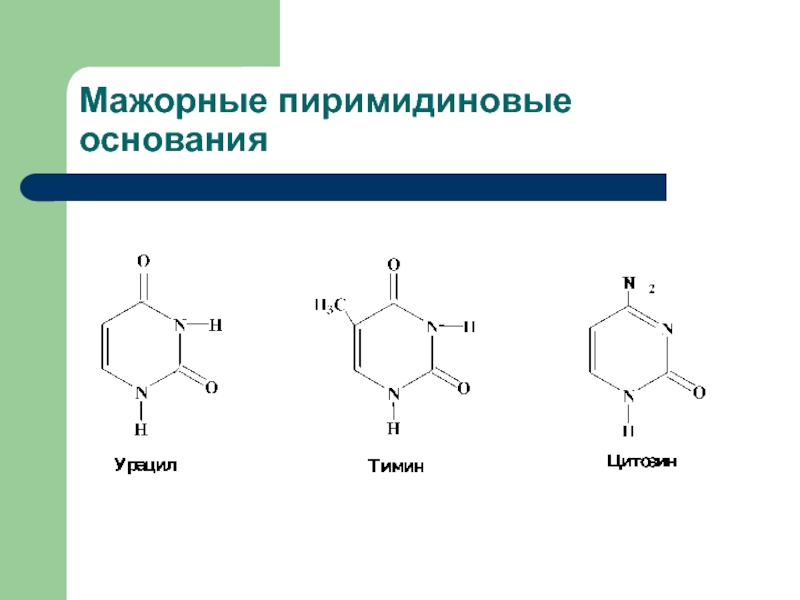
- 4. Мажорные пиримидиновые основания
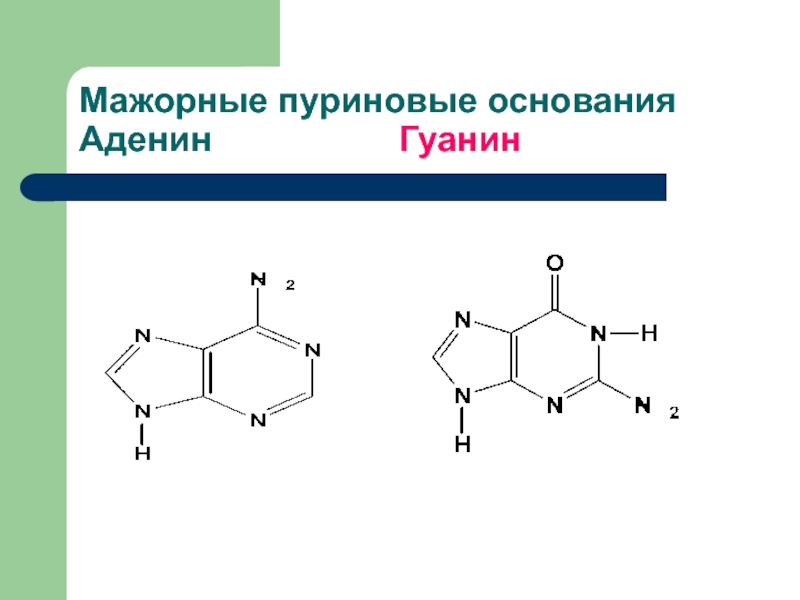
- 5. Мажорные пуриновые основания Аденин Гуанин
- 6. Использование пуринов и пиримидинов в организме1. Входят
- 7. Слайд 7
- 8. Последствия нарушений синтеза азотистых оснований для человека1.
- 9. Продолжение3. Ухудшение медиаторного обмена в головном мозге,
- 10. Биосинтез пиримидинов (краткое описание)Для синтеза пиримидинового кольца
- 11. Стадии синтеза пиримидина
- 12. Суммарное уравнение синтеза УМФКарбамоилфосфат+аспартат+НАД+ +2АТФ+фосфорибозилдифосфат(ФРДФ)УМФ+СО2+2АДФ+2Pi+NADH+PPi
- 13. Слайд 13
- 14. Биосинтез пурина (краткое описание)Для синтеза пуринов необходимы:ФосфорибозилдифосфатК
- 15. Биосинтез пурина (краткое описание)До замыкания 5-членного цикла
- 16. Слайд 16
- 17. Суммарное уравнение синтеза пуринов (ИМФ)CO2 (гидрокарбонат)+2 (С1-ТГФК)+глицин+2 глутамина+аспартат+4АТФ+фосфорибозилдифосфат (ФРДФ)ИМФ+2 глутамата+фумарат+4АДФ+4Pi
- 18. Ключевые продукты синтеза азотистых основанийПиримидиныКлючевым соединением является
- 19. Регуляция синтеза пуринов и пиримидиновПиримидиныКлючевой фермент -
- 20. Атака на фолиевую кислоту как противоопухолевый приемЕсли
- 21. Конкурентное ингибирование тимидилатсинтетазы как противоопухолевый приемУМФ(не входит
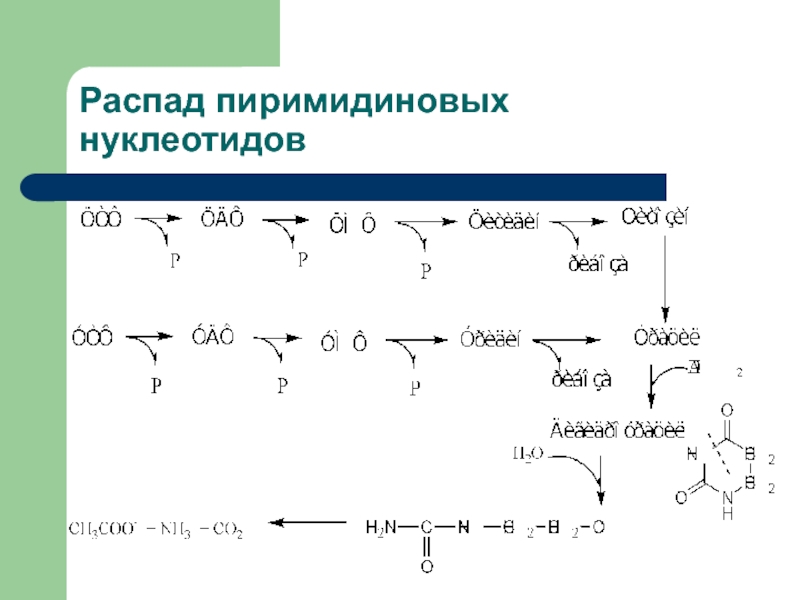
- 22. Распад пиримидиновых нуклеотидов
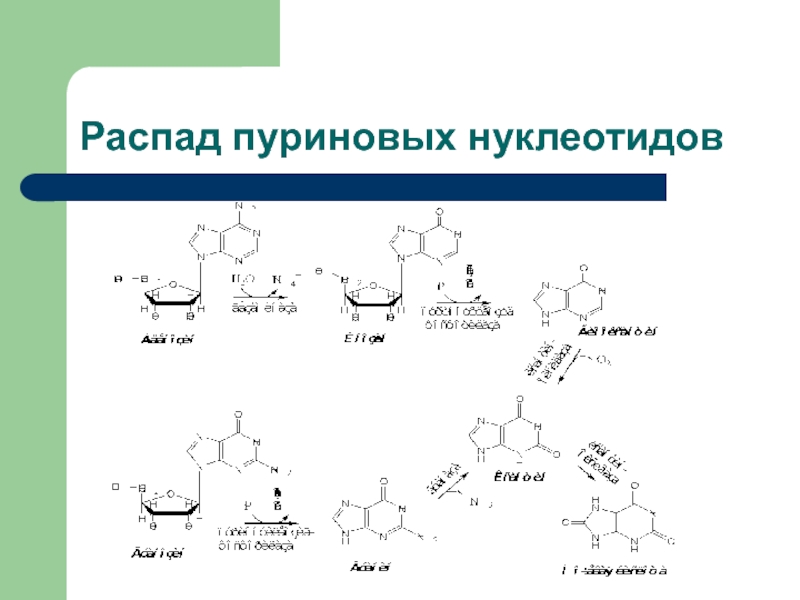
- 23. Распад пуриновых нуклеотидов
- 24. Слайд 24
- 25. Распад пуриновых нуклеотидов заканчивается образованием плохорастворимого соединения
- 26. Последствия гиперурикемииГиперурикемия сопровождается высоким уровнем мочевой кислоты
- 27. «Путь спасения» пуриновых основанийПуть спасения позволяет превратить
- 28. «Путь спасения» пуринов (продолжение)С нарушениями «пути спасения»
- 29. Причины гиперурикемии1.Нарушение выведения мочевой кислоты при заболеваниях
- 30. Принципы коррекции гиперурикемии1. Нормализация питания (уменьшить потребление
- 31. Диета при гиперурикемииСодержат много пуриновТелятинаФасоль и другие
- 32. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Биосинтез и распад пуриновых и пиримидиновых азотистых оснований
Болезни обмена пуринов
и пиримидинов
и биосинтез азотистых основанийСлайд 3Азотистые основания как органические соединения
Азотистые основания – это ароматические гетероциклические
соединения. рН их растворов щелочной.
Пиримидины содержат в 6-тичленном цикле
2 гетероатома (азот).Пурины содержат 4 гетероатома (азот) в конденсированном дигетероцикле
Слайд 6Использование пуринов и пиримидинов в организме
1. Входят в состав ДНК
и РНК в виде нуклеотидов(формирование триплетов генетического кода)
2. Участвуют в
образовании важных окислительно-восстановительных коферментов (НАД+, НАДФ+, ФАД)3. Являются составной частью макроэргических соединений (нуклеотидов): АТФ, ГТФ, УТФ, ЦТФ, ТТФ, обеспечивающих энергией все основные реакции биосинтеза в клетке и мышечное сокращение
Циклические АМФ и ГМФ – вторичные посредники гормонов, регулирующих все виды обмена
Аденин – возбуждающий нейромедиатор, активирующий также сокращение миокарда
Слайд 8Последствия нарушений синтеза азотистых оснований для человека
1. Прекращение процессов транскрипции
генов и, следовательно, нарушение синтеза белка в организме
2. Прекращение процесса
репликации и, следовательно, прекращение деления клетокПРОЯВЛЕНИЯ: у детей – резкое замедление роста, у взрослых – плохая регенерация тканей, ускоренное старение
Слайд 9Продолжение
3. Ухудшение медиаторного обмена в головном мозге, ускоренная гибель нейронов
4.
Резкое снижение скорости ОВР, в том числе в митохондриях –
тотальный дефицит АТФПРОЯВЛЕНИЯ: ухудшение памяти, внимания, мышечная и сердечная слабость, нарушение всех процессов биосинтеза, снижение всасывания в жкт, крайне тяжелая (апластическая) анемия
ПРИ ПОЛНОЙ БЛОКАДЕ СИНТЕЗА КАКОГО-ЛИБО ИЗ АО ЧЕЛОВЕК ПОГИБАЕТ В ТЕЧЕНИЕ НЕСКОЛЬКИХ НЕДЕЛЬ
Слайд 10Биосинтез пиримидинов (краткое описание)
Для синтеза пиримидинового кольца необходимы:
Аспартат – дает
атомы N1, С4, С5, С6
Карбамоилфосфат – дает атомы N3 и
С2Образование карбамоил-фосфата с большой скоростью идет из глутамина и аниона гидрокарбоната, как и в орнитиновом цикле
Слайд 12Суммарное уравнение синтеза УМФ
Карбамоилфосфат+аспартат+НАД+ +2АТФ+фосфорибозилдифосфат(ФРДФ)
УМФ+СО2+2АДФ+2Pi+NADH+PPi
Слайд 14Биосинтез пурина (краткое описание)
Для синтеза пуринов необходимы:
Фосфорибозилдифосфат
К нему присоединяется аминогруппа,
источником которой обычно является глутамин. Это азот N9 пурина
К азоту
N9 присоединяется остаток глицина (атомы С4,С5, N7)К азоту N9 присоединяется формильная группа (С8), которую приносит тетрагидрофолат
Слайд 15Биосинтез пурина (краткое описание)
До замыкания 5-членного цикла к С5 присоединяется
азот N3 (аминогруппа глутамина)
Углерод С6 принадлежит гидрокарбонату
N1 – это аминогруппа
аспартатаС2 также приносится тетрагидрофолатом в виде формильной группы
Слайд 17Суммарное уравнение синтеза пуринов (ИМФ)
CO2 (гидрокарбонат)+2 (С1-ТГФК)+глицин+2 глутамина+аспартат+4АТФ+фосфорибозилдифосфат (ФРДФ)
ИМФ+2 глутамата+фумарат+4АДФ+4Pi
Слайд 18Ключевые продукты синтеза азотистых оснований
Пиримидины
Ключевым соединением является дигидроортат, который взаимодействует
с фосфорибозилдифосфатом с образованием оротидин-5’-монофосфата
(ОМФ)
Пурины
Ключевым промежуточным соединением является гипоксантин
Синтез начинается
только с фосфорибозилдифосфата, поэтому образуется сразу нуклеозид, содержащий ксантин – ИНОЗИНОВАЯ КИСЛОТА (ИМФ)Слайд 19Регуляция синтеза пуринов и пиримидинов
Пиримидины
Ключевой фермент - карбамоилфосфатсинтаза (поставщик карбамоилфосфата)
Активность
фермента тормозится УТФ – конечным продуктом пути (ретроингибирование)
Фермент активируется в
присутствии АТФ и фосфорибозил дифосфатаПурины
В присутствии АДФ и ГДФ тормозится образование фосфорибозилдифосфата
(ретроингибирование)
Увеличение уровня АМФ и ГМФ тормозит присоединения N9 к ФРДФ
(ретроингибирование)
Биосинтез пуринов сильно зависит от уровня фолиевой кислоты (витамин Вс) – переносчика одноуглеродных фрагментов
Слайд 20Атака на фолиевую кислоту как противоопухолевый прием
Если нарушить перенос формильного
фрагмента фолиевой кислотой, то синтез пуринов обрывается, а вместе с
ним прекращается деление клеток.Потребность опухолевых клеток в фолате выше, поэтому они страдают в этом случае сильнее, чем нормальные клетки
Блокировать работу фолиевой кислоты может, например, препарат метатрексат
Слайд 21Конкурентное ингибирование тимидилатсинтетазы как противоопухолевый прием
УМФ(не входит в ДНК!) легко
и быстро превращается в ТМФ (входит в ДНК!) путем метилирования
при С5.Если нарушить процесс метилирования урацила при С5, то синтез тимина станет невозможным, и репликация прекратится.
Конкурентным ингибитором синтеза тимина является препарат 5-фторурацил: в присутствии F метилирование при С5 невозможно.
Слайд 25Распад пуриновых нуклеотидов заканчивается образованием плохорастворимого соединения - 2,6,8–тригидроксипурина, называемого
мочевой кислотой.
Усиленное образование мочевой кислоты приводит к повышению ее уровня
в крови (гиперурикемии)Слайд 26Последствия гиперурикемии
Гиперурикемия сопровождается высоким уровнем мочевой кислоты в моче –
гиперурикурия
Соли мочевой кислоты (ураты) также плохо растворимы, поэтому повышают риск
мочекаменной болезниКристаллы мочевой кислоты откладываются в тканях, особенно в области суставов при охлаждении. Развиваются воспалительные изменения в суставах, деформация и приступообразные боли.
Слайд 27«Путь спасения» пуриновых оснований
Путь спасения позволяет превратить пуриновые основания в
нуклеотиды, что снижает образование мочевой кислоты.
Под действием специальных трансфераз
происходят следующие реакции:Аденин + 1ФФ-рибоза-5Ф → АМФ + ФФ
Гуанин + 1ФФ-рибоза -5Ф→ ГМФ + ФФ
Гипокcантин + 1ФФ-5Ф→ ИМФ + ФФ
Слайд 28«Путь спасения» пуринов (продолжение)
С нарушениями «пути спасения» связаны 2 наследственных
заболевания:
А. Подагра (наследственная гиперурикемия) – нарушение превращения аденина в АМФ
с помощью аденин-фосфорибозил-трансферазыБ. Редкое заболевание синдром Леша – Найхана – нарушение превращения гипоксантина в ИМФ (дефект фермента гипоксантин:гуанин–фосфорибозилтрансферазы)
Слайд 29Причины гиперурикемии
1.Нарушение выведения мочевой кислоты при заболеваниях почек
2.Повышенное образование мочевой
кислоты
А)при избыточном потреблении пурин-содержащих продуктов
Б)при распаде тканей (воспаление, злокачественные опухоли)
В)при
врожденных дефектах «пути спасения» (наследственная подагра, синдром Леша-Найхана)Слайд 30Принципы коррекции гиперурикемии
1. Нормализация питания (уменьшить потребление пурин-богатых продуктов)
2. Исключение
продуктов, снижающих рН мочи (ухудшают выведение и растворимость солей мочевой
кислоты)3. При необходимости назначают аллопуринол – конкурентный ингибитор превращения ксантина в мочевую кислоту