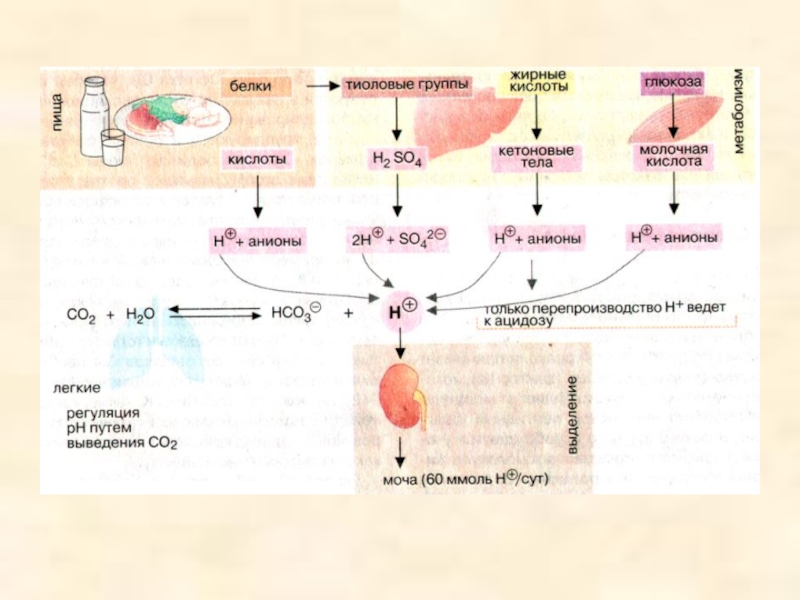
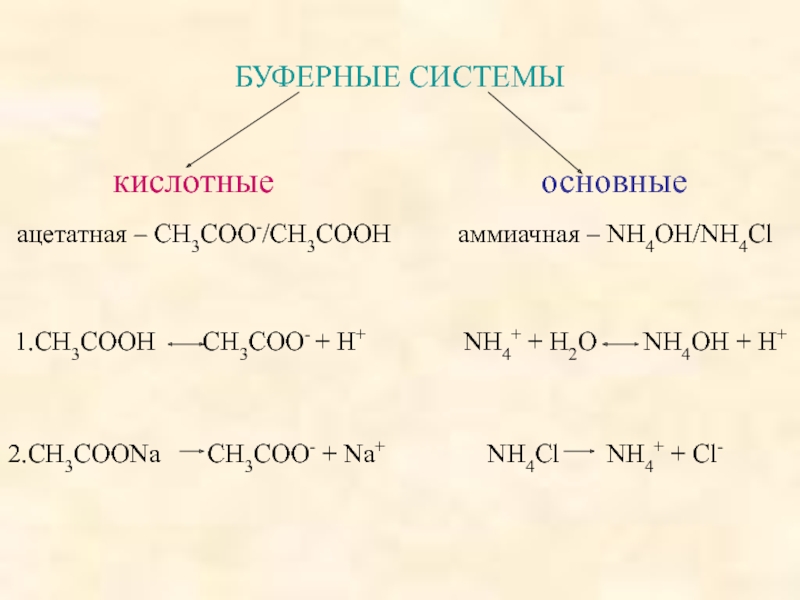
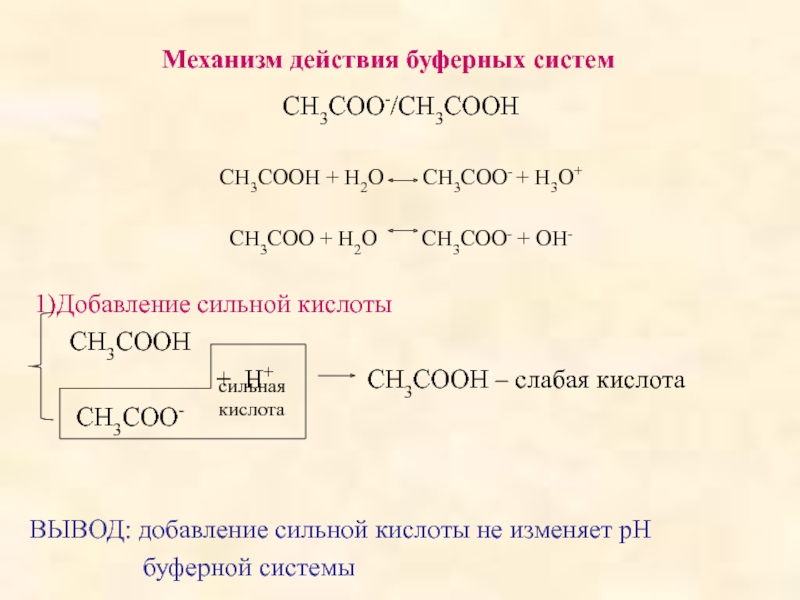
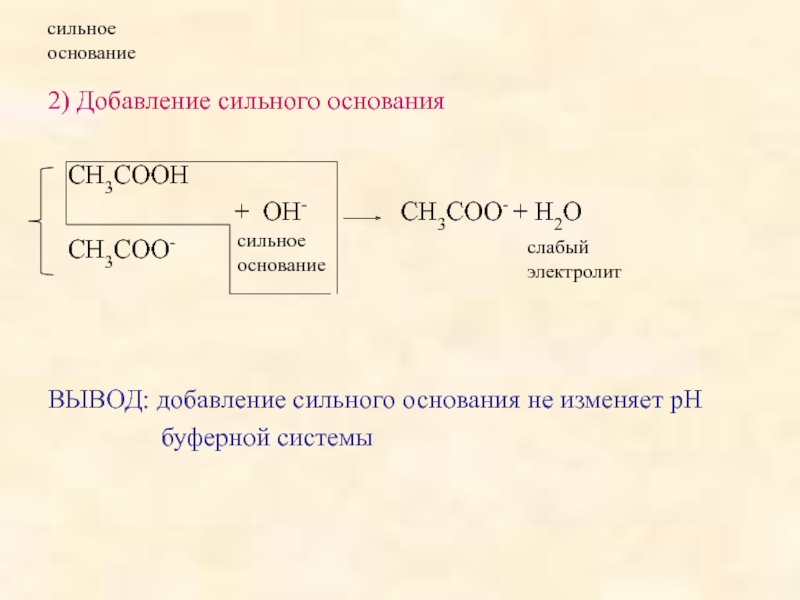
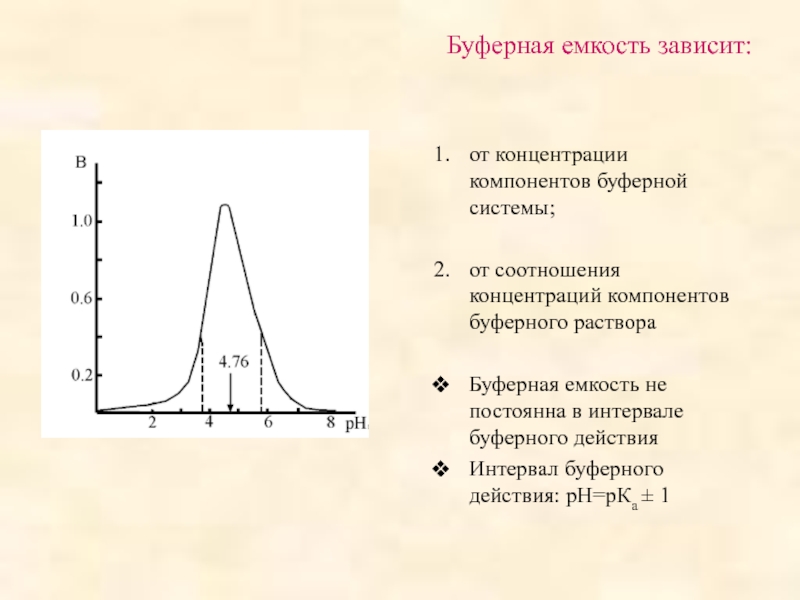
поддерживать постоянное значение рН при разбавлении или добавлении небольших количеств
кислоты или основания.Кислотно-основное равновесие
НА Н+ + А- В + Н+ ВН+
А- / НА
В / ВН+
кислота
сопряженное
основание
основание
сопряженная
кислота
Буферные системы