Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Давление газа. Уравнение состояния идеального газа. Изопроцессы
Содержание
- 1. Давление газа. Уравнение состояния идеального газа. Изопроцессы
- 2. Давление газа возникает в результате столкновений молекул
- 3. Слайд 3
- 4. Слайд 4
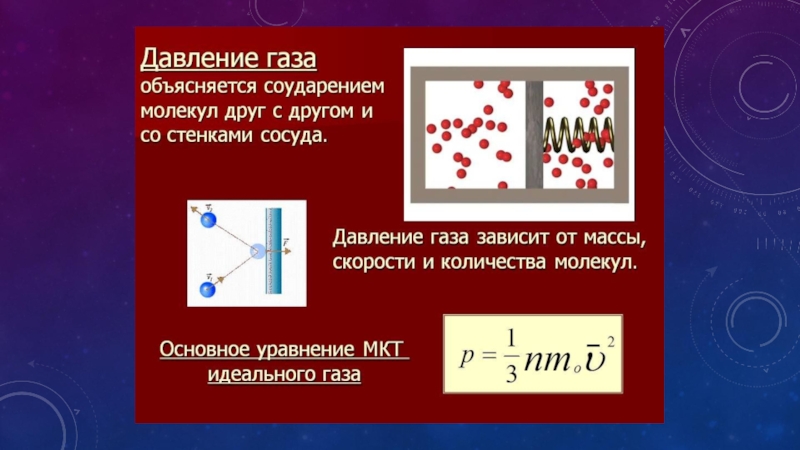
- 5. Основное уравнение молекулярно-кинетической теории идеального газаОсновное уравнение
- 6. Идеальный газ – это модель реального газа.
- 7. Уравнение состояния идеального газа — формула, устанавливающая
- 8. Изопроцессы – это процессы, которые совершаются при одинаковом параметре или Т-температуре, или V-объеме, или р-давлении.
- 9. Изотермический процесс —закон Бойля — Мариотта (при
- 10. Изобарный процесс —закон Гей-Люссака (при постоянном давлении
- 11. Изохорный процесс — закон Шарля (при постоянном
- 12. Источники: http://kaplio.ru/davlenie-gaza-uravnenie-mendeleeva-klapejrona-izoprotsessy/ https://studfiles.net/
- 13. Скачать презентанцию
Давление газа возникает в результате столкновений молекул со стенками сосуда ( и на помещенное в газ тело ), в котором находится беспорядочно движущиеся молекулы газа. Чем чаше удары, тем они сильнее
Слайды и текст этой презентации
Слайд 1Давление газа. Уравнение состояния идеального газа. Изопроцессы.
Подготовила:
Студентка ПСК группы 671
Лисунова
Ксения
Слайд 2Давление газа возникает в результате столкновений молекул со стенками сосуда
( и на помещенное в газ тело ), в котором
находится беспорядочно движущиеся молекулы газа. Чем чаше удары, тем они сильнее – тем выше давление. Давление зависит и от скорости поступательно движущихся газовых молекул. Единица измерения давления — паскаль p(Па). Измеряют давление газа манометром.Слайд 5Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального
газа устанавливает связь между макроскопической величиной - давлением, которое может
быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
можно записать:
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = nRT