Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дәріс № 4 Судың иондық көбейтіндісі Сутектік көрсеткіш (рН) Тұздар гидролизі
Содержание
- 1. Дәріс № 4 Судың иондық көбейтіндісі Сутектік көрсеткіш (рН) Тұздар гидролизі
- 2. Судың диссоциациясыН2О Н+ + ОН-
- 3. (Н2О) =1,8 10-9 , бұл дегеніміз судың 50 000 000 молекуласынан - 1 молекула диссоциацияланады:
- 4. КН2О = Н+ОН- = = 1,810-16 55,56 = 10-14Н+*ОН- =10-14Сонда таза суда:
- 5. 1909 жылы Серенс терминдер енгізді сутектік көрсеткіш (рН) және гидроксильді көрсеткіш (рОН)СУДА:ОНДА:
- 6. Сутектік көрсеткішрН = - lg Н+
- 7. рН = 7 нейтралды ортарН
- 8. Кез келген ерітіндінің рН шамасы индикаторлық шкаламен анықталады
- 9. рН < 7 рН > 7 МалиновыйБесцветныйФенолфталеинЛакмусКрасныйФиолетовыйСинийМетилоранжРозовыйОранжевыйЖелтыйИндикаторлар0
- 10. Тұздар гидролизіТұздар гидролизі – тұз иондарының сумен
- 11. CH3COONa + HOH CH3COOН + NaOH
- 12. Гидролиз типтері1) әлсіз қышқыл және күшті негізден
- 13. 3Na+ + PO43- + 3HOН = H3PO4
- 14. 2) Әлсіз негіз,ty және күшті қышқылдан түзілген тұз катион бойынша гидролизденеді (орта қышқылдық, рН
- 15. 1 сатыFeCl2 Fe2+ + 2Cl-Fe2+ +
- 16. 3) Әлсіз негізбен әлсіз қышқылдан түзілген тұз
- 17. Қайтымсыз гидролиз Al2S3 + 6H2O 2Al(OH)3 + 3H2S Мысалы, Cr2S3, Al2(SO3)2, Al2(CO3)2 т.б.
- 18. Гидролиздену дәрежесіГидролиздену дәрежесі - n – гидролизге ұшыраған молекулалар саныN – жалпы еріген молекулалар саны
- 19. Гидролиз константасы және гидролиздену дәрежесі
- 20. Гидролиз этилового спирта в организмеC2H5OH + Na
- 21. Күшті қышқыл ерітіндісінің рН анықтау [Н+]=Сқышқыл
- 22. Әлсіз қышқыл ерітіндісінің рН анықтау
- 23. Күшті негіз ерітіндісінің рН анықтау[ОН-] =СнегізрОН = -lg [ОН-]
- 24. Әлсіз негіз ерітіндісінің рН анықтау
- 25. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Дәріс № 4
Судың иондық көбейтіндісі
Сутектік көрсеткіш (рН)
Тұздар гидролизі
Буферлік жүйелер
Слайд 3(Н2О) =1,8 10-9 , бұл дегеніміз судың 50 000 000
молекуласынан - 1 молекула диссоциацияланады:
Слайд 51909 жылы Серенс терминдер енгізді сутектік көрсеткіш (рН) және гидроксильді
көрсеткіш (рОН)
СУДА:
ОНДА:
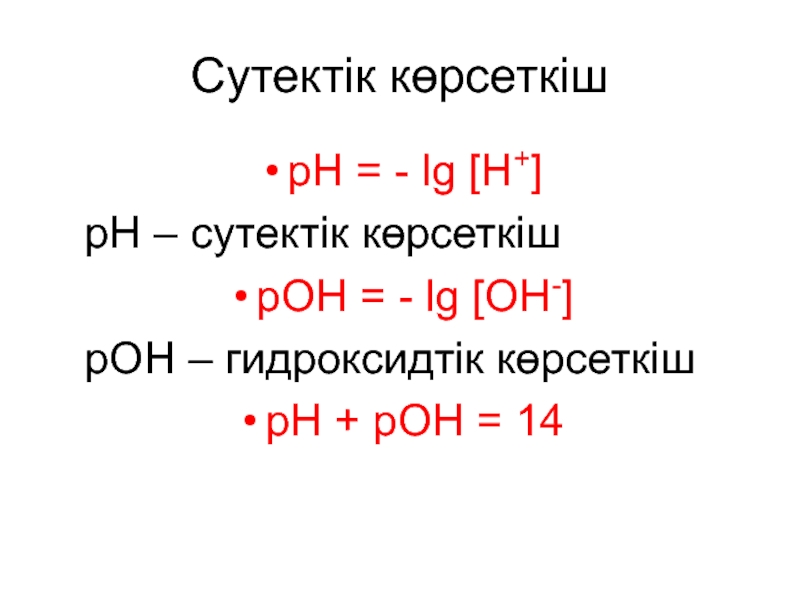
Слайд 6Сутектік көрсеткіш
рН = - lg Н+
рН – сутектік
көрсеткіш
рОН = - lg ОН-
рОН – гидроксидтік көрсеткіш
рН
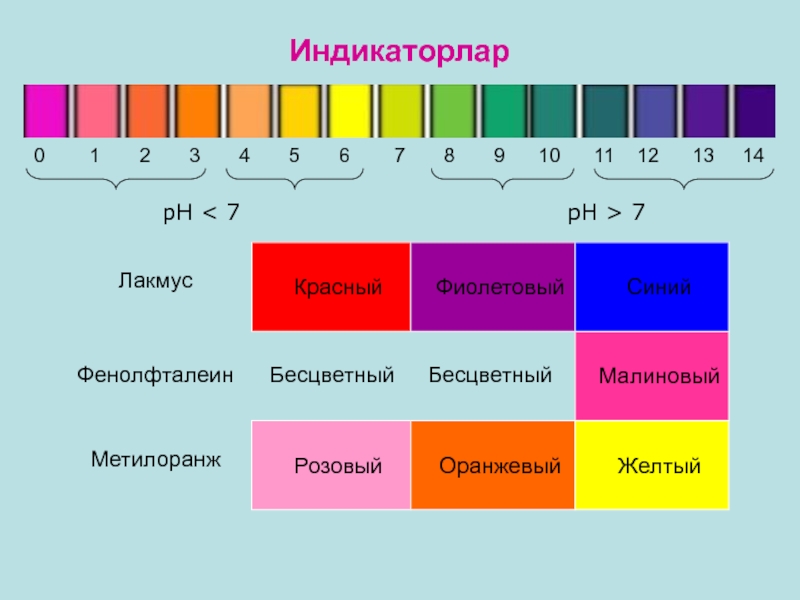
+ рОН = 14Слайд 9 рН < 7
рН > 7
Малиновый
Бесцветный
Фенолфталеин
Лакмус
Красный
Фиолетовый
Синий
Метилоранж
Розовый
Оранжевый
Желтый
Индикаторлар
0
1 2 3
4 5 6 7 8 9 10 11 12 13 14Бесцветный
Слайд 10Тұздар гидролизі
Тұздар гидролизі – тұз иондарының сумен әрекеттесу нәтижесінде тұз
ыдырып, әлсіз электролиттің (әлсіз қышқылдің не әлсіз негіздің) түзілу реакциясы
Гидролиздің
4 түрі белгіліСлайд 11
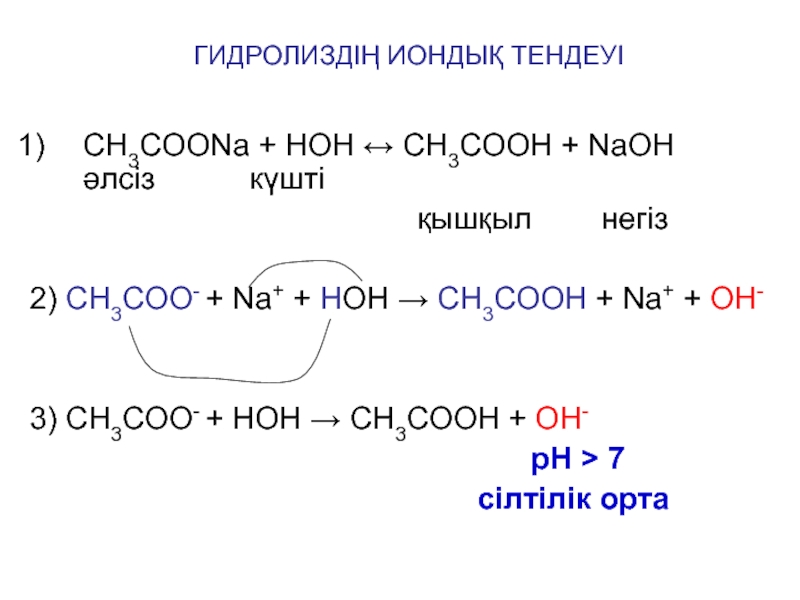
CH3COONa + HOH CH3COOН + NaOH
әлсіз күшті
қышқыл негіз
2) CH3COO- + Na+ + HOH CH3COOH + Na+ + OH-
3) CH3COO- + HOH CH3COOH + OH-
рН 7
сілтілік орта
ГИДРОЛИЗДІҢ ИОНДЫҚ ТЕНДЕУІ
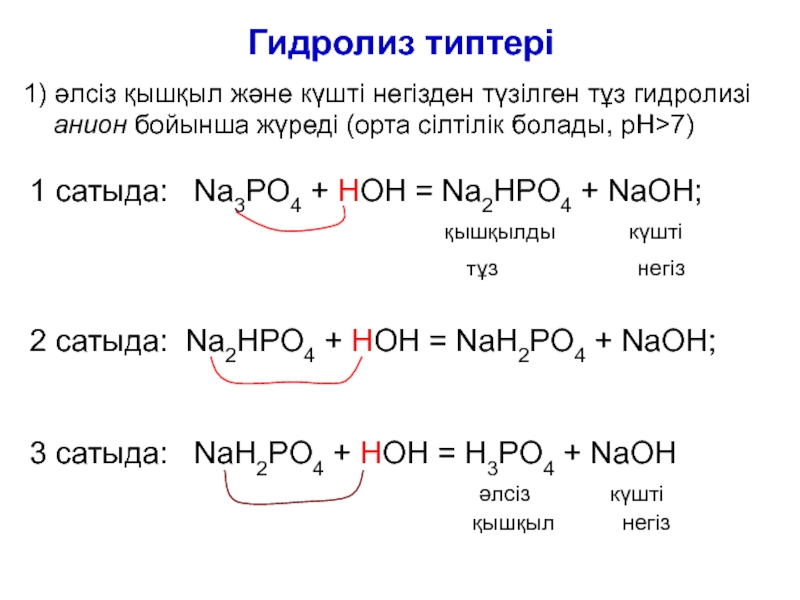
Слайд 12Гидролиз типтері
1) әлсіз қышқыл және күшті негізден түзілген тұз гидролизі
анион бойынша жүреді (орта сілтілік болады, рН>7)
1 сатыда: Na3PO4
+ HOН = Na2HPO4 + NaOH;қышқылды күшті
тұз негіз
2 сатыда: Na2HPO4 + HOН = NaH2PO4 + NaOH;
3 сатыда: NaH2PO4 + HOН = H3PO4 + NaOH
әлсіз күшті
қышқыл негіз
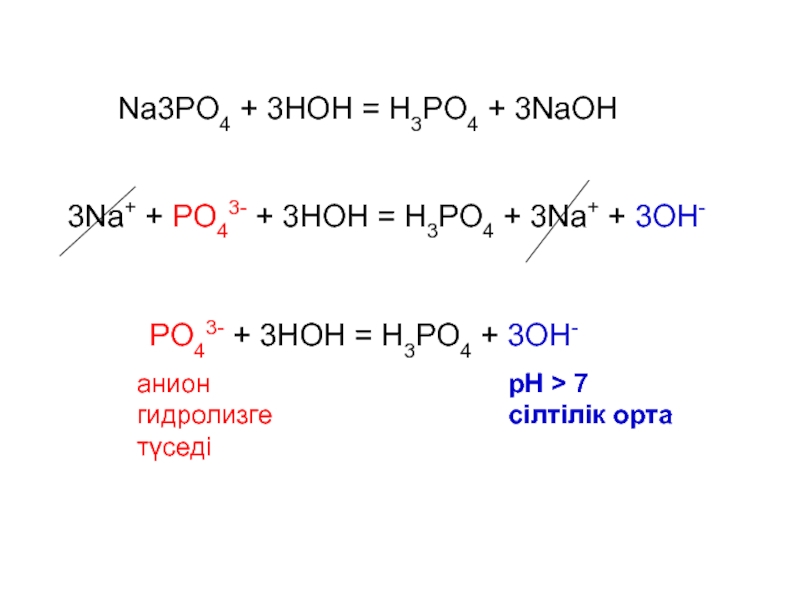
Слайд 133Na+ + PO43- + 3HOН = H3PO4 + 3Na+ +
3OH-
PO43- + 3HOН = H3PO4 + 3OH-
Na3PO4 + 3HOН =
H3PO4 + 3NaOHрН 7
сілтілік орта
анион
гидролизге
түседі
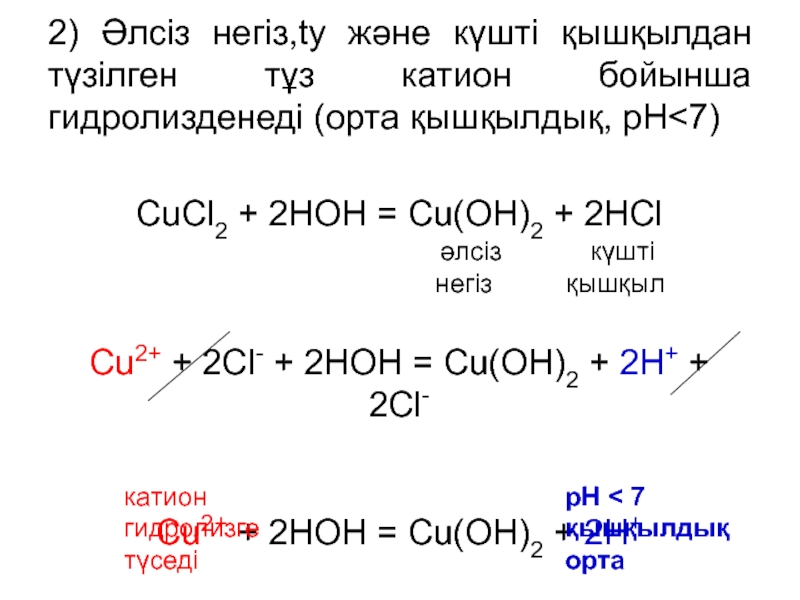
Слайд 142) Әлсіз негіз,ty және күшті қышқылдан түзілген тұз катион бойынша
гидролизденеді (орта қышқылдық, рН
әлсіз күштінегіз қышқыл
Cu2+ + 2Cl- + 2HOH = Cu(OH)2 + 2H+ + 2Cl-
Cu2+ + 2HOH = Cu(OH)2 + 2H+
катион
гидролизге
түседі
рН < 7
қышқылдық орта
Слайд 151 саты
FeCl2 Fe2+ + 2Cl-
Fe2+ + HOH (FeOH)+
+ H+ pH 7
FeCl2 + HOH
FeOHCl + HCl2 саты
FeOHCl (FeOH)+ + Cl-
(FeOH)+ + НОН Fe(OH)2 + H+
FeOHCl + НОН Fe(OH)2 + HСl
Слайд 163) Әлсіз негізбен әлсіз қышқылдан түзілген тұз катион және анион
бойынша гидролизденеді (орта бейтарап болады, рН =7)
Al2S3 + 3H2O =
2Al(OH)3 + 3H2Sәлсіз қышқыл әлсіз негіз
4) Күшті негізбен күшті қышқылдан түзілген тұз гидролизденбейеді (орта бейтарап болады, рН =7)
NaCl + H2O = NaOH + HСl
күшті негіз күшті қышқыл
НОН = H+ + OH-
Слайд 17Қайтымсыз гидролиз
Al2S3 + 6H2O 2Al(OH)3 + 3H2S
Мысалы, Cr2S3, Al2(SO3)2, Al2(CO3)2 т.б.
Слайд 18Гидролиздену дәрежесі
Гидролиздену дәрежесі -
n – гидролизге ұшыраған молекулалар саны
N
– жалпы еріген молекулалар саны
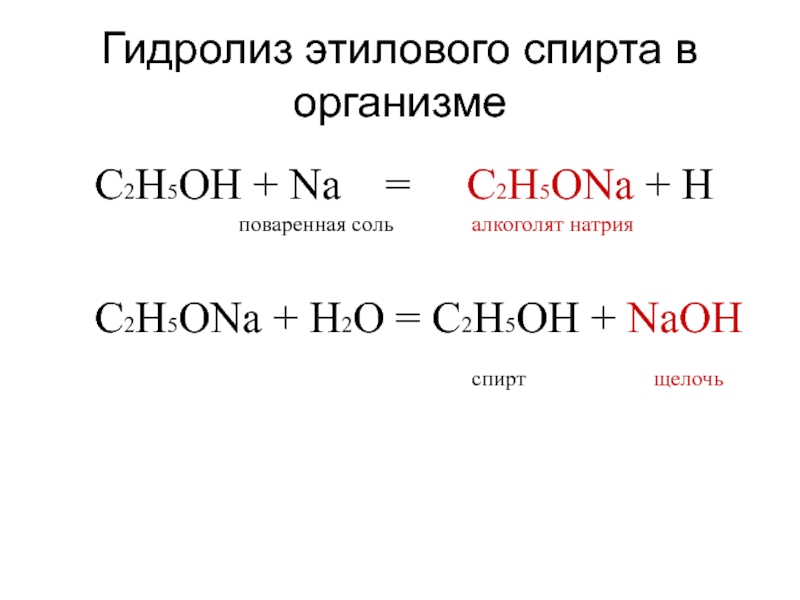
Слайд 20Гидролиз этилового спирта в организме
C2H5OH + Na =
C2H5ONa + H
поваренная соль алкоголят натрияC2H5ONa + H2O = C2H5OH + NaOH
спирт щелочь













![Дәріс № 4 Судың иондық көбейтіндісі Сутектік көрсеткіш (рН) Тұздар гидролизі Күшті қышқыл ерітіндісінің рН анықтау [Н+]=Сқышқыл Күшті қышқыл ерітіндісінің рН анықтау [Н+]=Сқышқыл](/img/thumbs/f7685a67fb0dc9904706def71945585f-800x.jpg)
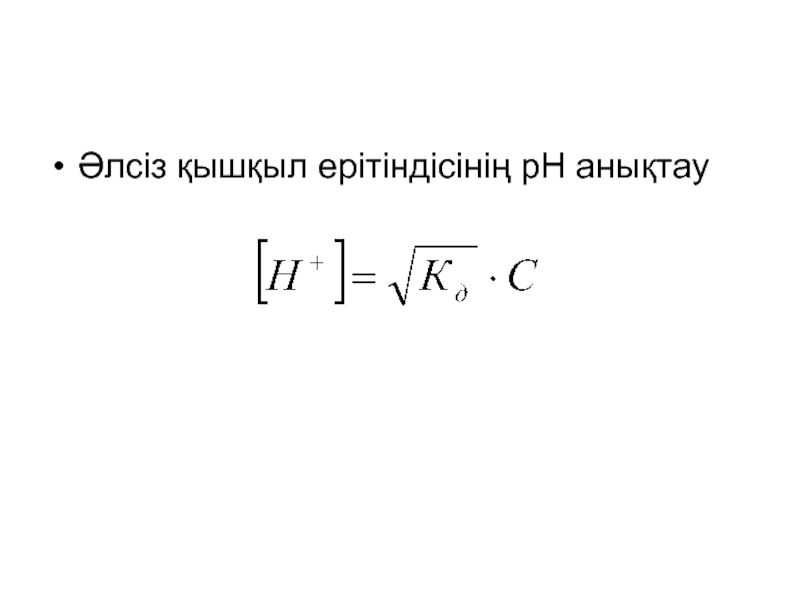
![Дәріс № 4 Судың иондық көбейтіндісі Сутектік көрсеткіш (рН) Тұздар гидролизі Күшті негіз ерітіндісінің рН анықтау[ОН-] =СнегізрОН = -lg [ОН-] Күшті негіз ерітіндісінің рН анықтау[ОН-] =СнегізрОН = -lg [ОН-]](/img/tmb/4/333274/8ebe9b84164868c9eae38310f22bd2d2-800x.jpg)




















