Слайд 1Единый государственный экзамен
Химия 2021
Задание 2
ЕГЭ
Слайд 2Задание 2. Закономерности изменения химических свойств элементов и их соединений
по периодам и группам.
Общая характеристика металлов IА – IIIА
групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов.
Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д. И. Менделеева и особенностям строения их атомов.
Общая характеристика неметаллов IVА – VIIА групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов.
Слайд 3Примерное время выполнения задания – 2 - 3 минуты
Уровень сложности
задания – базовый
Максимальный балл за выполнение задания - 1
Задание №
2 рассчитано на проверку понимания смысла периодического закона Д. И. Менделеева и умения использовать его для качественного анализа и обоснования основных закономерностей строения атомов, определения свойств химических элементов и их соединений.
Задание содержит пять химических элементов, из которых необходимо выбрать три одного периода или одной группы и расположить их в порядке согласно формулировке задания. В ответе надо записать цифры, под которыми указаны выбранные элементы.
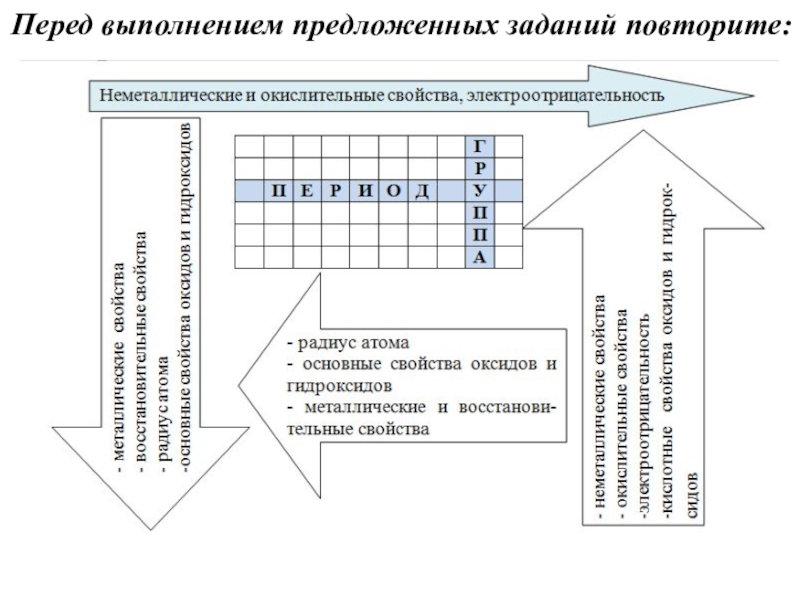
Слайд 4Перед выполнением предложенных заданий повторите:
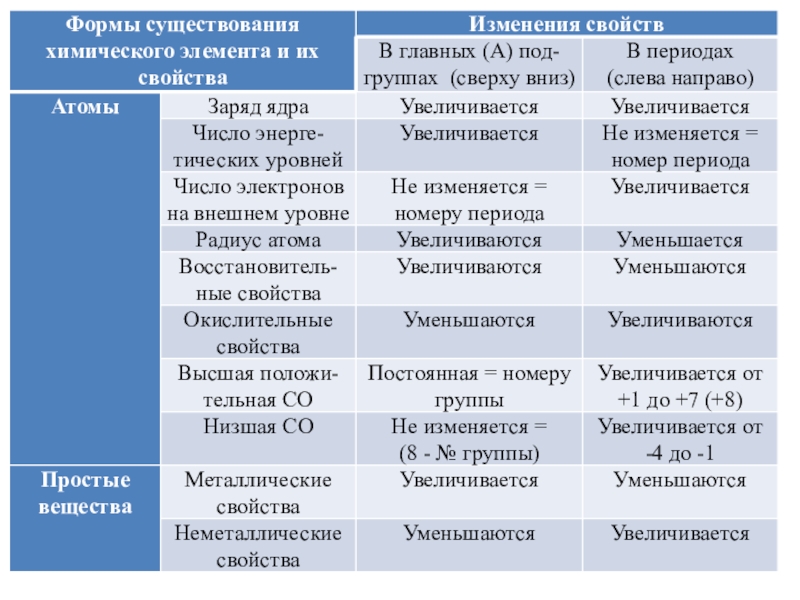
Слайд 5Радиус атома – расстояние от ядра атома до электрона, находящегося
на внешнем слое электронной оболочки атома. Количество электронных слоев равно
номеру периода, соответственно, вниз по группе число электронных слоев увеличивается, а значит, радиус атома возрастает.
В побочных подгруппах радиус атома изменяется неравномерно, поэтому в подобных заданиях ОГЭ такие элементы не встречаются.
Вправо по периоду (среди элементов главных подгрупп) количество электронов на внешнем уровне увеличивается, но общее число уровней остается без изменений. Отрицательно заряженные электроны притягиваются к положительно заряженному ядру, и чем больше их в пределах одного уровня, тем больше сила этого притяжения – атом немного сжимается. Вправо по периоду (среди элементов главных подгрупп) радиус атома уменьшается.
Слайд 6Электроотрицательность – это способность атома притягивать к себе валентные электроны
других атомов. Элементы VIIIА группы – благородные газы – имеют
завершенный внешний уровень, поэтому обладают нулевой электроотрицательностью. Самым электроотрицательным элементом является фтор F, второй по электроотрицательности – кислород О, третий – хлор Cl. Чем ближе элемент ко фтору в периодической системе, тем выше его электроотрицательность.
Металлы обладают небольшой электроотрицательностью и, наоборот, склонны отдавать свои электроны. Электроотрицательность увеличивается вправо по периоду и вверх по подгруппе.
Слайд 7Металлические свойства – совокупность физико – химических свойств, характерных для
элементов и их простых веществ, которым соответствуют простые вещества –
металлы. Металлы – простые вещества, обладающие характерным металлическим блеском, высокой электро- и теплопроводностью, пластичностью, ковкостью.
Металлические свойства усиливаются вниз по подгруппе и влево по периоду.
Неметаллические свойства являются противоположностью металлическим и, соответственно, усиливаются вверх по подгруппе и вправо по периоду.
Слайд 8Кислотные свойства – совокупность свойств, которые определяют поведение кислот в
химических реакциях, например взаимодействие с основными оксидами и основаниями.
Основные свойства
являются противоположностью кислотным и показывают поведение оснований в химических реакциях.
Кислотные свойства оксидов и гидроксидов усиливаются вправо по периоду и вверх по подгруппе.
Основные свойства оксидов и гидроксидов усиливаются влево по периоду и вниз по подгруппе.
Слайд 9Окислительные свойства – способность атома или иона принимать электроны, понижая
свою степень окисления.
Восстановительные свойства – способность атома или иона отдавать
электроны, повышая свою степень окисления.
Окислительные свойства усиливаются вправо по периоду и вверх по подгруппе, восстановительные – влево по периоду и вниз по подгруппе.
Слайд 10Существуют частицы, которые могут проявлять только окислительные свойства (например, Na+,
S+6) – степень окисления атома максимальная.
Некоторые частицы проявляют только
восстановительные свойства (например, S-2, F-) – степень окисления атома минимальная.
Но есть частицы, которые способны проявлять как окислительные, так и восстановительные свойства, например, атомы в них находятся в промежуточной степени окисления (например, N+3, S+4, Fe+2).