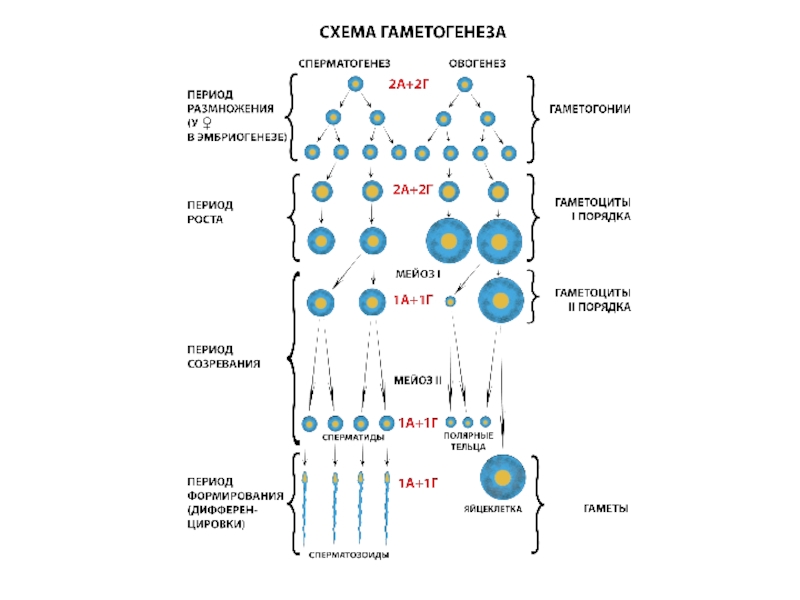
Слайд 1Экспериментальная терапия клеточными культурами нарушений спермато- и овогенеза
Скачкова Т. Е.
Слайд 2Актуальность темы
Во всем мире проблема инфертильности имеет не только важное
медицинское, но социальное значение. Демографические показатели России и многих стран
мира свидетельствуют об увеличении частоты инфертильности у мужчин, достигающей в среднем от 30 до 50 %. Доля «мужского» фактора бесплодия в общей доле бесплодных браков составляет по некоторым данным от 30 до 40 %
В связи с увеличением числа бесплодных браков, на фоне увеличения доли мужского бесплодия, актуальной задачей на сегодняшний день, является разработка новых методов лечения инфертильности у мужчин.
Эффективность трансплантации, при пересадке культур, обогащенных сперматогенными стволовыми клетками у животных, в различных вариантах по разным данным, колеблется от 18 до 80% . Большая разница в показателях, полученная при оценке результатов этих исследований требует изучения эффекта трансплантации обогащенными клеточными культурами или препаратами, содержащими стволовые клетки разных видов, а также для оценки возможности восстановления фертильности и безопасности такой процедуры.
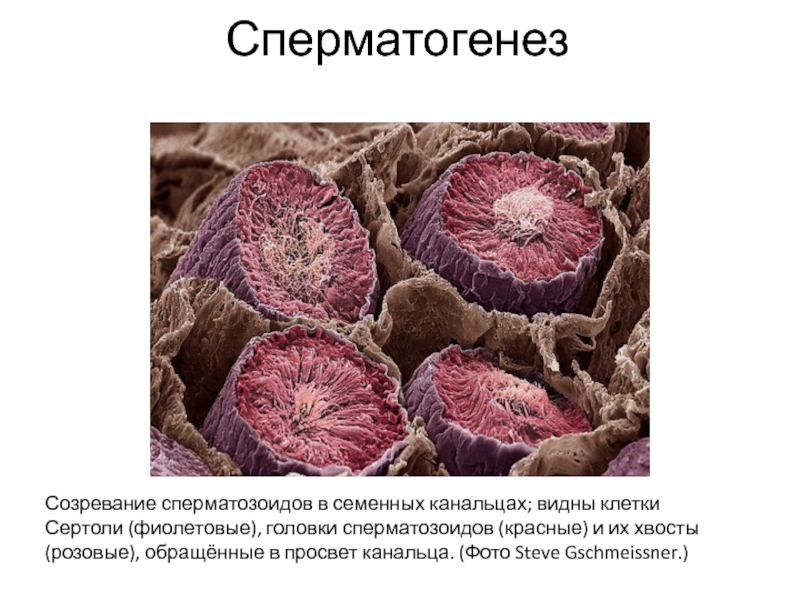
Слайд 4Сперматогенез
Созревание сперматозоидов в семенных канальцах; видны клетки Сертоли (фиолетовые), головки
сперматозоидов (красные) и их хвосты (розовые), обращённые в просвет канальца.
(Фото Steve Gschmeissner.)
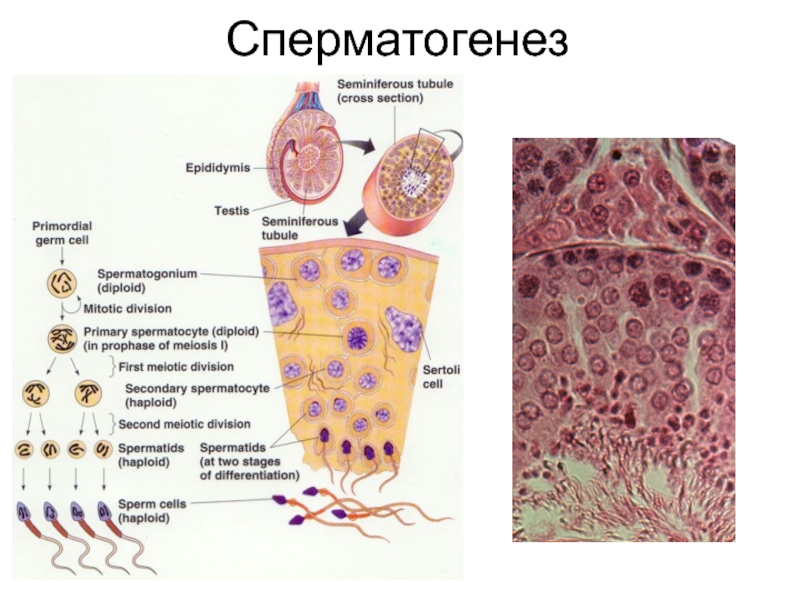
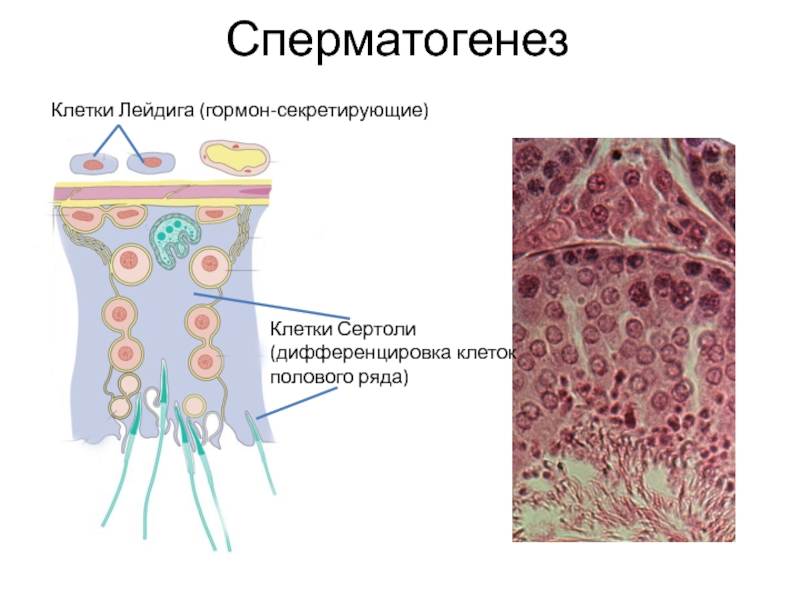
Слайд 6Сперматогенез
Клетки Лейдига (гормон-секретирующие)
Клетки Сертоли
(дифференцировка клеток полового ряда)
Слайд 7Трансплантация сперматогенных стволовых клеток в эксперименте и клинической практике
Объект: крыса
Спермальные
стволовые клетки в идеале должны иметь неограниченный потенциал делений, для
того, чтобы обеспечить сохранение и воспроизводство популяции сперматозоидов на всем протяжении жизни мужчины.
Активность деления ССК обусловлена наличием свободного места для размещения дочерних клеток в свободной зоне, при отсутствии свободных участков скорость делений снижается. Таким образом, скорость делений ССК ограничивается не снижением потенциала деления, а отсутствием свободных мест для размещения дочерних клеток. Отмечено, что при пересадке ССК новорожденным животным ССК образуют гораздо большее число колоний, чем при трансплантации взрослым животным, что связано с гораздо более благоприятными условиями для трансплантации.
При пересадке ССК приблизительно 10% клеток способны формировать колонии у донора
(НИИ урологии Росмедтехнологий)
Слайд 8Трансплантация сперматогенных стволовых клеток в эксперименте и клинической практике
Объект: крыса
Клетки
Сертоли взаимодействуют со стволовыми гонадными клетками, образуя благоприятную окружающую среду
для сперматогенеза. Культивированные клетки Сертоли при трансплантации животным донорам вызывают пролиферацию семенных канальцев и усиление сперматогенеза. Причем трансплантация культуры клеток Сертоли от эмбрионов оказывала более выраженный эффект, чем аналогичная культура от взрослых животных. Встречаются работы, которые свидетельствуют о возможности трансплантации культуры клеток Сертоли между разными животными, вызывая при этом усиление сперматогенеза.
Деление CСК, проходит на базальной мембране, в специально защищенных условиях. Причем деление клеток происходит относительно базальной мембраны. Если деление идет параллельно базальной мембраны, то клетка диффернцируется в аналогичную стволовую клетку. Если биологическая ниша формируется на отдалении от базальной мембраны, то дифференцировка идет вертикально, и СК дает начало для нового типа клеток.
(НИИ урологии Росмедтехнологий)
Слайд 9ТРАНСПЛАНТАЦИЯ КЛЕТОК СЕМЕННИКОВ
Объект: человек
Для лечения больных с гипофункцией мужских половых
желез стали применять трансплантацию клеток Лейдига. Обычно к трансплантационному лечению
прибегают при недостаточной эффективности медикаментозной заместительной терапии. С целью предотвращения отторжения пересаженных клеток Лейдига их можно помещать в микрокапсулы, хорошо проницаемые для тестостерона и стимулирующих его секрецию гонадотропинов. Эксперименты на кастрированных животных показали, что микроинкапсулированные клетки Лейдига, помещенные в полость брюшины ксеногенных реципиентов, способны обеспечить полную компенсацию тестостероновой недостаточности по меньшей мере в течение 2 месяцев после трансплантации.
Более физиологичным является использование для пересадки органных (органотипических) культур мужских половых желез, так как они содержат не только клетки Лейдига, продуцирующие тестостерон, но и выполняющие трофическую функцию клетки Сертоли, а также другие структурные элементы, обеспечивающие сохранность межклеточных взаимоотношений, подобные тем, которые имеют место в целой железе

Слайд 10Трансплантация сперматогенных стволовых клеток в эксперименте и клинической практике
Для восстановления
сперматогенеза и фертильности используются различные варианты трансплантации:
А) ксеногеные трансплантации
сохраняются все
условия для возникновения и поддержания функции сперматогенеза от донора. У мышей развивались сперматозоиды крысы, которые в дальнейшем использовались для получения потомства у крыс. Собственные сперматозоиды у мышей не восстанавливались.
Б) аллогенные трансплантации
трансплантация сперматогониальных стволовых клеток у животных одного вида от фертильных к инфертильным животным приводила к восстановлению сперматогенеза у реципиентов
В) сингенные трансплантации
Геном донора аналогичен геному реципиента
Слайд 11Ксенотрансплантация обогащенных клеточных
культур различных видов при экспериментальном
лечении инфертильности
Объект: крыса
Экспериментальным животных
создавалось состояние двухстороннего крипторхизма в течение 3 недель. Затем яички
низводились мошонку с одновременной субкапсулярной трансплантацией обогащенной клеточной культуры. Препараты клеточных культур были изготовлены из абортивного материала ткани плода человека в возрасте 16 недель
Были использованы обогащенная культура мезенхимальных стволовых
клеток, обогащенная клеточная культура, содержащая сперматогенные стволовые
клетки и суммарная обогащенная культура стволовых и прогениторных клеток костного мозга, лишенная эритроцитов.
Контрольная группа животных перенесла субкапсулярное введение эквивалентного количества изотонического раствора хлорида натрия. Фертильность определялась на 21, 72 и 108 сутки после низведения яичек.
(НИИ урологии Росмедтехнологий)
Слайд 12Ксенотрансплантация обогащенных клеточных
культур различных видов при экспериментальном
лечении инфертильности
Слайд 13Brian P. Hermann, Школа медицины Университета Питтсбурга
Объект: обезьяна
Сперматогонии из ткани
яичек обезьян, взятые до химиотерапии, приводящей к бесплодию, при трансплантации
обратно в яички после лечения образуют нормальные по функции сперматозоиды.
Сбразцы ткани яичка у 12 взрослых обезьян и 5 обезьян подросткового возраста, после чего проводили химиотерапию для нарушения фертильности. Затем проводилась аутологичная трансплантация сперматогоний обратно в яички.
Меченные стволовые клетки присутствовали в эякулированной сперме у 9 взрослых обезьян и 3 обезьян подросткового возраста (после достижения ими половой зрелости). Аналогичные аллогенные трансплантированные клетки у 6 взрослых особей привели к химеризму «донор-реципиент» в эякуляте 2 животных (наличие клеток с генетическим материалом донора и реципиента). Эякулированные клетки одного аллогенного трансплантата были введены в 85 ооцитов, из которых в 81 случаев развился плод (от 4 клеток до бластоцита).
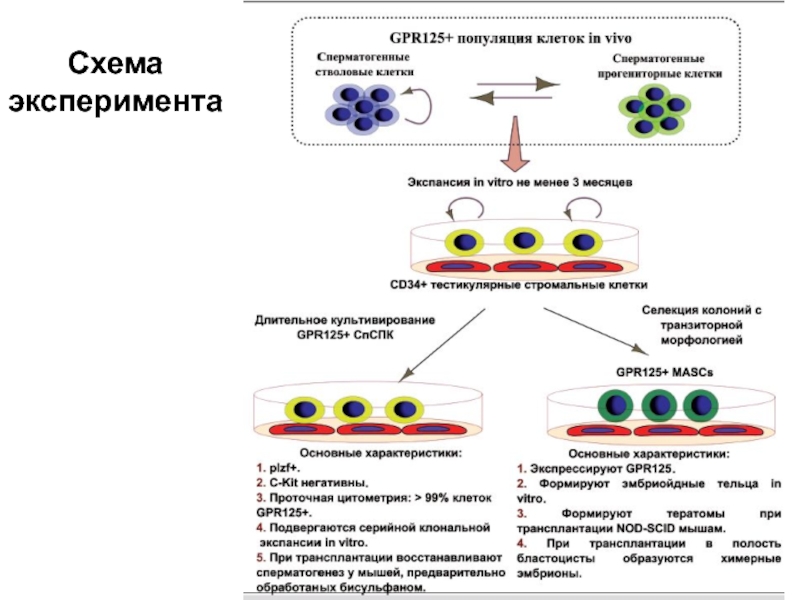
Слайд 14Получение мультипотентных клеток из сперматогенных стволовых клеток
Выделенные из протоков извитых
семенных канальцев клетки быстро теряют пролиферативную активность. Используя специфический коктейль
факторов роста удалось культивировать сперматогенные стволовые/пролифераторные клетки мыши в течение длительного времени. После пятимесячного культивирования трансплантация полученных клеток бесплодным мышам приводила к восстановлению сперматогенеза. Формирования тератом не наблюдалось.
После 4-7 недель культивирования выявляютя колонии клеток, по морфологии сходных с ЭСК. Они дифференцировались в разные виды соматических клеток и формировали тератомы при трансплантации иммунодефицитным мышам, могли формировать химерные эмбрионы при имплантации в бластоцист.
Слайд 16Получение плюрипотентных стволовых клеток из семенников взрослых мужчин
У взрослых млекопитающих
мужские половые клетки включают популяцию стволовых сперматогенных клеток (ССпК), которые
обеспечивают постоянный сперматогенез в течение всей жизни. ССпК происходят от первичных половых клеток (ППК) эмбриона, которые имеют внегонадное происхождение и вступают в процесс дифференцировки после миграции в гонады. При культивировании ППК мышей и человека в определенных условиях формируются колонии плюрипотентных клеток, обладающих сходными с ЭСК характеристиками
В 2003 г., используя специфический коктейль факторов роста, в состав которого входили нейротрофический глиальный фактор роста (glial cell line-derived neurotrophic factor, GDNF), EGF, bFGF и LIF, японской команде T. Shinohara удалось выделить и культивировать сперматогенные клетки-предшественницы мыши в течение длительного времени. Их преимущество по перед, например, iPS-клетками состоит в отсутствии использования вирусных методов доставки генов плюрипотентности. Однако если рассматривать возможность аутогенной трансплантации таких клеток, то их использование будет ограничено рамками мужского пола.

Слайд 17Эмбриональные стволовые клетки как потенциальный источник гамет
in vitro
ЭСК имеют способность
формировать in vitro клетки всех тканей и органов взрослого организма,
и поэтому представляют собой ценный источник для получения in vitro донорского материала для заместительных биомедицинских технологий при лечении широкого спектра заболеваний человека.
У ооцита удаляется полярное тельце с метафазной пластинкой и вводится ядро соматической клетки. После активации такого комплекса сконструированный зародыш краткосрочно культивируют до стадии бластоцисты, а затем из клеток ВКМ выделяют ЭСК, которые будут аутологичны для донора кариопласта. Ооплазма ооцита может репрограммировать ядро дифференцированной клетки взрослого организма в обратном направлении до состояния тоти- и полипотентности.
Получение в культуре функционально активных гаплоидных мужских и женских гамет в результате дифференцировки диплоидных ЭСК представляет огромный интерес.
(НИИ экспериментальной ветеринарии им. Я.Р. Коваленко, Москва)
Слайд 18Дифференцировка ЭСК в
женские половые клетки in vitro.
Объект: мышь
В эксперименте
использовали генетически трансформированные ЭСК с фенотипом gcOct4—GFP+. Для их создания
использовали рекомбинантную конструкцию, в которой репортерный ген зеленого флюоресцирующего белка (GFP) был поставлен под контроль промотора гена Oct4. Ген Oct4 — транскрипционный фактор, который экспрессируется только в тоти- и полипотентных клетках эмбрионов млекопитающих до стадии гаструляции.
Это позволило авторам последовательно с помощью неоднократной проточной цитофлюорометрии отобрать интересующие исследователей клоны в процессе их дифференцировки, так как фенотип gcOct4–GFP+ могли иметь
половые клетки, а не клетки эпибласта и бластоцисты. Отсортированные клетки формировали в суспензии клеточные агрегаты, схожие с ранними фолликулами яичников.
Ооцитподобные комплексы в культуре развивались в структуры, схожие с бластоцистами, как предполагают авторы, образованными в результате спонтанной партеногенетической активации.
Получение in vitro ооцитов человека без участия женщины-донора вызывает бурную реакцию со стороны общественности.

Слайд 19Дифференцировка ЭСК в
мужские половые клетки in vitro.
Объект: мышь
Год: 2003
ЭСК
могут дифференцироваться в гоноциты in vitro, а затем могут in
vitro формировать сперматогониальные клетки и даже гаплоидные сперматиды и сперматозоиды.
Клетки с фенотипом Mvh-lacZ+, полученные из ЭСК, смешивали с соматическими клетками гонад, выделенных из тестикул самцов 12,5—13,5 суточного возраста, смешивали и переносили под капсулу семенника реципиента. Через 6—8 нед после переноса трансплантаты формировали под капсулой структуры, похожие на семенные канальцы. Когда под капсулу тестикул реципиентов переносили недифференцированные ЭСК наблюдали формирование тератом, отрицательных по lacZ.
В результате инъекции созданных in vitro клеток с фенотипом, подобным
сперматозоидам, в ооцит были получены in vitro ранние предимплантационные эмбрионы.
Слайд 20Дифференцировка ЭСК в гаметы
перспективы.
Искусственно созданные in vitro гаметы служат уникальным
объектом для исследования процессов их специализации, миграции, пролиферации, половой детерминации
в развитии.
Использование половых клеток человека, полученных из ЭСК in vitro, позволит определить токсичность лекарственных препаратов, в том числе контрацептивов, на различных стадиях развития гамет.
«Сперматозоидоподобные» клетки (sperm-like cells), полученные этим способом, непригодны для оплодотворения
Слайд 21Постнатальный овогенез и стволовые клетки костного мозга
Объект: человек
Во взрослом организме
мыши могут заново образовывать фолликулы, которые берут происхождение от терминальных
[герминативных] стволовых клеток [ГерСК]. Клетки костного мозга могут повлиять на этот процесс.
Клинический случай рождения ребёнка пациенткой, прошедшей курс химиотерапии с последующей аллогенной пересадкой костного мозга. В большинстве случаев, подобное лечение (как и само заболевание] приводит к бесплодию, так как затрагивает практически все делящиеся клетки организма, разрушает овоциты и другие клетки половой системы, находящиеся на различных стадиях созревания. Однако существуют данные, что у небольшого количества пациентов все же сохраняется способность к зачатию.
Слайд 22Постнатальный овогенез и стволовые клетки костного мозга
В описанном случае у
пациентки полностью восстановился гемопоэз, а через несколько лет появился менструальный
цикл. Через восемь лет после пересадки костного мозга пациентка смогла в возрасте 21 года забеременеть и родить здорового ребенка. Восстановление фертильности авторы объясняют тем фактом, что клетки костного мозга, способные выходить в кровоток под воздействием различных стимулов, заново населяют яичники и начинают выполнять функции половых клеток.
Если со временем все-таки появится неопровержимое доказательство участия клеток донорского трансплантата в развитии яйцеклеток и последующей беременности, это может вызвать возникновение этических противоречий, а также оказать значительно социальное и психологическое влияние как на пациентов и их потомков, так и на доноров костного мозга.
Слайд 23И все таки самое главное в теме восстановления фертильности -
счастливый долгожданный финал!!
Спасибо за внимание