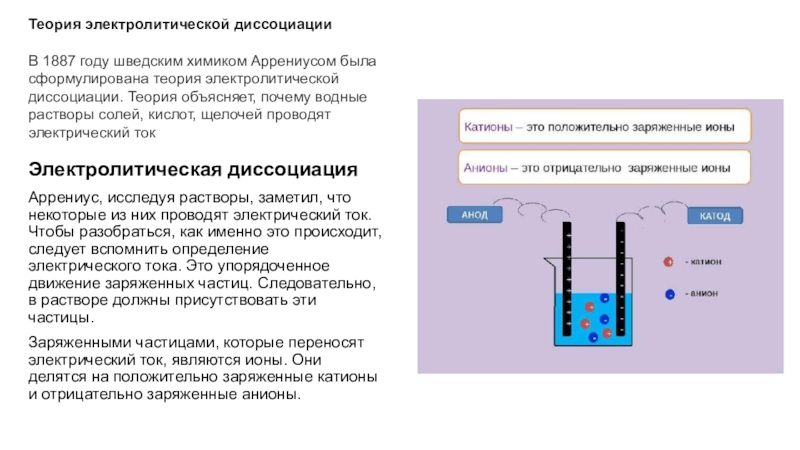
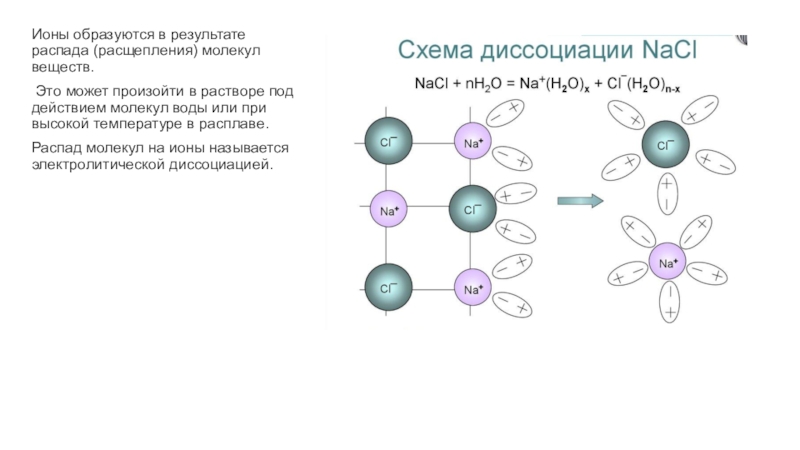
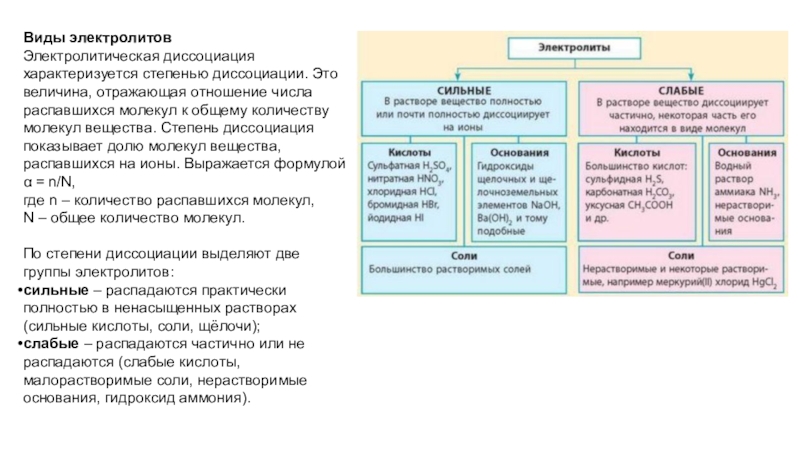
электрический ток. Чтобы разобраться, как именно это происходит, следует вспомнить
определение электрического тока. Это упорядоченное движение заряженных частиц. Следовательно, в растворе должны присутствовать эти частицы.Заряженными частицами, которые переносят электрический ток, являются ионы. Они делятся на положительно заряженные катионы и отрицательно заряженные анионы.
Теория электролитической диссоциации
В 1887 году шведским химиком Аррениусом была сформулирована теория электролитической диссоциации. Теория объясняет, почему водные растворы солей, кислот, щелочей проводят электрический ток