Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ЭЛЕКТРОЛИЗ
Содержание
- 1. ЭЛЕКТРОЛИЗ
- 2. Электролиз-это совокупность окислительно-восстановительных процессов,протекающих при прохождении постоянного
- 3. Катод-это отрицательно заряженный электрод -он обозначается K(-)Анод – это положительно заряженный электрод- он обозначается A(+)
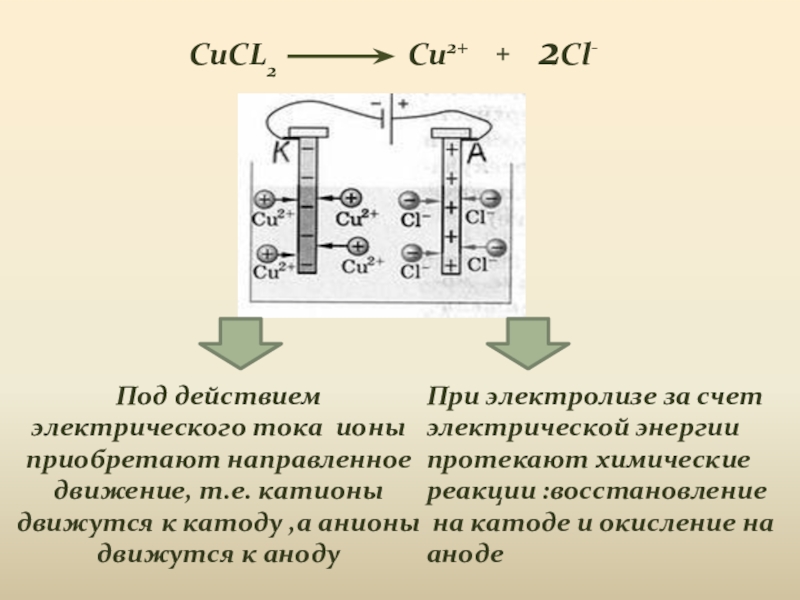
- 4. Под действием электрического тока ионы приобретают направленное
- 5. Английский физик и химик, один из основателей
- 6. Первые его работы в области
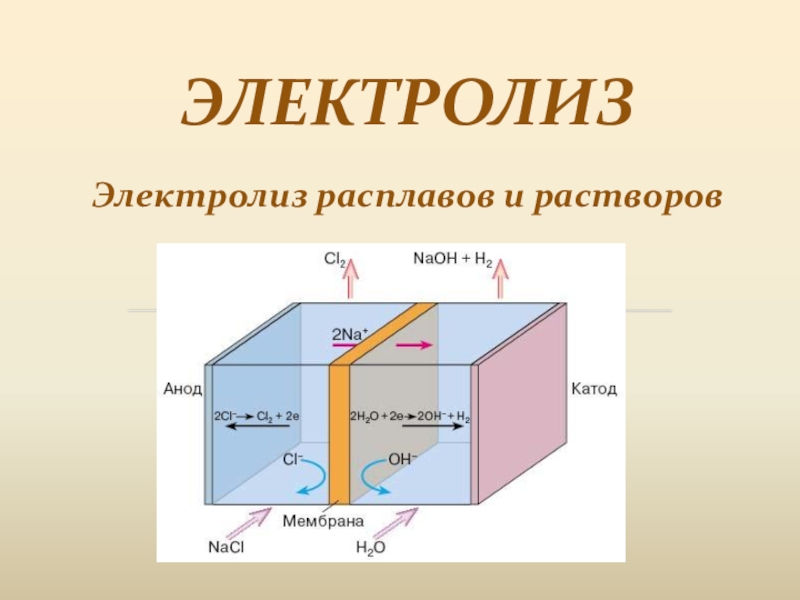
- 7. Сущность электролиза изображают с помощью схемы ,
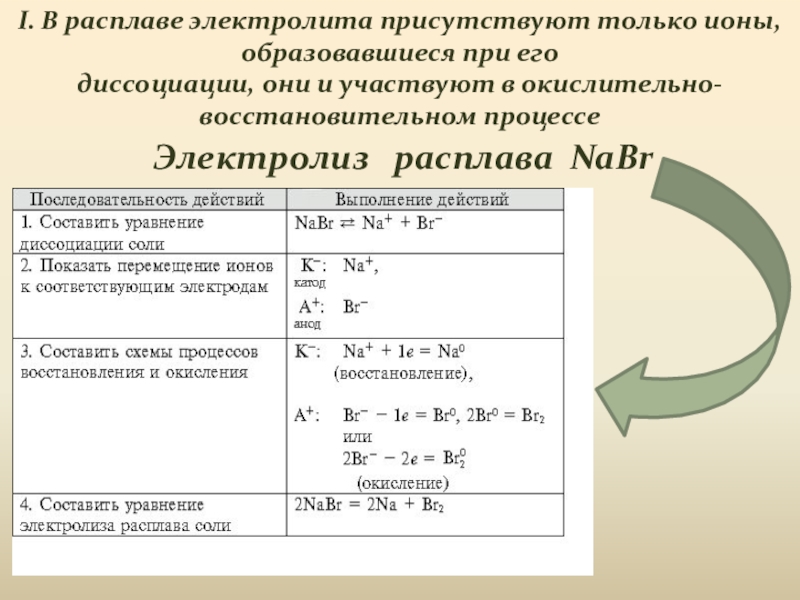
- 8. Электролиз расплава NaBrI. В расплаве электролита
- 9. Электролиз расплава NaOH
- 10. II. Электролиз водного раствора электролитаВ отличии от
- 11. MnZnCrFeCoNiSnPbЕсли у катода накапливаются катионы металла (стоящего
- 12. 3) Если у катода накапливаются катионы металла,который
- 13. Последовательность разрядки анионов на аноде зависит от
- 14. 3) При электролизе растворов щелочей окисляются гидроксид-ионы4OH-
- 15. А знаете ли вы, что…..Современную жизнь без электролиза представить себе уже невозможно….
- 16. Применение электролизаЭлектролизом расплавов природных соединений получают активные
- 17. Слайд 17
- 18. Но…..уже в середине XIX века некоторые химики
- 19. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Электролиз-это совокупность окислительно-восстановительных процессов,протекающих при прохождении постоянного электрического тока через
раствор или расплав электролита с погруженными в него электродами
Слайд 3Катод-это отрицательно заряженный электрод -он обозначается K(-)
Анод – это положительно
заряженный электрод- он обозначается A(+)
Слайд 4Под действием электрического тока ионы приобретают направленное движение, т.е. катионы
движутся к катоду ,а анионы движутся к аноду
CuCL2
Cu2+
+
2Cl-
При электролизе за
счет электрической энергии протекают химические реакции :восстановлениена катоде и окисление на аноде
Слайд 5Английский физик и химик,
один из основателей электрохимии
В конце
18 века он приобрел репутацию хорошего химика. В первые годы
XIX века Дэви увлекся изучением действия электрического тока на различные вещества, в том числе на расплавленные соли и щелочиСлайд 6
Первые его работы в области электрохимии были посвящены
изучению действия электрического тока на химические соединения.
Он показал, что
электрический ток вызывает разложение (электролиз) кислот и солей.Дэви получил электролизом два новых металла из расплавов их соединений - калий и натрий
Тридцатилетний ученый сумел в течение двух лет получить также в свободном виде еще ранее неизвестные металлы: барий, кальций, магний и стронций.
Это стало одним из самых выдающихся событий в истории открытия новых металлов
Слайд 7Сущность электролиза изображают с помощью схемы , которая
показывает диссоциацию
электролита, направление движения ионов, процессы на электродах и выделяющиеся вещества
NaCl
Na+ + CL-K(-)
A(+)
Na+ + 1e-=Na0
2Cl- -2e-=CL2o
2NaCL 2Na + Cl2
Слайд 8Электролиз расплава NaBr
I. В расплаве электролита присутствуют только ионы,
образовавшиеся при его
диссоциации, они и участвуют в окислительно-восстановительном процессе
Слайд 10II. Электролиз водного раствора электролита
В отличии от расплава в растворе
электролита кроме ионов, получившихся при его диссоциации, присутствуют еще и
молекулыводы, а также ионы H+ и OH-
Слайд 11MnZnCrFeCoNiSnPb
Если у катода накапливаются катионы металла (стоящего в ряду напряжений
после H2), то восстанавливаются ионы металла
Cu2++2e-=Cu0
2) Если у катода накапливаются
катионы металла,стоящего в начале ряда напряжений(по AL), то восстанавливаются ионы водорода из молекул воды вместо катиона данного металла
2H2O + 2e- = H2 + 2OH-
LiKBaCaNaMg
H2
CuAgHgAu
Al
Слайд 123) Если у катода накапливаются катионы металла,который расположен в ряду
напряжений (после AL и до H2),то будут протекать два процесса:
восстановление иона металла и ионов водорода из молекул водыZn2+ +2e-=Zn0
2H2O +2e-=H2 +2OH-
4) Если в растворе смесь катионов разных металлов, то сначала восстанавливается менее активный
5) При электролизе раствора кислоты на катоде восстанавливаются катионы водорода
2H+ +2e-=H20
LiKBaCaNaMgAl
MnZnCrFeCoNiSnPb
H2
CuAgHgAu
Слайд 13Последовательность разрядки анионов на аноде зависит от природы аниона:
1) При
электролизе растворов солей бескислородных кислот( кроме фторидов)
окисляются анионы кислотных остатков
2CL-
- 2e-=CL2F-, NO3-, SO42-, OH-, CL-, S2- , Br-, I-
Восстановительная активность анионов усиливается
Слайд 143) При электролизе растворов щелочей окисляются гидроксид-ионы
4OH- -4e-=O2 +2H2O
2) При
электролизе растворов солей
кислородосодержащих
кислот и фторидов идет процесс окисления гидроксид-ионов
из
молекул воды2H2O – 4e- =O2 +4H+
Слайд 16Применение электролиза
Электролизом расплавов природных соединений получают активные металлы
(K, Na,Be,Ca,Ba …)
Электролизом
растворов солей получают-
Zn, Cd, Co…..
Электролиз используют для получения -
F2,
CL2, H2, O2, NaOH и ….Слайд 18Но…..уже в середине XIX века некоторые химики указывали на то,
что алюминий можно получать путем электролиза. В 1854 году Роберт
Бунзен – немецкий химик-экспериментатор получил алюминий путем электролиза расплава хлористого алюминия (AlCl3)Сегодня в 21 веке невозможно представить нас без алюминия.
Этот блестящий легкий металл, прекрасный проводник электричества, получил в последние десятилетия самое широкое применение в различных отраслях производства.
И получают его много электролизом давно по отработанной технологии…