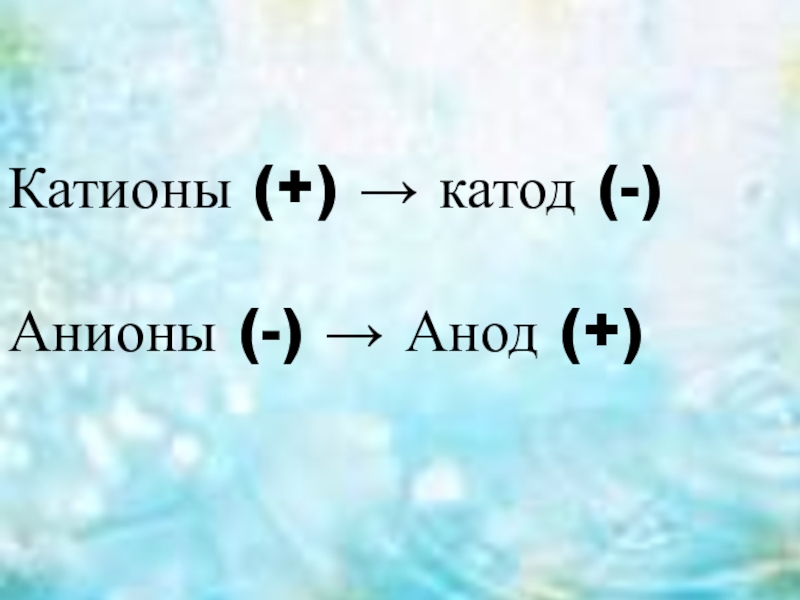Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролиз
Содержание
- 1. Электролиз
- 2. Электролиз – это окислительно – восстановительный процесс,
- 3. Катионы (+) → катод (-)Анионы (-) → Анод (+)
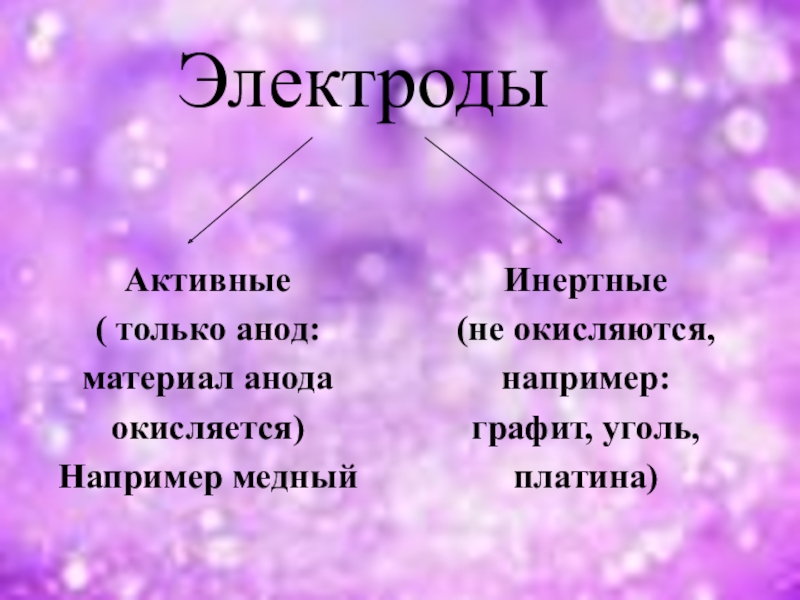
- 4. Электроды
- 5. 2 вида электролиза:- электролиз расплавов- электролиз растворов
- 6. Электролиз расплаваХлорида натрияNaCl → Na + +
- 7. Слайд 7
- 8. Правила восстановления анионов на аноде:a) если анод
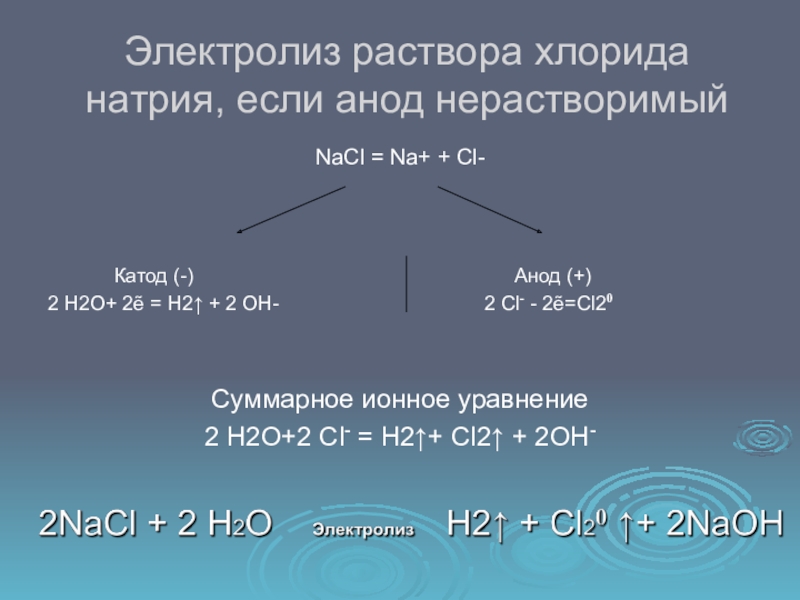
- 9. Электролиз раствора хлорида натрия, если анод нерастворимыйNaCl
- 10. Электролиз раствора сульфата меди (II) на нерастворимом
- 11. Cu2+ +2ẽ = Cu0
- 12. Электролиз раствора гидроксида калия на нерастворимом аноде:КОН
- 13. 2 Н2О+ 2 ẽ = Н2↑+ 2ОН-
- 14. Суммарное молекулярное уравнение:2 Н2О Электролиз 2Н2↑+ О2↑
- 15. Схема электролиза раствора сульфата меди CuSO4
- 16. Схема электролиза раствора сульфата меди CuSO4
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Электролиз – это окислительно – восстановительный процесс, протекающий на электродах
при прохождении электрического тока через расплав или раствор электролита.
Слайд 6Электролиз расплава
Хлорида натрия
NaCl → Na + + Cl –
K (-)Na ++ ẽ →Na 2 восстановление
A (+) 2Cl - -2ẽ → Cl 02↑ 1 окисление
2 Na+ + 2Cl- = 2Na0 + Cl0↑
Слайд 8Правила восстановления анионов на аноде:
a) если анод не растворимый
Cl-,
Br-, S-, I -…
Бескислородные (кроме F) анионы окисляются
Анион n- -
n ẽ → Анион 0Слайд 9Электролиз раствора хлорида натрия, если анод нерастворимый
NaCl = Na+ +
Cl-
Катод (-)
Анод (+) 2 Н2О+ 2ẽ = Н2↑ + 2 ОН- 2 Cl- - 2ẽ=Cl20
Суммарное ионное уравнение
2 Н2О+2 Cl- = Н2↑+ Cl2↑ + 2OH-
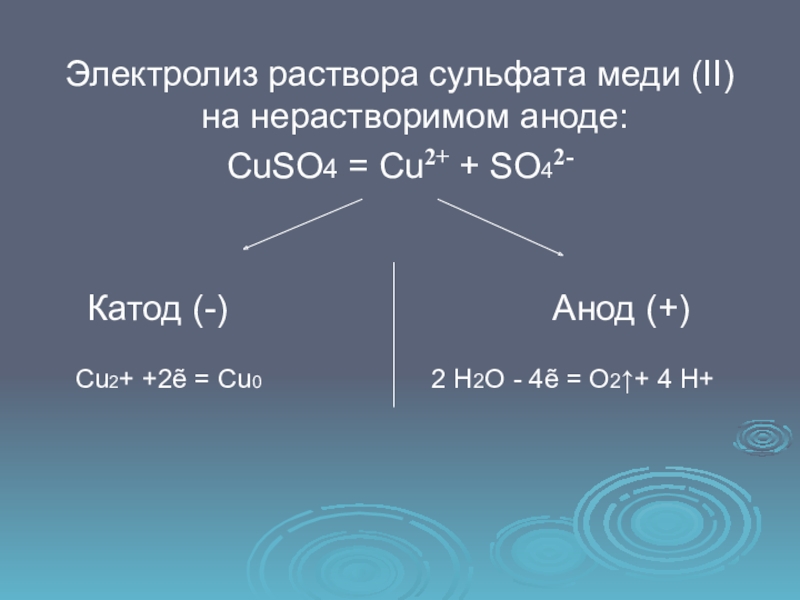
Слайд 10Электролиз раствора сульфата меди (II) на нерастворимом аноде:
CuSO4 = Cu2+
+ SO42-
Катод (-)
Анод (+)Cu2+ +2ẽ = Cu0 2 Н2О - 4ẽ = O2↑+ 4 H+
Слайд 11Cu2+ +2ẽ = Cu0
2
2 Н2О - 4ẽ = O2↑+
4 H+ 1Суммарное ионное уравнение:
2 Cu2+ +2 Н2О= 2 Cu0+ O2↑+4 Н+
Суммарное молекулярное уравнение:
2 CuSO4 + 2 Н2О Электролиз 2 Cu+ O2+ 2 H2SO4
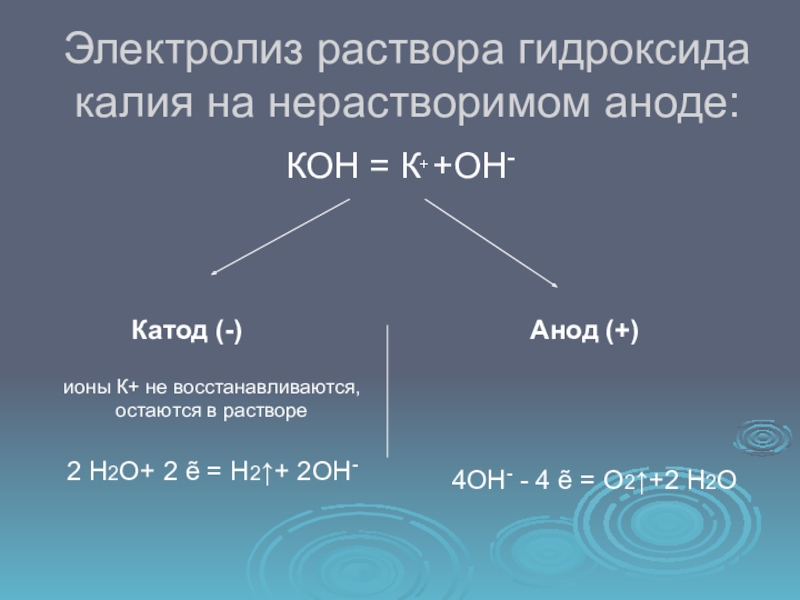
Слайд 12Электролиз раствора гидроксида калия на нерастворимом аноде:
КОН = К+ +ОН-
Катод (-)
Анод (+)ионы К+ не восстанавливаются,
остаются в растворе
2 Н2О+ 2 ẽ = Н2↑+ 2ОН-
4ОН- - 4 ẽ = О2↑+2 Н2О
Слайд 15Схема электролиза раствора сульфата меди CuSO4 , если анод
медный:
CuSO4 = Cu2+ + SO42-
АНОД: (+) Cu2+
-2ẽ = Cu0КАТОД (-): Cu2+ +2ẽ = Cu0
Суммарное уравнение электролиза с растворимым анодом написать нельзя.
б) Если анод РАСТВОРИМЫЙ, то окисляется металл анода, несмотря на природу аниона:
Mnn++ - n ẽ = M0
Анод Раствор
Слайд 16Схема электролиза раствора сульфата меди CuSO4 , если анод
медный:
CuSO4 = Cu2+ + SO42-
АНОД: (+) Cu2+
-2ẽ = Cu0КАТОД (-): Cu2+ +2ẽ = Cu0
Суммарное уравнение электролиза с растворимым анодом написать нельзя.
Схема электролиза раствора сульфата меди CuSO4 , если анод медный:
CuSO4 = Cu2+ + SO42-
АНОД: (+) Cu2+ -2ẽ = Cu0
КАТОД (-): Cu2+ +2ẽ = Cu0
Суммарное уравнение электролиза с растворимым анодом написать нельзя.