Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролиз расплавов и водных растворов солей
Содержание
- 1. Электролиз расплавов и водных растворов солей
- 2. Электролиз водных растворов и расплавов солейЭлектролиз –
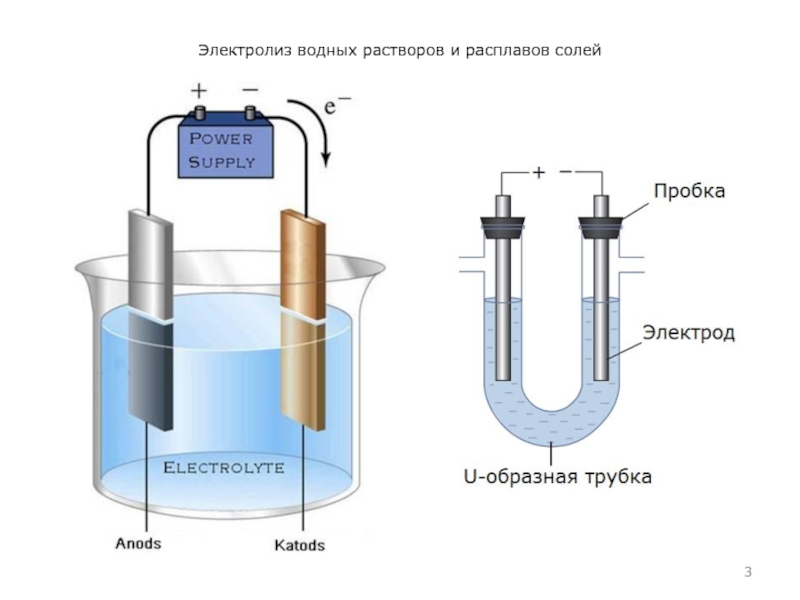
- 3. Электролиз водных растворов и расплавов солей
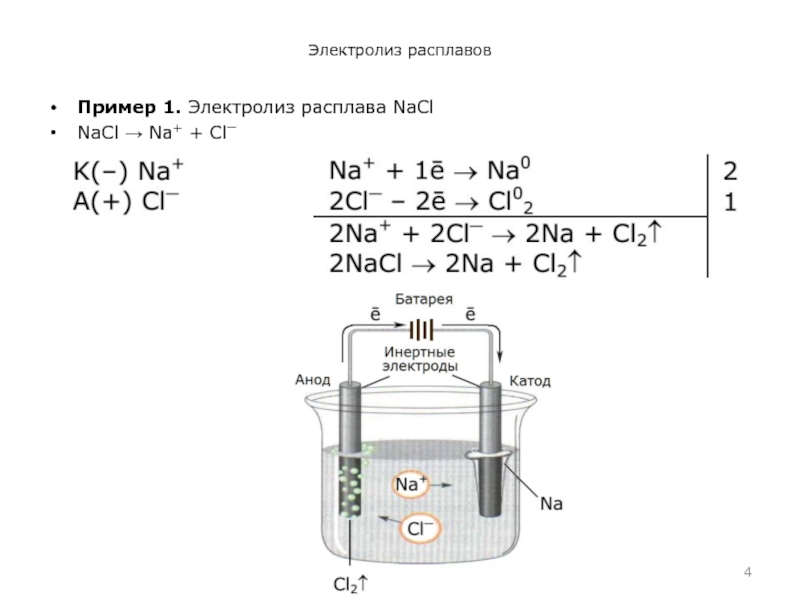
- 4. Электролиз расплавовПример 1. Электролиз расплава NaClNaCl Na+ + Cl⎺
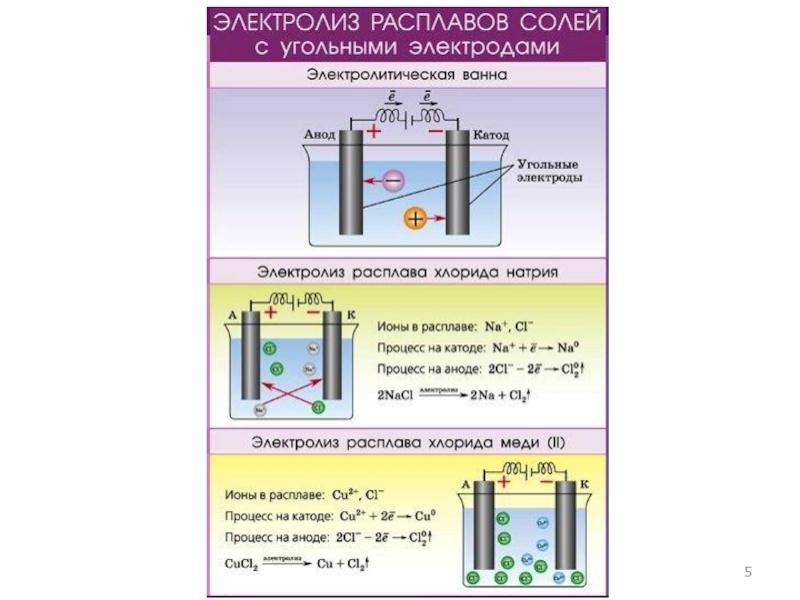
- 5. Слайд 5
- 6. Электролиз расплавовПример 2. Электролиз расплава NaOH NaOH Na+ + ОН⎺
- 7. Электролиз расплавовПример 3. Электролиз расплава Аl2O3 Аl2O3 Аl3+ + АlO33−
- 8. Электролиз водных растворовЭлектролиз растворовКатодные (восстановительные) процессы. На
- 9. Электролиз водных растворовАнодные (окислительные) процессы. При электролизе
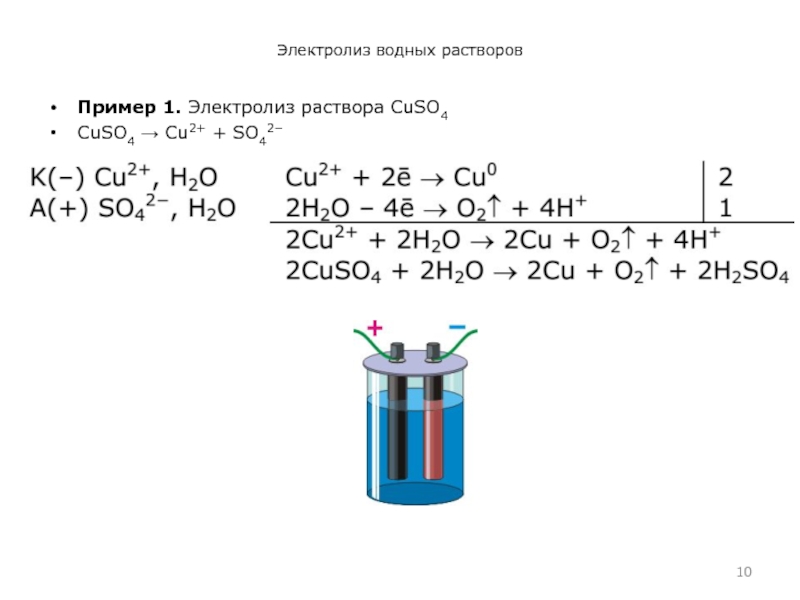
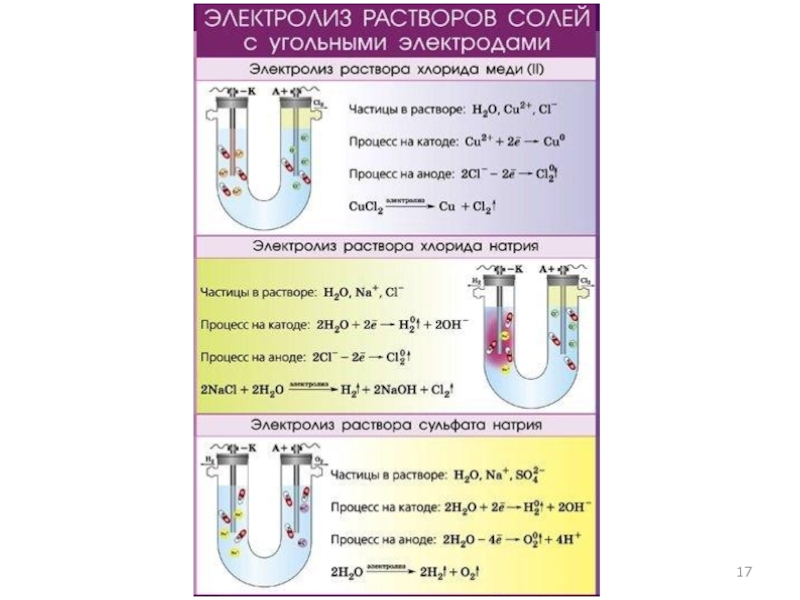
- 10. Электролиз водных растворовПример 1. Электролиз раствора CuSO4 CuSO4 Cu2+ + SO42−
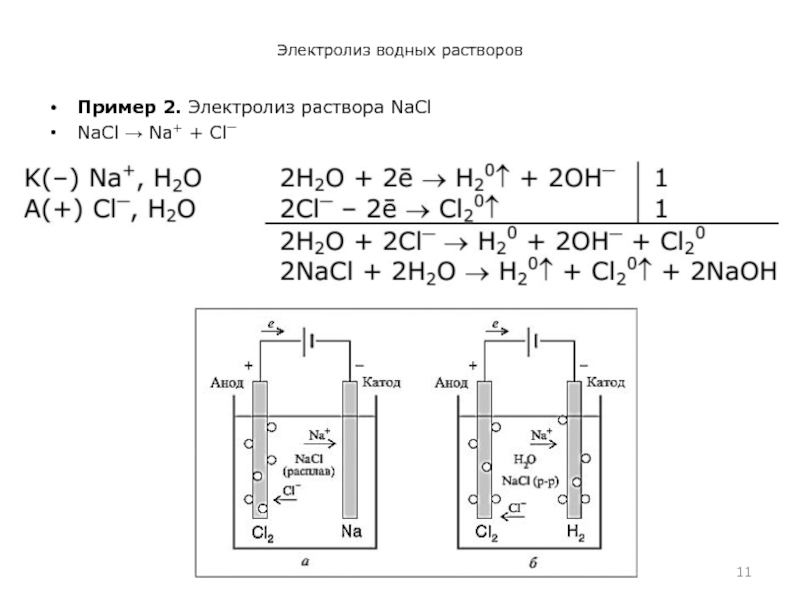
- 11. Электролиз водных растворовПример 2. Электролиз раствора NaСl NaСl Na+ + Сl⎺
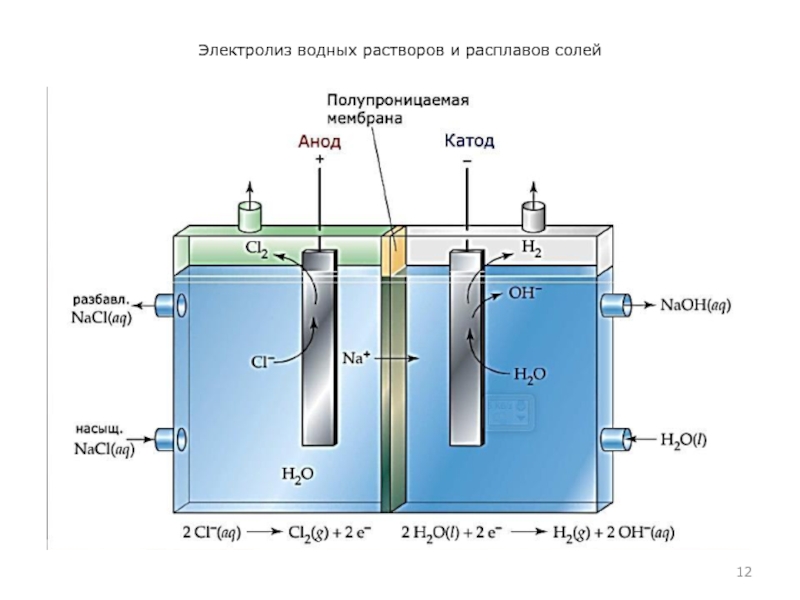
- 12. Электролиз водных растворов и расплавов солей
- 13. Электролиз водных растворов и расплавов солей
- 14. Электролиз водных растворов и расплавов солейПример 3. Электролиз раствора Na2SO4. Na2SO4 2Na+ + SO42−
- 15. Электролиз водных растворов и расплавов солейПример 4. Электролиз раствора Na2SNa2S 2Na+ + S2−
- 16. Электролиз водных растворов и расплавов солейПример 5. Электролиз раствора CH3COONaCH3COONa Na+ + CH3COO−
- 17. Слайд 17
- 18. Электролиз водных растворовРастворимый анод при электролизе сам
- 19. Слайд 19
- 20. Электролиз водных растворовИспользование электролиза Окислительная и восстановительная
- 21. Электролиз водных растворов и расплавов солей
- 22. Электролиз водных растворов и расплавов солей
- 23. Скачать презентанцию
Электролиз водных растворов и расплавов солейЭлектролиз – это окислительно-восстановительный процесс, происходящий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита.Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом
Слайды и текст этой презентации
Слайд 1Электролиз расплавов и водных растворов солей
Единственный путь, ведущий к знанию,
– это деятельность.
Б. ШоуСлайд 2Электролиз водных растворов и расплавов солей
Электролиз – это окислительно-восстановительный процесс,
происходящий на электродах при прохождении постоянного электрического тока через раствор
или расплав электролита.Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами – проводниками, соединенными с полюсами источника электрической энергии.
Анодом при электролизе называется положительный электрод, катодом – отрицательный.
Положительные ионы – катионы – (ионы металлов, ионы водорода, ионы аммония и др.) – движутся к катоду, отрицательные ионы – анионы – (ионы кислотных остатков и гидроксильные группы) – движутся к аноду.
Слайд 8Электролиз водных растворов
Электролиз растворов
Катодные (восстановительные) процессы. На катоде происходит восстановление
катионов металлов и водорода или молекул воды. Для растворов кислот: K(−)
Н+, Н2О 2Н+ + 2ē Н20. Для растворов солей или щелочей: K(−) Мn+, Н2О. Характер восстановительного процесса зависит от значения стандартного электродного потенциала металла:Слайд 9Электролиз водных растворов
Анодные (окислительные) процессы. При электролизе растворов используют растворимые
и нерастворимые аноды. Нерастворимые аноды изготавливают из углерода или платины,
а растворимые – из цинка, меди, никеля и других металлов. На нерастворимом аноде происходит окисление анионов или молекул воды.Слайд 14Электролиз водных растворов и расплавов солей
Пример 3. Электролиз раствора Na2SO4.
Na2SO4 2Na+ + SO42−
Слайд 15Электролиз водных растворов и расплавов солей
Пример 4. Электролиз раствора Na2S
Na2S
2Na+ + S2−
Слайд 16Электролиз водных растворов и расплавов солей
Пример 5. Электролиз раствора CH3COONa
CH3COONa
Na+ + CH3COO−
Слайд 18Электролиз водных растворов
Растворимый анод при электролизе сам подвергается окислению, т.е.
направляет электроны во внешний круг. При отдаче электронов смещается равновесие
между электродом и раствором и электрод растворяется:Пример 4. Электролиз раствора CuSO4 с использованием медного анода.
CuSO4 Cu2+ + SO42−
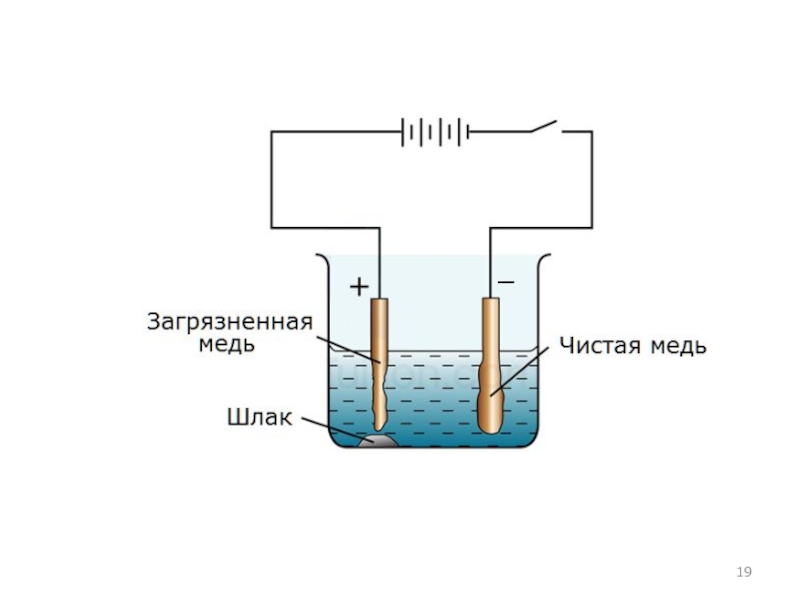
Слайд 20Электролиз водных растворов
Использование электролиза
Окислительная и восстановительная способность электрического тока намного
сильнее, чем у химических окислителей и восстановителей. Поэтому электролизом получают
наиболее активные металлы (калий, натрий, кальций, магний, алюминий), и менее активные (цинк, медь, кадмий и т.д.). Восстановленные на катоде металлы характеризуются очень высокой чистотой. Применяют электролиз и для очистки некоторых металлов от примесей (электролитическое рафинирование), например меди, никеля, свинца, золота.Электролизом получают активные неметаллы (хлор, фтор) и такие важные соединения, как натрий гидроксид, калий гидроксид, калий хлорат, пероксид водорода.
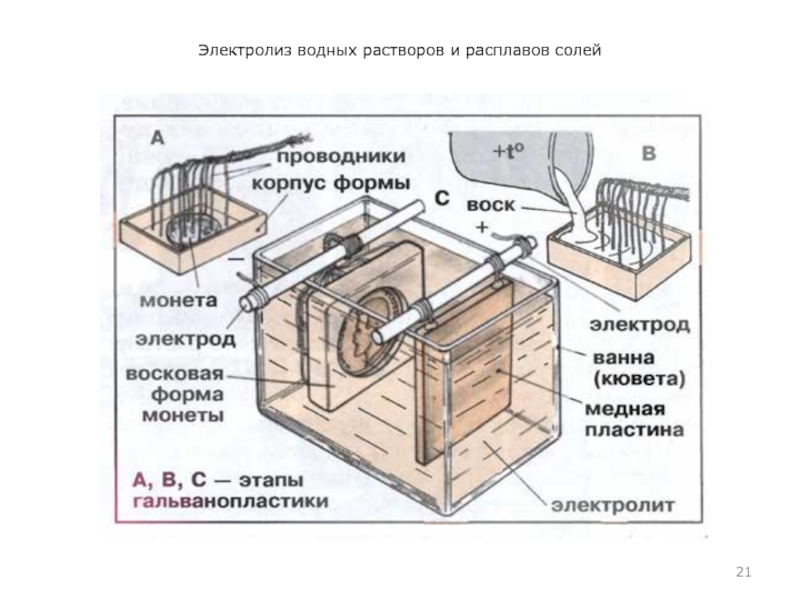
Электролиз применяют также для нанесения защитных металлических покрытий на поверхности (гальванопластика) и изготовление копий рельефных поверхностей (гальваностегия, электрохимическая обработка). Например, хромирование деталей машин, золочение ювелирных изделий.
Электролизом сточных промышленных вод обеспечивается их очистка от катионов металлов-загрязнителей, которые восстанавливаются на катоде.