Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электронное строение атома
Содержание
- 1. Электронное строение атома
- 2. Ранние модели строения атома«Пудинг с изюмом» (1902-1904
- 3. Современная модель атомаАтом – электронейтральная частицаЯдро атома
- 4. Состав ядра атомаПротоны. Масса = 1,
- 5. ИзотопыИзотопы – совокупность атомов, имеющих одинаковое число
- 6. Частицы микромираКорпускулярно-волновой дуализмЭлектрон – частица с массой
- 7. Важные понятияЭлектронное облако – пространство около ядра
- 8. Квантовые числаКвантовые числа описывают состояние электрона в
- 9. Квантовые числаl – побочное квантовое число; уточняет
- 10. Слайд 10
- 11. Квантовые числаm1 – магнитное орбитальное квантовое числосоответствует
- 12. Квантовые числаms – магнитное спиновое квантовое число
- 13. Принципы заполнения электронных оболочекПринцип минимальной энергии:принцип Паулиправило Хундаправило Клечковского
- 14. Несоблюдение принципа ПаулиПри несоблюдении принципа Паули на
- 15. Несоблюдение правила ХундаПри несоблюдении правила Хунда суммарный
- 16. Правило КлечковскогоЗаполнение электронами орбиталей в атоме происходит
- 17. Электронные семействаs-элементы, если заполняется
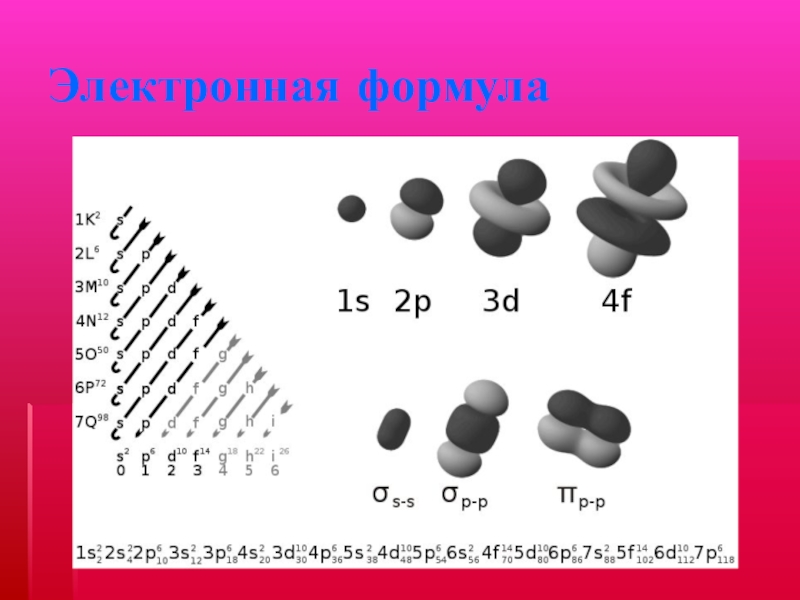
- 18. Электронная формулаЭлектронная формула атома химического элемента показывает
- 19. Электронная формула
- 20. «Провал» электронаВ атомах некоторых элементов электрон с
- 21. ЗаданиеОпределить элемент:Составить электронные и электронно-графические формулы элемента:
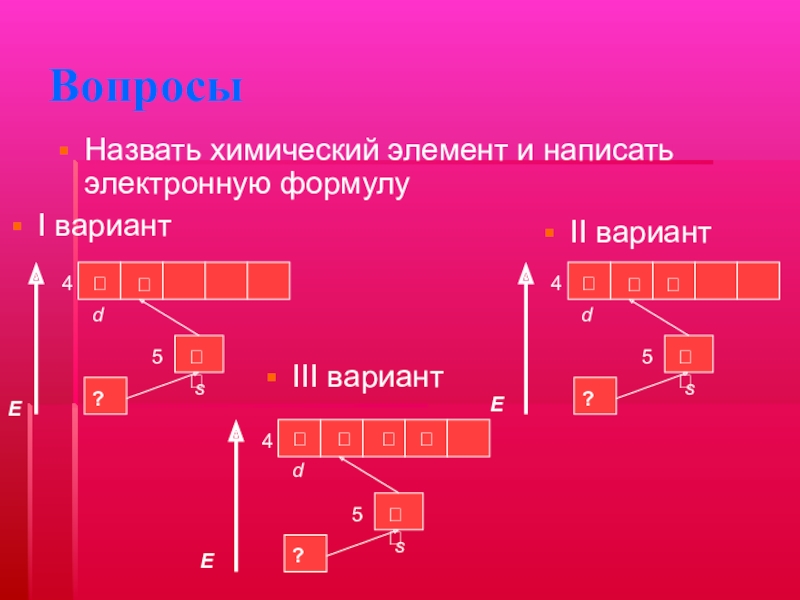
- 22. ВопросыI вариантНазвать химический элемент и написать электронную формулуIII вариант
- 23. Спасибо за внимание!
- 24. Скачать презентанцию
Ранние модели строения атома«Пудинг с изюмом» (1902-1904 г. Дж. Томсон)«Планетарная» (1907 г. Э. Резерфорд)«Модель Бора» (1913 г.)
Слайды и текст этой презентации
Слайд 2Ранние модели строения атома
«Пудинг с изюмом»
(1902-1904 г. Дж. Томсон)
«Планетарная» (1907
г. Э. Резерфорд)
Слайд 3Современная модель атома
Атом – электронейтральная частица
Ядро атома – положительно заряженное
Электроны
– отрицательно заряженные
Электроны вращаются вокруг ядра с определённой скоростью
Электроны имеют
двойственную
природуСлайд 4Состав ядра атома
Протоны.
Масса = 1, заряд = +1
Нейтроны.
Масса =
1, заряд = 0
Заряд ядра определяется количеством протонов
Количество протонов соответствует
порядковому номеру элемента в ПСХЭСлайд 5Изотопы
Изотопы – совокупность атомов, имеющих одинаковое число протонов, но различающихся
количеством нейтронов в ядре атома.
Изотопы различны атомной массой (А)
Число нейтронов
определяется по формуле: N = A – Z, где Z – порядковый номер элементаСлайд 6Частицы микромира
Корпускулярно-волновой дуализм
Электрон – частица с массой
m1= 9*10-28, скорость
108 см/сек,
заряд -1
Эксперименты в 1927 г. подтвердили явления дифракции и
интерференции.Слайд 7Важные понятия
Электронное облако – пространство около ядра атома, где сосредоточены
вся масса электрона и электронная плотность
Атомная орбиталь – часть э.о.,
где сосредоточено >90% электронной плотностиРадиус АО – расстояние от ядра атома до максимальной электронной плотности
Слайд 8Квантовые числа
Квантовые числа описывают состояние электрона в атоме
n – главное
квантовое число, хар-т общую энергию электрона данного уровня, номер периода
в ПСХЭ соотв-т к-ву энергетических уровней в атоме, n принимает целые значенияСлайд 9Квантовые числа
l – побочное квантовое число; уточняет запас энергии электрона
на энергетическом уровне, хар-т связь e с ядром, а так
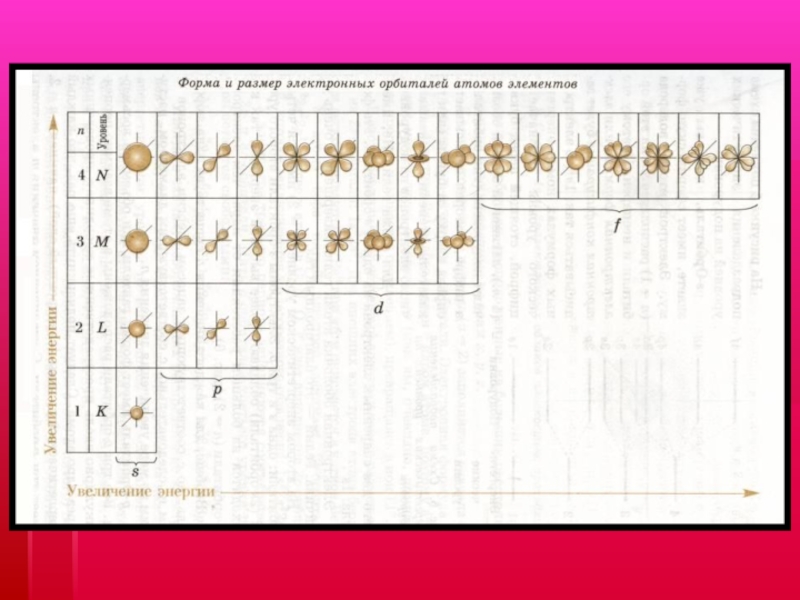
же форму АО. Значения от 0 до n-1l=0 – подуровень s, форма орбитали сферическая
l=1 – подуровень p, объёмная форма орбитали
l=2 – подуровень d, более сложная форма орбитали
l=3 – подуровень f, более сложная форма орбитали
Номер э.у. соответствует к-ву подуровней на данном энергетическом уровне