Ві зверху донизу підгрупи зростають радіуси атомів, тобто віддаленість валентних
електронів від ядра. При цьому зменшується енергія іонізації атомів, їх електронегативність, що свідчить про послаблення неметалічних властивостей елементів.неМе – N2
Ме - Bi
Від азоту до вісмуту зростає стійкість сполук із ступенем окиснення 3+ у порівнянні із сполуками 5+.
Збільшення радіусів атомів елементів від азоту до вісмуту призводить до зростання міжмолекулярної взаємодії речовин і переходу їх у конденсований стан:
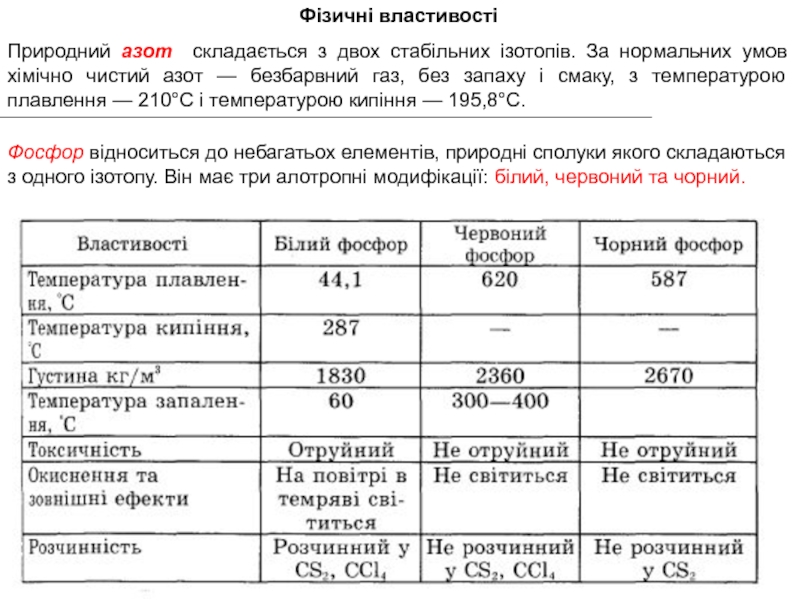
N2 - газ, а Р, Аs, Sb та Ві - тверді сполуки.