Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Элементы атомной физики
Содержание
- 1. Элементы атомной физики
- 2. Планетарная модель атома по РезерфордуРазмеры атома – порядка 10-10 мРазмеры ядра – порядка 10-14 м
- 3. Недостатки модели:Время жизни атома – порядка 10-7
- 4. В 1885г. Бальмер нашел, что длину волны
- 5. Волновое число:Тогда формула Бальмера принимает вид:R -
- 6. Слайд 6
- 7. Нильс Хенрик Давид Бор (1885 - 1962)
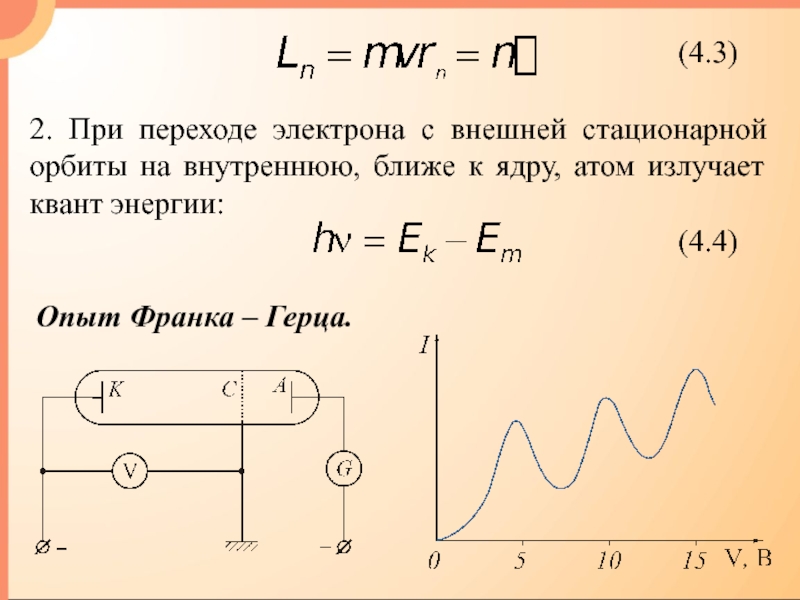
- 8. 2. При переходе электрона с внешней стационарной
- 9. Слайд 9
- 10. Чтобы электрон удержался на орбите, сила кулонов-ского взаимодействия должна сообщать ему центро-стремительное ускорение.(4.5)
- 11. Полная энергия электрона на орбите:Из первого постулата Бора:
- 12. Слайд 12
- 13. Слайд 13
- 14. Задача 4.1Определить по теории Бора радиус, частоту
- 15. Слайд 15
- 16. Задача 4.2 Атом водорода в основном состоянии
- 17. Слайд 17
- 18. 4.3. Квантовые числа.
- 19. n = 1, 2, 3, 4…
- 20. l = 0, 1, 2, 3, …
- 21. m – магнитное число, так как момент
- 22. Слайд 22
- 23. Кратность вырождения: В электрическом и магнитном полях вырождение снимается (эффекты Штарка и Зеемана).
- 24. - определяет вероятность состояния электрона.l – определяет
- 25. Полный момент импульса электрона:
- 26. 4.4. Принцип Паули. Распределение электронов в атоме.
- 27. Вольфганг Эрнст Паули 1900 - 1958n=1
- 28. Подоболочки:1s; 2s, 2p;
- 29. Слайд 29
- 30. 4.5. Периодическая система Д.И. Менделеева. В
- 31. Квантовые числа атома равны сумме
- 32. 2. При этом квантовое числоJ = |L
- 33. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Планетарная модель атома по Резерфорду
Размеры атома – порядка 10-10 м
Размеры
ядра – порядка 10-14 м
Слайд 3Недостатки модели:
Время жизни атома – порядка 10-7 с
Спектр излучения –
непрерывный
На
самом деле:- спектр излучения линейчатый
- время жизни – очень большое
Слайд 4В 1885г. Бальмер нашел, что длину волны λ, которая соответствует
линиям водорода, расположенным в видимой части спектра, можно вычислить по
эмпирической формуле:БАЛЬМЕР
Иоганн Якоб
(1825-98)
где вместо n следует подставлять
целые числа 3, 4, 5, 6,
а В - эмпирическая константа,
равная 3645,6⋅10-10 м = 3645,6 Å
Слайд 5Волновое число:
Тогда формула Бальмера принимает вид:
R - постоянная Ридберга
(R=1,097·107
м-1).
Johannes Robert Rydberg, 1854-1919 - шведский физик
Слайд 7Нильс Хенрик Давид Бор
(1885 - 1962)
Постулаты Бора
1. Существуют
стационарные состояния атома. Этим стационарным состояниям соответствуют вполне определенные (стационарные)
орбиты электронов. При движении по стационарным орбитам электроны не излучают электромагнитные волны.4.2. Модель атома водорода по Н. Бору.
Слайд 8
2. При переходе электрона с внешней стационарной орбиты на внутреннюю,
ближе к ядру, атом излучает квант энергии:
Опыт Франка –
Герца.Слайд 10
Чтобы электрон удержался на орбите, сила кулонов-ского взаимодействия
должна сообщать ему центро-стремительное ускорение.
(4.5)
Слайд 14
Задача 4.1
Определить по теории Бора радиус, частоту и скорость обращения
электрона для первой орбиты, а также энер-гию ионизации для атома
гелия.Слайд 16Задача 4.2
Атом водорода в основном состоянии поглотил квант света
с длиной волны 0,1215 мкм. Определить радиус электронной орбиты возбужденного
атома водорода.
Слайд 20l = 0, 1, 2, 3, … (n-1).
Согласно принципу неопределенности Гайзенберга одновременно могут иметь определенные значения лишь
модуль момента импульса и одна из проекций момента на координатные оси.
Слайд 21m – магнитное число, так как момент импульса и магнитный
момент однозначно связаны гиро-магнитным соотношением.
Магнитное квантовое
число m характеризует пространственную ориентацию орбит в магнитном поле. Под действием внешнего магнитного поля, направ-ленного по оси z, орбита электрона в атоме принимает такую ориентацию, при которой проекция вектора момента импульса на заданное направление z будет определяться формулой (4.13)m = -l, -l+1, -l+2, … -1, 0, 1, 2, … l-2, l-1, l
Слайд 23
Кратность вырождения:
В электрическом и магнитном полях вырождение снимается
(эффекты Штарка и Зеемана).
Слайд 24
- определяет вероятность состояния электрона.
l – определяет форму волновой функции
(«орбиты») электрона.
l = 0 – сферическая симметрия (s – состояние)
l
= 1 – p - состояниеl = 2 – d - состояние
l = 3 – f - состояние
m – определяет ориентацию орбиты в магнитном поле.
Слайд 26
4.4. Принцип Паули. Распределение электронов в атоме.
Правила отбора:
Переход из
d – состояния (l = 2) c s = ½
(j = 5/2) возможен в состояние p (l = 1) c s = ½ (j = 3/2) и невозможен в состояние p c s = - ½ (j = ½ )Пример
Любая система стремится занять состояние с минимальной энергией.
В атоме это состояние n = 1, l = 0, m = 0.
Слайд 27Вольфганг
Эрнст Паули
1900 - 1958
n=1 l=0 m=0
s=±½
- 2 электрона
n=2 l=0, 1 m=-1, 0,
+1 s=±½- 8 электронов
n=3 l=0, 1, 2 m=-2, -1, 0, 1, 2 s=±½
- 18 электронов
Слайд 304.5. Периодическая система Д.И. Менделеева.
В 1869 г.
Д.И. Менделеев открыл периодический закон изменения химических и физических свойств
элементов в зависимости от их атомных масс. Порядковый номер элемента Z совпадает с числом положительных элементарных зарядов в ядре и количеством электронов в атоме.
Периодичность свойств химических элементов свя-зана с определенной периодичностью в расположении электронов в атоме.
Слайд 31 Квантовые числа атома равны сумме соответству-ющих квантовых чисел
всех электронов атома.
Для полностью заполненной подоболочки
L = 0, S = 0, J = 0.Правило Хунда (для электронов одной оболочки):
1. Минимальная энергия соответствует состоянию с наибольшим возможным спином S и с наибольшим возможным при таком S значении L.