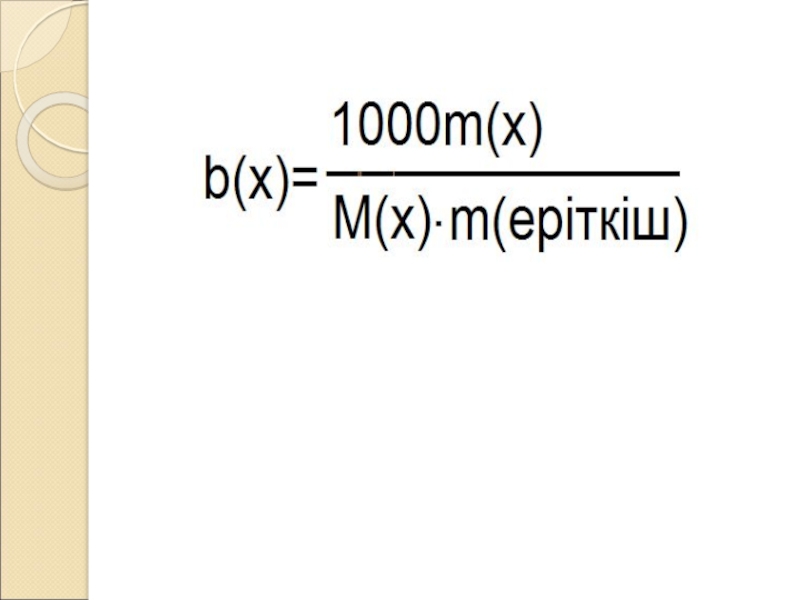Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ерітінділер. Ерітінділер концентрацияларын белгілеу тәсілі. Ерітінділердің
Содержание
- 1. Ерітінділер. Ерітінділер концентрацияларын белгілеу тәсілі. Ерітінділердің
- 2. Ерітіндінің концентрациясын белгілеу тәсілдері:Массалық үлес:ωm = m
- 3. Молярлық концентрация:
- 4. Молярлық эквиваленттік концентрациясы:
- 5. Моляльдік концентрация:
- 6. Титр: Т (x) = m (x) /
- 7. Ерітінділердің коллигативтік қасиеттері-еріген заттардың табиғатына тәуелсіз, тек
- 8. Раульдің бірінші заңы (1886ж)-ерітіндінің бетіндегі еріткіштің қаныққан
- 9. Раульдің екінші
- 10. Слайд 10
- 11. Осмос-еріткіш молекулаларының өздігіне жартылай сұйытылған ерітіндіден концентрлі
- 12. Осмостық қысым(π)-еріткіштіжартылай өткізгіш арқылы өтугемәжбүр ететін күш.Қан плазмасының осмостық қысымы 0,75МПа(7,63атм).
- 13. Вант-Гофф заңы -осмостық қысым (π)еріген заттың молярлық
- 14. Еріген заттың молярлық массасын анықтау әдістері.Криометрия- еріген
- 15. Эбулиометрия - еріген заттың молярлық массасын ерітіндінің қайнау температурасының жоғарылауы арқылы анықтау.Есептеу формуласы:Mзат=Е∙mзат∙1000/mеріткіш∙ΔTқайнау
- 16. Осмометрия – еріген заттың молярлық массасын ерітіндінің осмостық қысымын өлшеу арқылы анықтау.
- 17. Изотонды ерітінділер –осмостық қысымдары бірдей ерітінділер.
- 18. Гипертонды ерітінділер – қан плазмасымен салыстырғанда қысымы жоғары ерітінділер.Гипотонды ерітінділер –қан плазмасымен салыстырғанда қысымы төмен ерітінділер.
- 19. Плазмолиз- жасушаны гипертонды ерітіндіге батырғанда судың жасушаның
- 20. Гемолиз-жасушаны гипотонды ерітіндіге батырғанда судың ерітіндіден жасушаның
- 21. Изотондық коэффициент(i)ерітіндідегі бөлшектердің жалпысандарының , еріген
- 22. Бейэлектролиттер үшін i=1, ал электролиттер үшін i>1Электролиттер
- 23. Скачать презентанцию
Ерітіндінің концентрациясын белгілеу тәсілдері:Массалық үлес:ωm = m (x)/m (ерт) ·100%Көлемдік үлес:ωv = V (x)/V (ерт) · 100%Мольдік үлес:ωn = n (x)/n (ерт) · 100%
Слайды и текст этой презентации
Слайд 1Ерітінділер. Ерітінділер концентрацияларын белгілеу тәсілі. Ерітінділердің коллигативтік қасиеттері.
Ерітінді –еріткіш пен
еріген заттан құралған гомогенді жүйе.
сұйық, қатты, газ.Слайд 2Ерітіндінің концентрациясын белгілеу тәсілдері:
Массалық үлес:
ωm = m (x)/m (ерт) ·100%
Көлемдік
үлес:
ωv = V (x)/V (ерт) · 100%
Мольдік үлес:
ωn = n
(x)/n (ерт) · 100%Слайд 3Молярлық концентрация:
Cm (x) = n(x) / V (моль /л);
мұндағы
n – заттың моль мөлшері:n(x) = m (x) / M (x) ;
Сонда -
Cm (x) = m (x) / M (x) · V
Слайд 4Молярлық эквиваленттік концентрациясы:
Cэ (x) = m(x) /
V (моль/л),n (x) = m (x) / Mэ (x)
Mэ (x) = f (x) · M (x) (г/моль)
f – фактор – қышқылдық – негіздік реакцияда бір
сутек ионына тән немесе тотығу – тотықсыздану
реакциясында бір электронға тән заттың шамасын көрсететін сан.
f (қышқыл) = 1 / Z ( H + )
f (негіз) = 1 / Z ( OH )
f (тұз) = 1 / B · Z ( Me )
−
n+
Слайд 5 Моляльдік концентрация:
В(х) = n(х)/
mо (моль/кГ)
n(x) = m (x) / M (x) ;
Сонда:В(х) =m(х)/М(х)*mо
Слайд 7Ерітінділердің коллигативтік қасиеттері-еріген заттардың табиғатына тәуелсіз, тек еріген заттардың бөлшек
сандарына тәуелді қасиеттер. Бұларға осмостық қысым, қаныққан бу қысымының салыстырмалы
төмендеуі, қату температураларының төмендеуі мен қайнау температураларының жоғарылауы жатады.Слайд 8Раульдің бірінші заңы (1886ж)-ерітіндінің бетіндегі еріткіштің қаныққан бу қысымының салыстырмалы
төмендеуі еріген заттың мольдік үлесіне тең
немесе мұндағы: P0 –таза еріткіштің бетіндегі қаныққан бу қысымы; P-ерітіндінің бетіндегі қаныққан бу қысымы; n мен n0 –еріген зат пен еріткіштің мөлшерлері; n/n+n0=X – еріген заттың мольдік үлесі; ΔP- ерітіндінің қаныққан бу қысымының төмендеуі.Слайд 9 Раульдің екінші заңы :ерітіндінің қайнау температурасының жоғарылауы мен қату температурасының
төмендеуі еріген заттың моляльдық концентрациясына тура пропорционал болады:
ΔTқайнау =E*b(x) ; ΔT қату =K*b(x); мұндағы: ΔTқайнау =T1-T0 - ерітіндінің қайнау температурасының жоғарылауы ; ΔT қату =T1-T0 - ерітіндінің қату температурасының төмендеуі. T0 - еріткіштің қату және қайнау температуралары; T1 – ерітіндінің қайнау және қату температуралары; Е –еріткіштің эбускопиялық тұрақтысы ; К – еріткіштің криоскопиялық тұрақтысы; Е мен К еріткіштің табиғатына тәуелді ; b(x) –еріген заттың моляльдік концентрациясы ( 1000г еріткіште еріген заттың мөлшері)Слайд 11Осмос-еріткіш молекулаларының өздігіне жартылай сұйытылған ерітіндіден концентрлі ерітіндіге қарай өтуі.
Жартылай
өткізгіштерге ішек,тері, қан тамырлары,жасуша,ұлпа қабықтары жатады.
Слайд 12Осмостық қысым(π)-еріткішті
жартылай өткізгіш арқылы өтуге
мәжбүр ететін күш.
Қан плазмасының осмостық
қысымы
0,75МПа(7,63атм).
Слайд 13Вант-Гофф заңы -осмостық қысым (π)
еріген заттың молярлық концентрациясы
мен температураға тура
пропорционал:
π=CRTМұндағы, С-молярлық концентрация ,
R- газ тұрақтысы( 8,31 Дж/мольК).
Қан плазмасының осмостық концентрациясы 0,3моль/литр немесе 300 ммоль/л
Слайд 14Еріген заттың молярлық массасын анықтау әдістері.
Криометрия- еріген заттың молярлық массасын
ерітіндінің қату температурасының төмендеуі арқылы анықтау.
Есептеу формуласы:
Mзат=K∙mзат∙1000/mеріткіш ∙ Δ
TқатуСлайд 15Эбулиометрия - еріген заттың молярлық массасын ерітіндінің қайнау температурасының жоғарылауы
арқылы анықтау.
Есептеу формуласы:
Mзат=Е∙mзат∙1000/mеріткіш∙ΔTқайнау
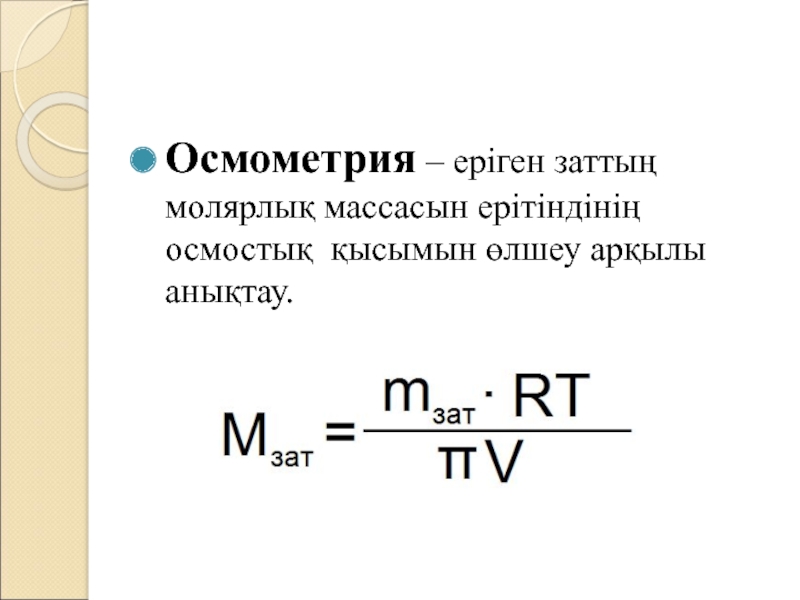
Слайд 16Осмометрия – еріген заттың молярлық массасын ерітіндінің осмостық қысымын өлшеу
арқылы анықтау.
Слайд 17 Изотонды ерітінділер –осмостық қысымдары бірдей ерітінділер.
0,9%-дық натрий
хлориді ертіндісі қан плазмасымен изотонды , оны физиологиялық ерітінді деп
атайды.Слайд 18Гипертонды ерітінділер – қан плазмасымен салыстырғанда қысымы жоғары ерітінділер.
Гипотонды ерітінділер
–қан плазмасымен салыстырғанда қысымы төмен ерітінділер.
Слайд 19Плазмолиз- жасушаны гипертонды ерітіндіге батырғанда судың жасушаның ішінен ерітіндіге қарай
өтуінен жасушаның жиырылу құбылысы.
Деплазмолиз-жиырылған жасушаны қайтадан суға салғанда оның бастапқы
күйіне келу құбылысы.Слайд 20Гемолиз-жасушаны гипотонды ерітіндіге батырғанда судың ерітіндіден жасушаның ішіне қарай еніп,
жасушаның ісіну құбылысы.Бұл кезде жасуша жарылып кетеді.
Тургор-жасушаның пішінін, серпімділігін, тұрақтылығын
сақтауға көмектесетін қысым.Слайд 21Изотондық коэффициент(i)
ерітіндідегі бөлшектердің жалпы
сандарының , еріген заттың
молекулалар сандарынан қанша
есе
үлкендігін көрсетеді.
і = 1+ α(n – 1);
ал
α = (і – 1)/ (n – 1)Мұндағы:
α-еріген заттың диссоциациялану дәрежесі ,
n-иондар саны.
Слайд 22
Бейэлектролиттер үшін i=1,
ал электролиттер үшін i>1
Электролиттер үшін:
Рауль заңы: ΔTқату
= i∙K∙b(x);
ΔTқайнау= i∙E∙b(x);Вант-Гофф заңы:
π= iCRT.