Слайд 1
ЕТЕРИ
Етери - це органічнi сполуки, в яких два вуглеводневих залишки
зв’язанi між собою через атом Оксигену або ще їх можна
розглядати як похідні вуглеводнів, у яких атом Гідрогену заміщено алкоксигрупою. Їх загальна формула R-O-R′.
ІЗОМЕРІЯ ТА НОМЕНКЛАТУРА
Ізомерія етерів залежить від будови вуглеводневих залишків, зв’язаних з Оксигеном.
За систематичною номенклатурою їх називають за назвою алкану, з яким зв’язана алкоксигрупа (R-O-). Причому, в основi назви лежить алкан з найбільшою довжиною вуглецевого ланцюга. За радикало-функціональною номенклатурою назва утворюється з двох вуглеводневих залишків з додаванням слова етер.
Слайд 3Методи одержання
Міжмолекулярна дегідратація спиртів у присутностi мінеральних кислот
Вторинні, а
тим більше третинні спирти не дають етерів. У присутності кислоти
вони дегідратують з утворенням алкенів. Тому етери третинних спиртів одержують іншим шляхом.
Дана реакція є алкілуванням одного спирту іншим. Вона відбувається за умови, що кислота взята не у надлишку, а температура реакції не дуже висока (120-160о), інакше спирт відщепить воду і перетвориться у алкен. Алкілуючий агент (протонований спирт або карбокатіон) утворюється зi спирту при його взаємодії з кислотою:
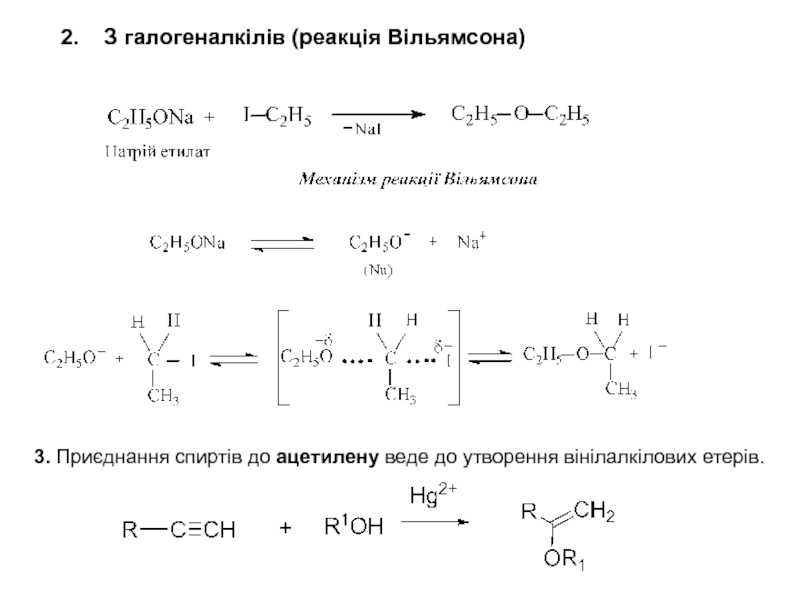
Слайд 4 2. З галогеналкілів (реакція Вільямсона)
3. Приєднання спиртів до
ацетилену веде до утворення вінілалкілових етерів.
Слайд 5ФІЗИЧНІ ВЛАСТИВОСТІ
У етерів відсутнi водневi зв’язки, тому вони не розчиняються
у водi i мають відносно низькi температури кипіння
С2Н5-ОН, tокип.= 78оС;
С2Н5-О-С2Н5, tо кип. = 34,6оC.
ХІМІЧНІ ВЛАСТИВОСТІ
Етери проявляють сильнішi електронодонорнi властивостi порівняно зi спиртами, за рахунок неподілених пар електронів атома кисню. Таке збільшення електроно-донорних властивостей пояснюється електронодонорним характером алкільних груп, що проявляють +І-ефект. Тому етери є основами Льюїса і розчиняються у сильних кислотах.
Однак уцілому етери є доволі інертними сполуками: не гідролізуються, не взаємодіють з лугами, розведеними кислотами.
Слайд 61. Утворення оксонієвих сполук (оксонієвих солей)
У присутностi сильних кислот утворюються
протонованi етери (оксонієвi солi або оксонієвi катіони).
Реакції ацидолізу i
розщеплення етерів
2.1. Ацидоліз кислотами. Ацидоліз – це розщеплення сполуки під дією кислоти.
Концентрованi кислоти розщеплюють етери за схемою:
Слайд 72.2. Реакція розщеплення протікає також під дією металічного натрію (П.І.Шоригін)
3.
Окиснення етерів
Більшість етерів легко окиснюється киснем повітря, утворюючи пероксиднi сполуки.
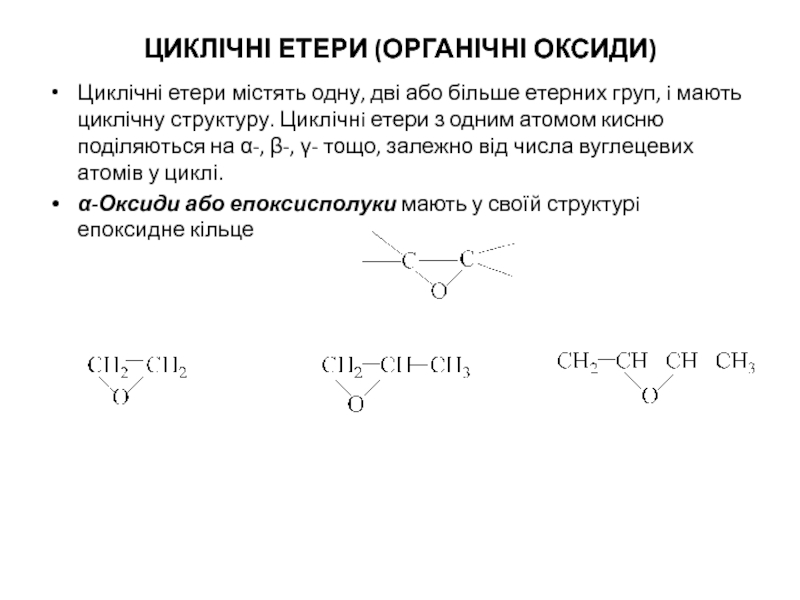
Слайд 8ЦИКЛІЧНІ Етери (ОРГАНІЧНІ ОКСИДИ)
Циклічні етери містять одну, дві або більше
етерних груп, i мають циклічну структуру. Циклічнi етери з одним
атомом кисню поділяються на -, -, - тощо, залежно від числа вуглецевих атомів у циклі.
-Оксиди або епоксисполуки мають у своїй структурi епоксидне кільце
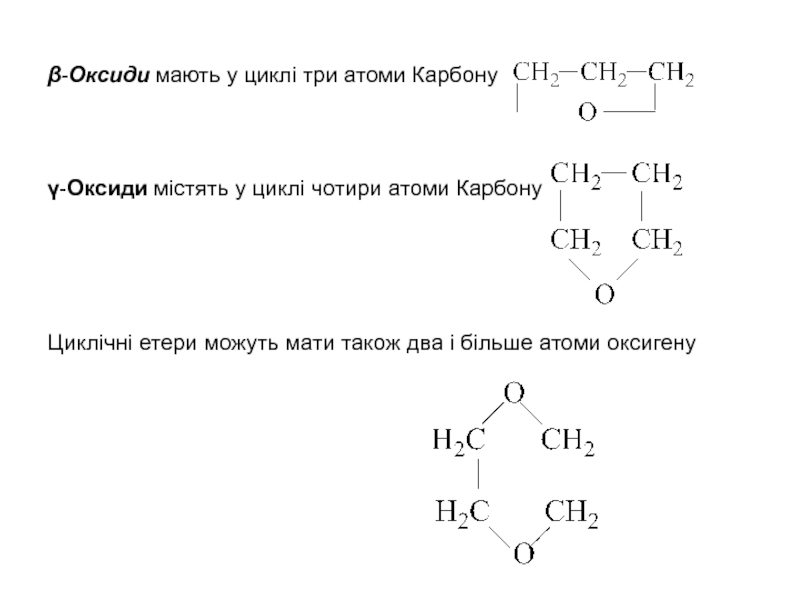
Слайд 9-Оксиди мають у циклi три атоми Карбону
-Оксиди містять у циклi
чотири атоми Карбону
Циклічнi етери можуть мати також два і більше
атоми оксигену
Слайд 10В особливу групу виділенi циклічнi етери з кількома атомами оксигену,
які називаються краун-етерами
[18]-Краун-6
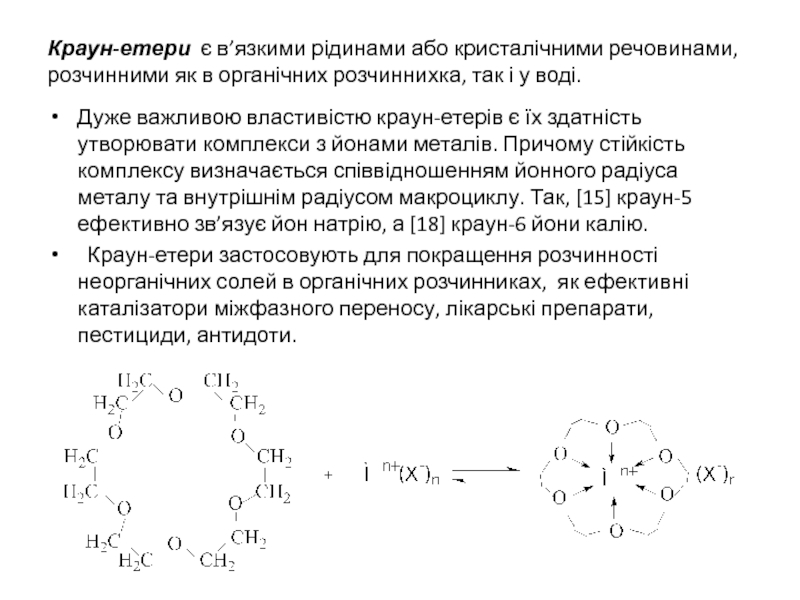
Слайд 11Краун-етери є в’язкими рідинами або кристалічними речовинами, розчинними як в
органічних розчиннихка, так і у воді.
Дуже важливою властивістю краун-етерів є
їх здатність утворювати комплекси з йонами металів. Причому стійкість комплексу визначається співвідношенням йонного радіуса металу та внутрішнім радіусом макроциклу. Так, [15] краун-5 ефективно зв’язує йон натрію, а [18] краун-6 йони калію.
Краун-етери застосовують для покращення розчинності неорганічних солей в органічних розчинниках, як ефективні каталізатори міжфазного переносу, лікарські препарати, пестициди, антидоти.
Слайд 12ОДЕРЖАННЯ ОКСИРАНІВ (ЕПОКСИДНИХ СПОЛУК)
1. Епоксисполуки одержують з етену або пропену
двома шляхами.
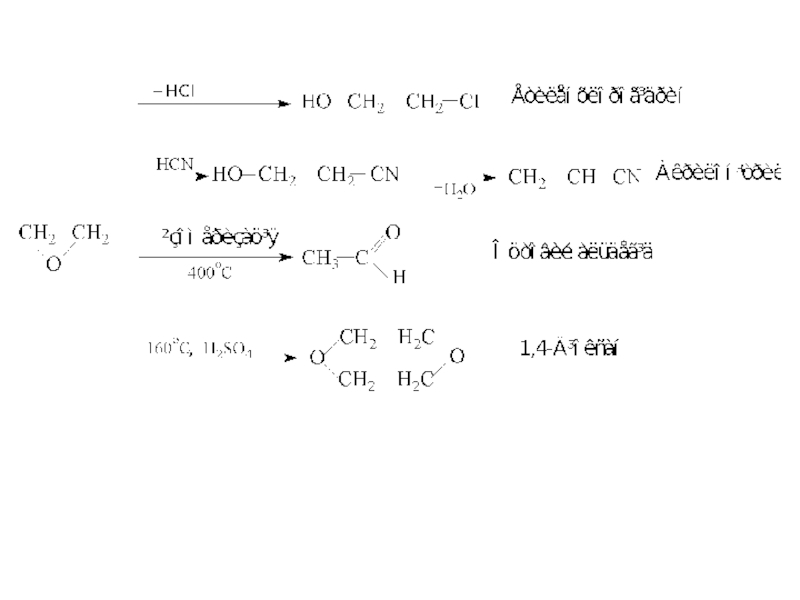
З алкіленхлорогідринів - реакцією дегідрохлорування (див.стор.) Причому утворення епоксидів
можливе лише при транс-положеннi СІ та ОН
1.2. Окиснення алкенів
Окиснення етилену ведуть в присутностi срібного каталізатора
Слайд 13ХІМІЧНІ ВЛАСТИВОСТІ ЕПОКСИДНИХ СПОЛУК
Епоксидне кільце має вигляд правильного трикутника зі
значно деформованими валентними кутами.
Таке угруповання відносно нестійке i полярне.
Зв’язок С—О в епоксидному кільцi розривається легко i для епоксидів характернi реакції приєднання з розщепленням кільця.
Вони відбуваються за механізмами SN1 або SN2.
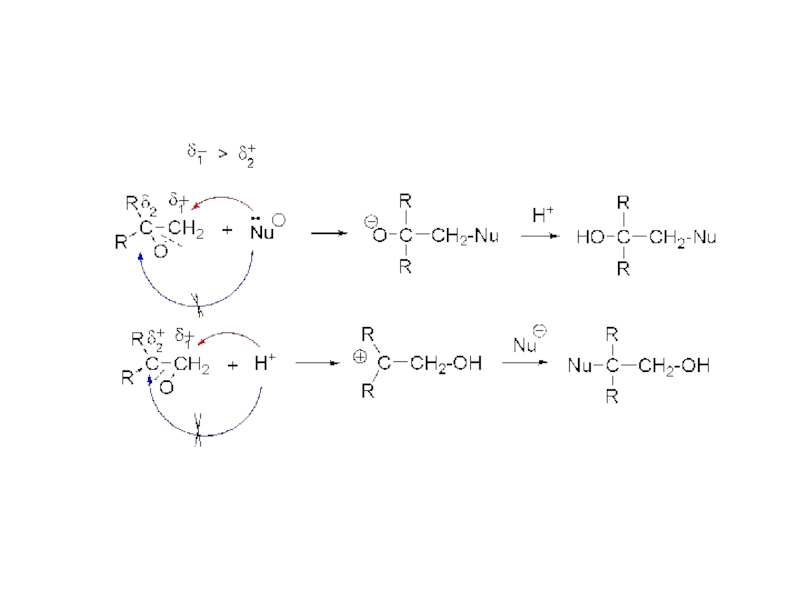
Слайд 14Якщо епоксид реагує з речовиною Н-Х, то протонізований атом Гідрогену
приєднується до Оксигену, а нуклеофільна частина молекули (Х) - до
Карбону епоксидного кільця ( заміщує атом оксигену біля атома карбону) за схемою:
Слайд 18ОРГАНІЧНІ ПЕРОКСИДИ
Органічними пероксидами називають сполуки, якi містять в молекулі пероксидну
групу —ОО—. Їх розглядають як похіднi найпростішого пероксиду Н—ОО—Н, пероксиду
водню, у якого один або два атоми водню заміщенi на вуглеводневi або іншi залишки.
Класифікація пероксидів
Гідропероксиди - загальна формула R—OO—H, де R –вуглеводневий радикал.
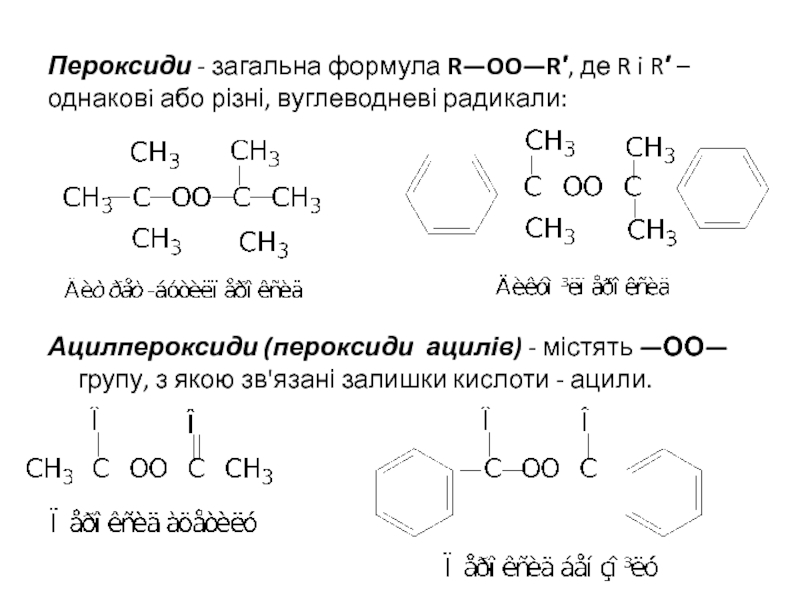
Слайд 19Пероксиди - загальна формула R—OO—R′, де R i R′ –
однаковi або різні, вуглеводневі радикали:
Ацилпероксиди (пероксиди ацилів) - містять —ОО—групу,
з якою зв'язані залишки кислоти - ацили.
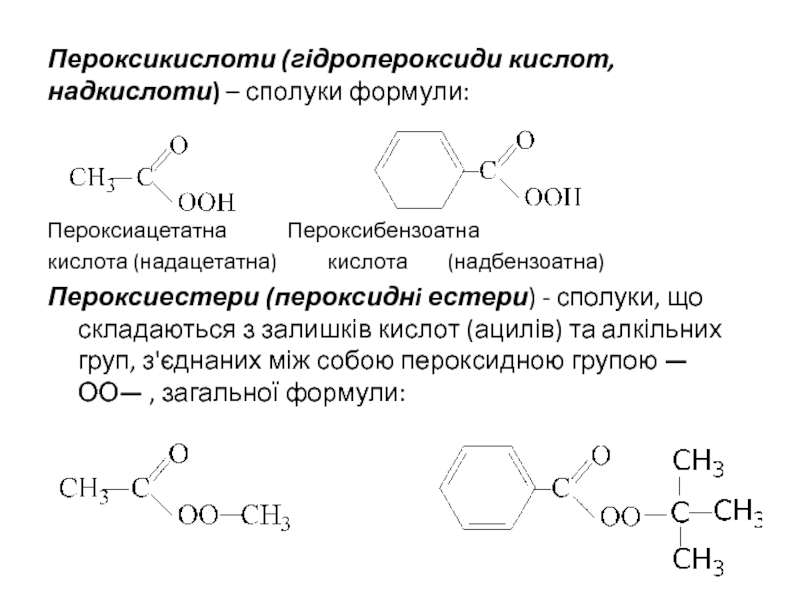
Слайд 20Пероксикислоти (гідропероксиди кислот, надкислоти) – сполуки формули:
Пероксиацетатна Пероксибензоатна
кислота (надацетатна) кислота (надбензоатна)
Пероксиестери
(пероксиднi естери) - сполуки, що складаються з залишків кислот (ацилів)
та алкільних груп, з'єднаних між собою пероксидною групою —ОО— , загальної формули:
Слайд 21Загальною властивістю органічних пероксидів є гомолітичний розпад на вільнi радикали
при нагріванні
Тому їх застосовують для ініціювання реакцій полімеризації, вулканізації каучуків,
затвердіння ненасичених смол тощо. Сьогодні вони все більше використовуються для модифікації різноманітних полімерів з метою надання їм специфічних властивостей, створення полімерних композитів та полімерів спеціального призначення. Органічнi пероксиди, особливо гідропероксиди, є проміжними продуктами при окисненнi вуглеводнів різних класів. Як правило, пероксиди нестійкі i у більшостi випадків небезпечнi у вжитку (вибухають від удару або нагрівання). Вони є сильними окиснювачами.






![ЕТЕРИ В особливу групу виділенi циклічнi етери з кількома атомами оксигену, які називаються краун-етерами [18]-Краун-6 В особливу групу виділенi циклічнi етери з кількома атомами оксигену, які називаються краун-етерами [18]-Краун-6](/img/thumbs/b2d7d5c28829d2b84df080221fb78599-800x.jpg)