Слайд 1Факторы формирования химического состава природных вод
С.М.Судариков
Гидрогеохимия
Слайд 2Факторы формирования химического состава –природная обстановка, которая способствует формированию хим.
состава воды.
Они поддерживают или угнетают водную миграцию элементов и
процессы, являющихся механизмами, формирующими состав воды.
Могут быть выделены физико-географические, геологические, физико-химические, физические, биологические, искусственные факторы.
Слайд 3Физико-географические факторы
Главным элементом физико-географических условий, влияющим на формирование химического состава
природных вод, является климат.
Солончаки и связанные с ними соленые
воды и рассолы известны только в засушливых областях, воды с очень низкой минерализацией встречаются либо в горах, либо там, где тают ледники и снег, либо в прохладных областях с сильно переувлажненным климатом.
Слайд 4Климат
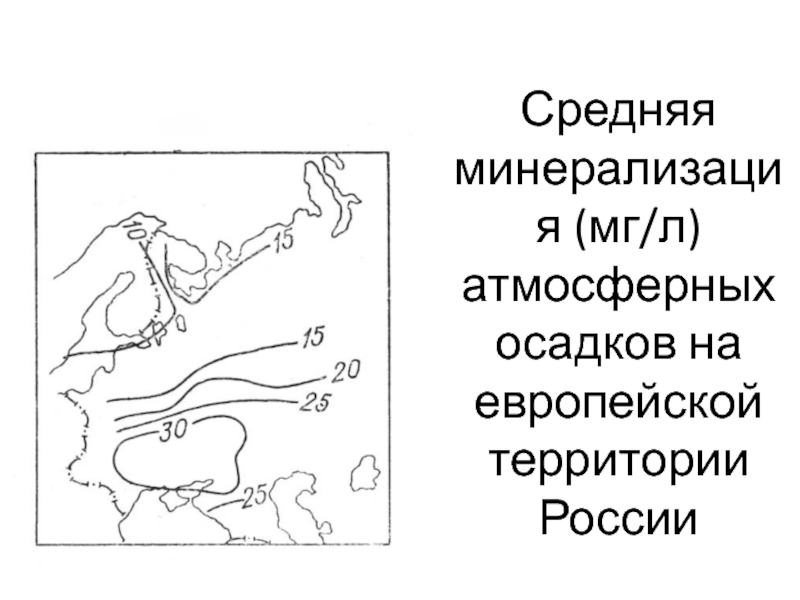
Атмосферные осадки, выпадающие на поверхность Земли, регулируют запасы поверхностных и
грунтовых вод.
При значительном превышении количества выпадающих атмосферных осадков над
испарением (область избыточного увлажнения) химический состав поверхностных и грунтовых вод определяется, прежде всего, составом атмосферных осадков и процессами растворения горных пород.
Слайд 5Средняя минерализация (мг/л) атмосферных осадков на европейской территории России
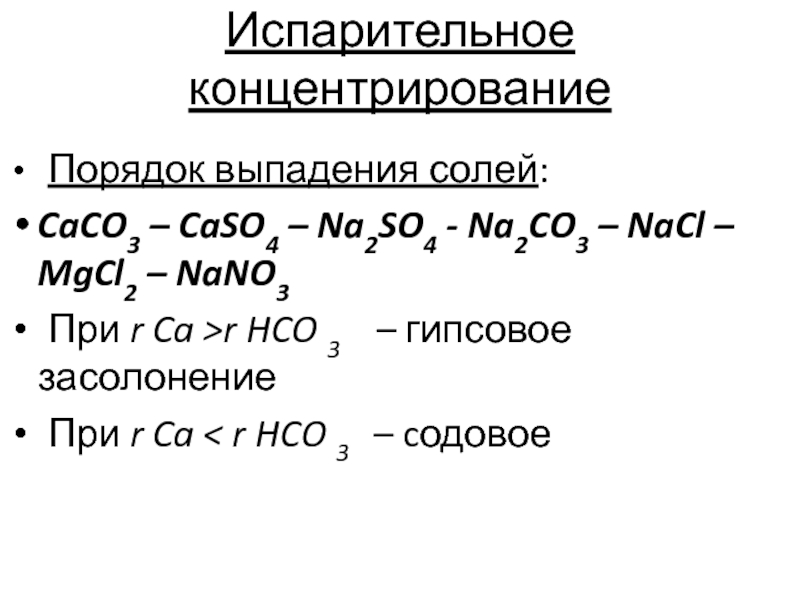
Слайд 6Испарительное концентрирование
Порядок выпадения солей:
CaCO3 – CaSO4 – Na2SO4 -
Na2CO3 – NaCl – MgCl2 – NaNO3
При r Ca >r
HCO 3 – гипсовое засолонение
При r Ca < r HCO 3 – cодовое
Слайд 7Вымораживание природных вод
Анализ результатов термодинамического моделирования процессов вымораживания
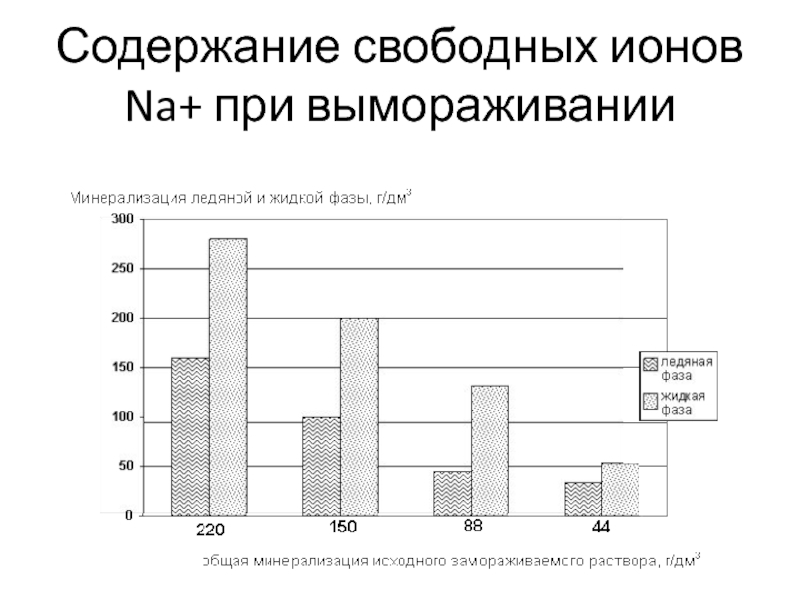
До минерализации
100 г/дм3 количество свободных ионов натрия не изменяется. При минерализации
выше 100 г/дм3 содержание свободных ионов натрия в обеих фазах уменьшается, но в жидкой фазе интенсивнее
Слайд 8Содержание свободных ионов Na+ при вымораживании
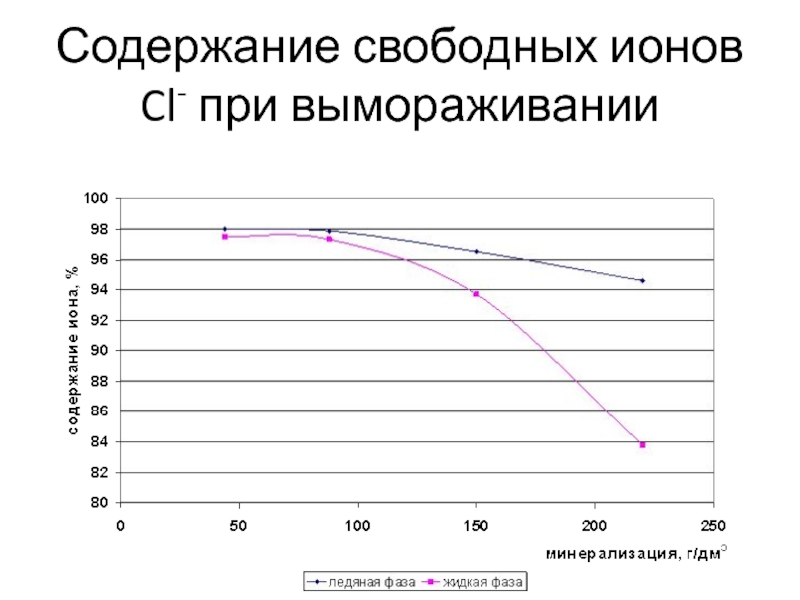
Слайд 9Количество свободных ионов кальция и хлора до минерализации 100 г/дм3
практически не меняется и равно 97%. При минерализациях свыше 100
г/дм3 этих ионов в свободном состоянии в жидкой фазе становится меньше, чем в ледяной, из-за комплексообразования
Слайд 10Содержание свободных ионов Cl- при вымораживании
Слайд 11ЭВТЕКТИКА (от греч. eutektos - легко плавящийся), жидкая фаза (расплав),
находящаяся в равновесии с двумя или более твердыми фазами.
Температура
кристаллизации эвтектики называется эвтектической точкой.
Продукт кристаллизации жидкой эвтектики - твердая эвтектика, высокодисперсная смесь нескольких твердых фаз того же состава, что и у жидкой эвтектики.
Слайд 12Эвтектика сульфата магния – минус 4.8оС, эвтектическая концентрация – 230
г/л.
Наличие в многолетнемерзлых породах сульфатных магниевых рассолов с минерализацией
218г/л указывает на температуру горных пород – минус 4.5оС.
При температуре многолетнемерзлых пород ниже эвтектики сульфата магния – минус 4.8оС – следует ожидать засоление льда кристаллогидратами MgSO4.
Слайд 13изменение анионного состава подземных вод при промерзании
Последовательность изменения анионного состава
подземных вод при промерзании в большинстве случаев можно выразить схемами
НСО3 ? SO4 ? Cl--, в зависимости от исходного химического состава подземных вод.
Слайд 14По мере понижения температуры подземных вод, раствор вымораживания обогащается солями
с низкими эвтектиками и, в первую очередь, бромидными и хлоридными
солями, а соответствующие им катионы занимают ряд
K ? Na ? Mg ? Ca ? Li.
Из сказанного следует, что морская вода полностью не замерзает практически никогда, т.к. эвтектики таких солей как LiCl и CaBr составляют -67 и -82оС соответственно, а при понижении температуры рапы ниже эвтектики CaCl2 (-49 - -55оС), возможно образование рассолов этих солей.
Слайд 15Важным климатическим параметром являются ветры
На морских побережьях в зависимости от
направления и интенсивности ветра меняется химический состав атмосферных осадков, поверхностных
и грунтовых вод.
Ветры могут уносить на 100-1000 км морские соли, соляную пыль с солончаков и усыхающих соленых озер, вулканические дымы, дымы промышленных предприятий.
Слайд 16В засушливых областях ветер может изменять соотношение главных ионов в
природных водах. При полном усыхании соляных озер на поверхности образуется
соляная корка, обогащенная хлоридами и сульфатами Mg и сульфатами Na, которая разрушается и выносится ветром.
Оставшиеся в донных отложениях хлориды Na в дождливые годы растворяются, но озерная вода содержит уже меньше «горьких» солей. Похожие процессы протекают и на поверхности солончаков, очищая залегающие под ними воды от хлоридов Mg и сульфатов Mg и Na.
Слайд 17Рельеф
Связь динамики и минерализации.
расчлененность ? интенсивность водообмена;
чем рельеф пересеченней, тем
интенсивней водообмен и меньше минерализация воды;
чем выше абсолютные отметки
местности, тем больше общая увлажненность и соответственно меньше минерализация воды
Слайд 18поясность и ярусность
Так формируется высотная поясность; Пояса на разных высотах
в горных районах отличаются по характеру осадков, температуры, таяния ледников,
растительности
Для горных стран (на примере Памира и Тянь-Шаня – В.С. Самарина) характерна уже ярусность рельефа.
Слайд 19роль микрорельефа в аридных областях
В областях с аридным климатом на
формирование химического состава природных вод решающее влияние оказывает испарение
Отдельные
формы рельефа, регулируют соотношение скопления влаги и ее испарения, формируют своеобразную контролируемую рельефом гидрохимическую зональность
Особенно существенны отрицательные формы, и среди них - падины, балки, речные долины и соры.
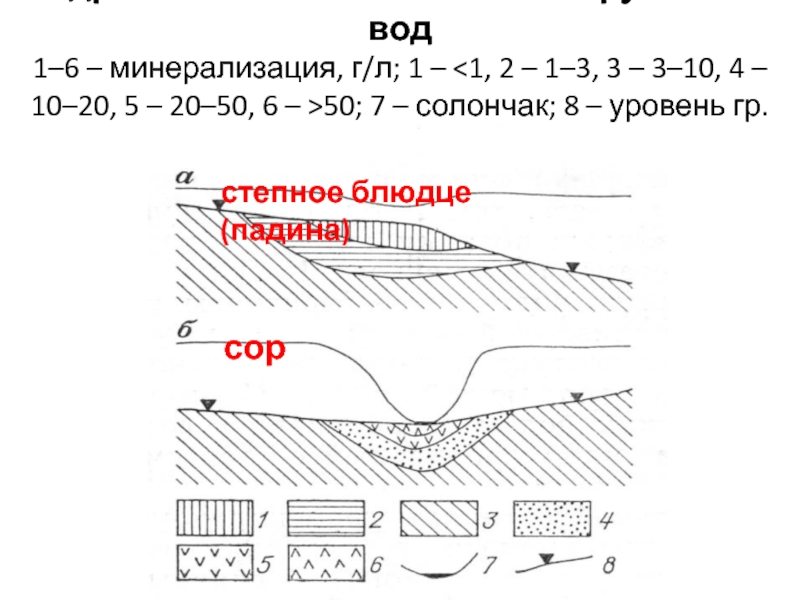
Слайд 20Падины (степные блюдца)
Представляют собой понижения размером до сотен квадратных метров
и глубиной вреза до 1 м. На окружающей желто-бурой степи
падины резко выделяются, так как покрыты ярко-зелеными влаголюбивыми травами.
Грунты обычно выщелочены и отличаются повышенной песчанистостью и трещиноватостью, хорошей водопроницаемостью
Это приводит к формированию под ними пресных грунтовых вод, которые широко используются для водоснабжения.
Слайд 21Гидрохимическая зональность грунтовых вод
1–6 – минерализация, г/л; 1 –
2 – 1–3, 3 – 3–10, 4 – 10–20, 5
– 20–50, 6 – >50; 7 – солончак; 8 – уровень гр.вод.
степное блюдце (падина)
сор
Слайд 22Гидрография
Чем гуще речная сеть, тем интенсивней водообмен в верхних водоносных
горизонтах; поэтому солей в грунтовых водах и питаемой ими реке
становится меньше.
Но глубоко врезанная речная сеть может вскрыть водоносные горизонты напорных вод с повышенной минерализацией – и ее роль может оказаться обратной: в реку начнет поступать вода повышенной минерализации.
Слайд 23Так, в р. Шелонь, впадающей в оз. Ильмень, в результате
разгрузки артезианских вод минерализация воды в межень может достигать 1 г/л,
а гидрокарбонатный состав сменяться хлоридным.
Роль речной сети как транспорта воды из увлажненных территорий (или в горах) в степи и пустыни, где эти реки становятся главным, источником пресной воды. Вблизи них формируются горизонты пресных грунтовых вод.
Крупные реки, транспортирующие воду с хим. составом, не характерным для данной зоны (Нил, Волга, Сыр-Дарья, Аму-Дарья)
Слайд 25Физико-химические факторы Растворимость
Легкорастворимые (>2 г/л)
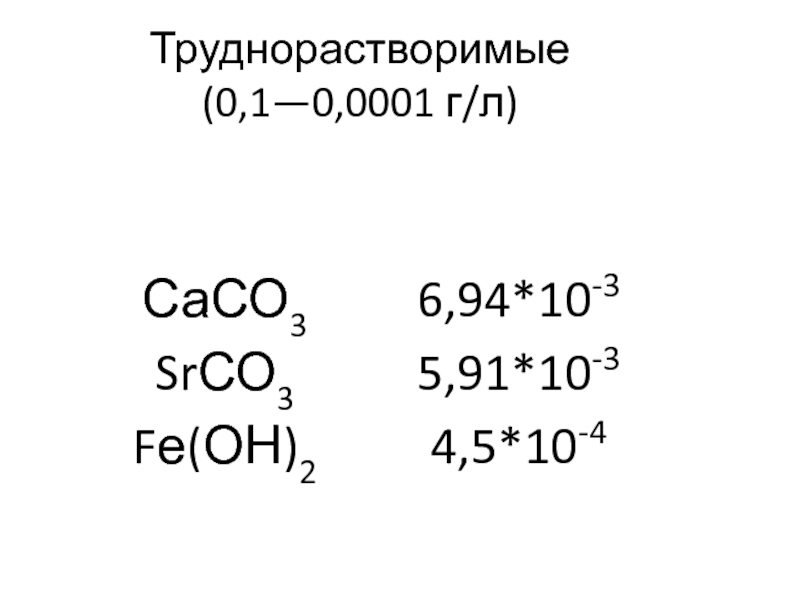
Слайд 27Труднорастворимые
(0,1—0,0001 г/л)
Слайд 29
Растворимость мирабилита Na2SO4 .10H2O
в интервале температур от 0 до 30о
возрастает от 45 до 300 г/кг, а при дальнейшем росте
температуры, когда мирабилит переходит в тенардит Na2SO4 – падает.
Похожая ситуация и с минералами группы соды.
NaCl: 0o – 263 г/кг; 100о – 282 г/кг;
хлориды кальция и магния – повышение на 20-30%
Слайд 30Классификация природных вод по кислотно-щелочной и окислительно-восстановительной обстановке
1–9 –
линии, соответствующие главным окислительно-восстановительным и щелочно-кислотным реакциям; I–XIX – классы
по окислительно-восстановительной и щелочно-кислотной обстановке
Слайд 31Наклонные линии на этой диаграмме соответствуют следующим окислит.-восстановительным реакциям:
1) граница
устойчивости воды, выше и правее которой вода окисляется до кислорода
2) граница, выше и правее которой возможно окисление воды до перекиси водорода
3) граница, выше и правее которой сероводород окисляется до серной кислоты
4) граница устойчивости воды, ниже и левее которой появляется свободный водород
Слайд 32Вертикальные линии диаграммы определяются константами диссоциации главных природных кислот:
5) равенство
концентраций серной кислоты и первой ступени ее диссоциации
6) левее
исчезает гидрокарбонат-ион
7) равенство концентрации иона водорода и гидроксил-иона, а также сероводорода и гидросульфид-иона
8) левее исчезает карбонат-ион
9) равенство концентраций гидрокарбонат- и карбонат-ионов
Слайд 33В соответствии с этими границами обстановку в полях II–VII можно
назвать окислительной;
VIII–XIII – нейтральной;
XIV–XVIII – восстановительной. Воды в
полях II, VIII, XIV – ультракислые;
III, IX, XV – кислые;
IV, X, XVI – слабокислые;
V, XI, XVII - слабощелочные; VI, XII, XVIII – щелочные;
VII, XIII – ультращелочные;
I, XIX – вода неустойчива
Слайд 34Температура.
а) Влияние на растворимость минералов
б) Влияние на свойства глинистых водоупоров
в)
Влияние на процессы гидратации-дегидратации
Слайд 35
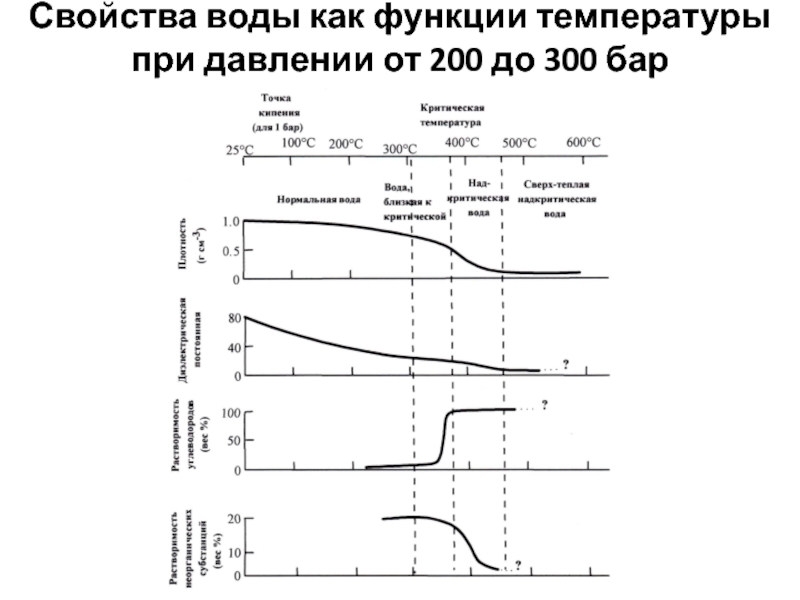
С повышением температуры изменяется растворяющая способность воды. При этом растворимость
одних компонентов может возрастать, других падать. Особенно резко меняется способность
воды к растворению вблизи критической области.
Слайд 36Свойства воды как функции температуры при давлении от 200 до
300 бар
Слайд 37С ростом температуры увеличивается диссоциация воды, так как этот процесс
эндотермичен.
В результате повышения температуры и давления меняется не только
химический состав воды, но и её реакционная способность.
В условиях повышенных температур подвергаются гидролизу обычно устойчивые силикаты и алюмосиликаты.
При 100оС нейтральная величина рН 6,1.
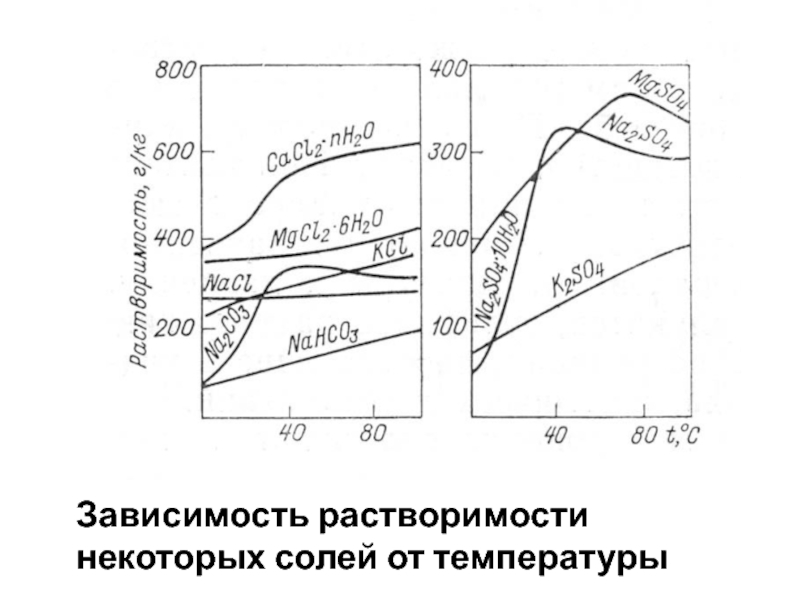
Слайд 38Зависимость растворимости некоторых солей от температуры
Слайд 39Растворимость солей Na, в общем, растёт с увеличением температуры, Ca
– падает (кроме CaCl2). Растворимость MgCO3 , даже при насыщении
CO2, с увеличением температуры от 13 до 100 оС падает с 28,4 до 0.0 г/л. Аналогично изменяется и растворимость карбонатов кальция.
Растворимость CO2 с ростом температуры заметно уменьшается. Растворимость SiO2 в определённых условиях пропорциональна росту температуры. Увеличивается также с повышением температуры растворимость многих соединений As и B.
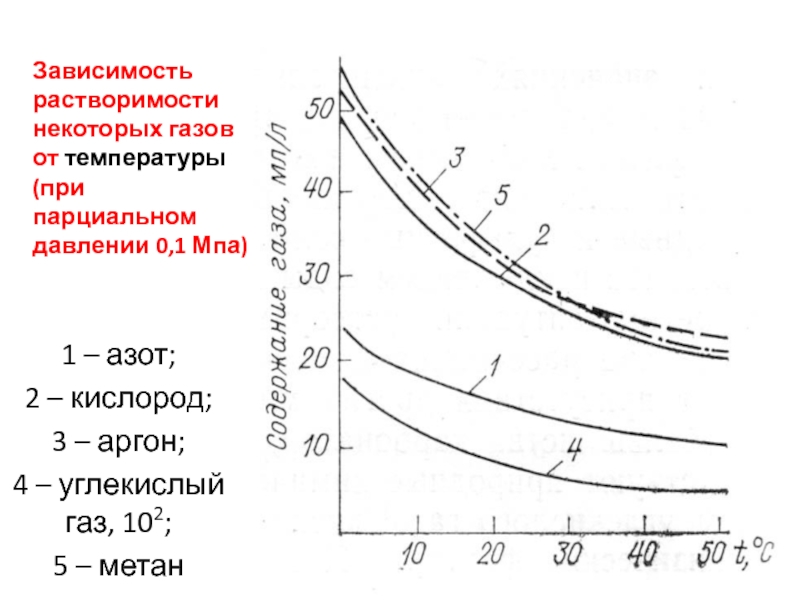
Слайд 40Зависимость растворимости некоторых газов от температуры (при парциальном давлении 0,1 Мпа)
1
– азот;
2 – кислород;
3 – аргон;
4 –
углекислый газ, 102;
5 – метан
Слайд 41Температурная зональность Западно-Сибирского артезианского бассейна
1 – водоносные горизонты и комплексы;
2 – региональные водоупоры; 3 – фундамент артезианского бассейна; 4
– изолинии температур подземных вод, ОС; 5 – подошва ММП
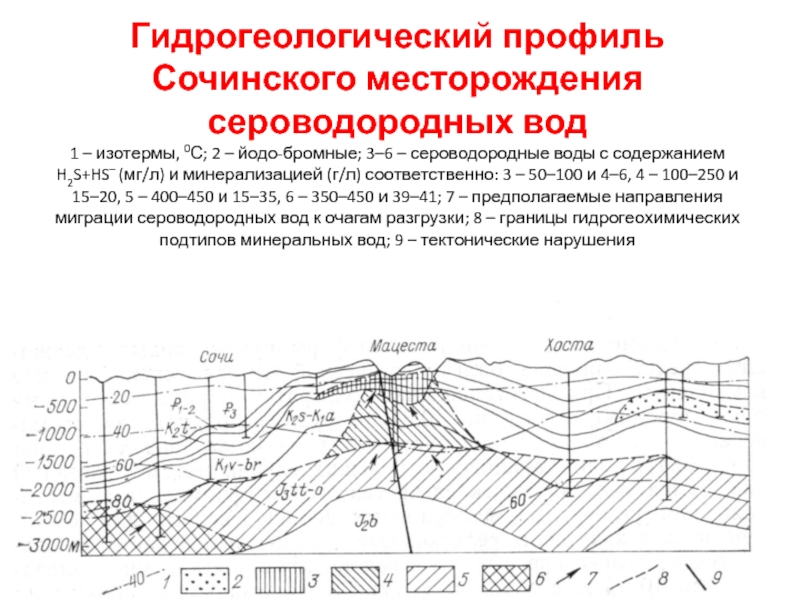
Слайд 42Гидрогеологический профиль Сочинского месторождения сероводородных вод
1 – изотермы, 0С;
2 – йодо-бромные; 3–6 – сероводородные воды с содержанием H2S+HS–
(мг/л) и минерализацией (г/л) соответственно: 3 – 50–100 и 4–6, 4 – 100–250 и 15–20, 5 – 400–450 и 15–35, 6 – 350–450 и 39–41; 7 – предполагаемые направления миграции сероводородных вод к очагам разгрузки; 8 – границы гидрогеохимических подтипов минеральных вод; 9 – тектонические нарушения
Слайд 43Геотермальные проявления Италии, р-н г. Сиена
Образование гейзеритов. SiO2 > 90-95
Слайд 44Термальные источники на о. Сан-Мигель
Слайд 46Карбонатные отложения вулканического происхождения