Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Предельные углеводороды Насыщенные алифатические углеводороды Алканы или
Содержание
- 1. Предельные углеводороды Насыщенные алифатические углеводороды Алканы или
- 2. Углеводороды это органические соединения, молекулы которых состоят
- 3. Алканы являются насыщенными углеводородами и содержат максимально
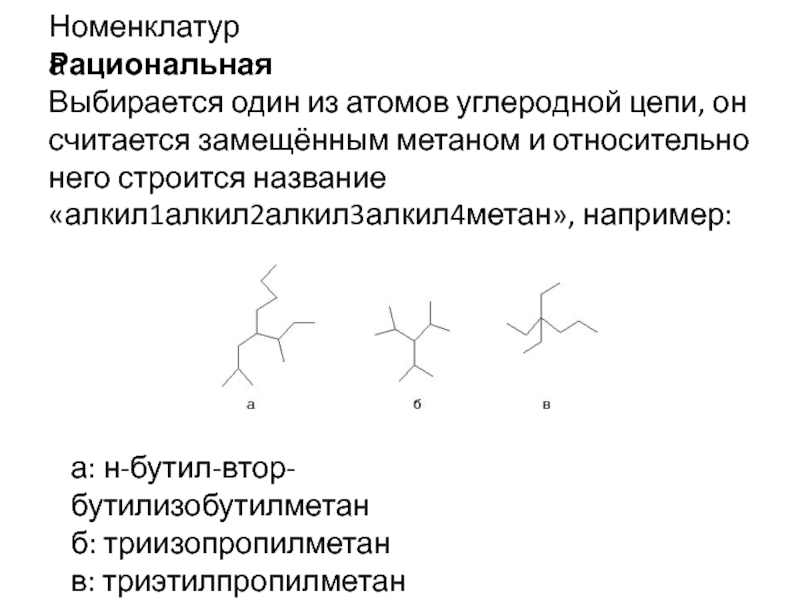
- 4. НоменклатураРациональнаяВыбирается один из атомов углеродной цепи, он
- 5. Систематическая ИЮПАКПо номенклатуре ИЮПАК названия алканов образуются
- 6. ИЗОМЕРИЯПервые три члена гомологического ряда алканов (метан,
- 7. Физические свойства.Алканы – бесцветные вещества, легче воды,
- 8. Температуры плавления и кипения увеличиваются с молекулярной
- 9. Химические свойства.Алканы химически мало активны.Для алканов наиболее
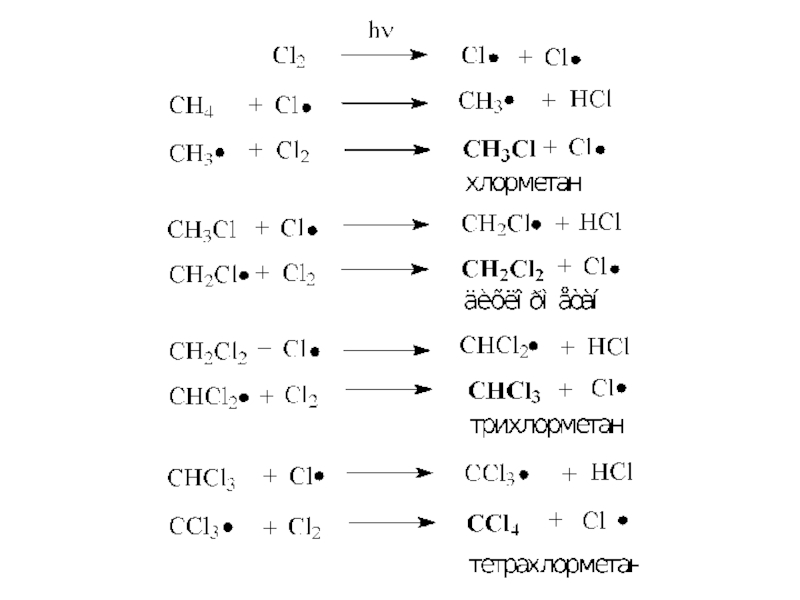
- 10. Галогенирование (замещение атома водорода атомом галогена -
- 11. Слайд 11
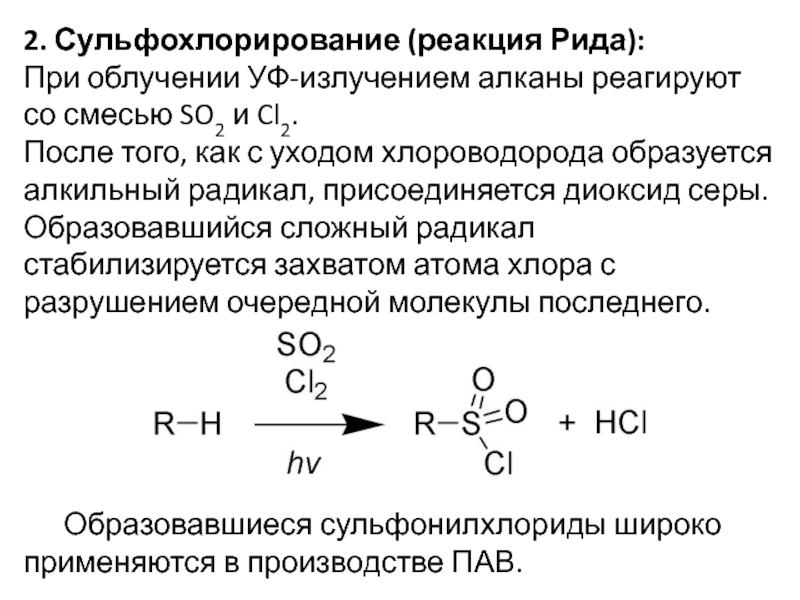
- 12. 2. Сульфохлорирование (реакция Рида):При облучении УФ-излучением алканы
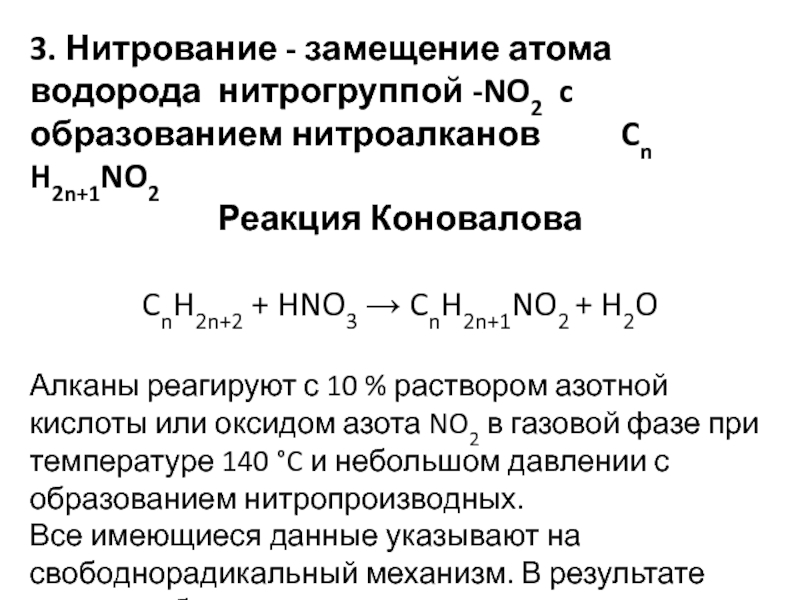
- 13. 3. Нитрование - замещение атома водорода нитрогруппой
- 14. Реакции окисления.При обычных условиях алканы устойчивы к
- 15. При каталитическом окислении парафинов могут образовываться спирты,
- 16. Термические превращения алканов:РазложениеРеакции разложения происходят лишь под
- 17. Крекинг - термический крекинг и каталитический крекинг
- 18. ДегидрированиеОбразование:1) В углеродном скелете 2 (этан) или
- 19. 3) В углеродном скелете 6 (гексан) и
- 20. Конверсия метанаВ присутствии никелевого катализатора протекает реакция:
- 21. Реакции электрофильного замещенияИзомеризация:Под действием катализатора (например, AlCl3)
- 22. ПолучениеГлавным источником алканов (а также других углеводородов)
- 23. Газификация твердого топлива (Процессы Бертло, Шрёдера, Бергиуса)
- 24. Из солей карбоновых кислот при повышенной температуре
- 25. Из галогеналканов: А) синтез Вюрца: СН3 –
- 26. Электролиз солей карбоновых кислот (синтез Кольбе)2R–COONa +2H2O
- 27. Скачать презентанцию
Углеводороды это органические соединения, молекулы которых состоят только из углерода C и водорода H. Алканы это ациклические углеводороды линейного или разветвлённого строения, содержащие только простые σ-связи и образующие гомологический ряд с общей
Слайды и текст этой презентации
Слайд 2Углеводороды это органические соединения, молекулы которых состоят только
из углерода
C и водорода H.
строения, содержащие только простые σ-связи и образующие гомологический ряд с общей формулой CnH2n+2Слайд 3Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов
водорода.
Каждый атом углерода в молекулах алканов находится в состоянии
sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28'. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью.
Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4).
Слайд 4Номенклатура
Рациональная
Выбирается один из атомов углеродной цепи, он считается замещённым метаном
и относительно него строится название «алкил1алкил2алкил3алкил4метан», например:
а: н-бутил-втор-бутилизобутилметан
б: триизопропилметан
в: триэтилпропилметан
Слайд 5Систематическая ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса
-ан путём добавления к соответствующему корню от названия углеводорода.
Выбирается
наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.Слайд 6ИЗОМЕРИЯ
Первые три члена гомологического ряда алканов (метан, этан, пропан) изомеров
не имеют.
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии
— изомерией углеродного скелета, а начиная с C7H16 — также оптической изомерией.Слайд 7Физические свойства.
Алканы – бесцветные вещества, легче воды, плохо растворяются в
воде, но растворяются в органических растворителях (бензол, тетрахлорметан).
Газообразные и жидкие
алканы образуют взрывоопасные смеси с воздухом. Слайд 8Температуры плавления и кипения увеличиваются с молекулярной массой и длиной
главной углеродной цепи.
При нормальных условиях неразветвлённые алканы с
CH4 до C4H10 и неопентан — газы; с C5H12 до C13H28 — жидкости; начиная с C14H30 и далее — твёрдые вещества.Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Слайд 9Химические свойства.
Алканы химически мало активны.
Для алканов наиболее характерны реакции замещения.
В этих реакциях происходит гомолитический разрыв ковалентных связей, они осуществляются
по свободнорадикальному (цепному) механизму. Слайд 10Галогенирование (замещение атома водорода атомом галогена - F, Cl, Br
с образованием галогеналкана RHal).
Алканы очень активно реагируют со фтором.
Хлорирование протекает под действием света и является фотохимической цепной реакцией.СН4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
При галогенировании алканов более сложного строения на атом галогена легче всего замещаются атомы водорода при третичном углеродном атоме, затем – при вторичном и, наконец, при первичном.
Слайд 122. Сульфохлорирование (реакция Рида):
При облучении УФ-излучением алканы реагируют со смесью
SO2 и Cl2.
После того, как с уходом хлороводорода образуется
алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего. Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Слайд 133. Нитрование - замещение атома водорода нитрогруппой -NO2 c образованием
нитроалканов Cn H2n+1NO2
Реакция Коновалова
CnH2n+2 + HNO3
→ CnH2n+1NO2 + H2OАлканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных.
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Слайд 14Реакции окисления.
При обычных условиях алканы устойчивы к действию окислителей (KMnO4,
K2Cr2O7).
1. Окисление кислородом воздуха при высоких температурах (горение)
А) полное окисление
(избыток О2) с образованием углекислого газа и воды: СН4 + 2О2 → СО2 + 2Н2ОБ) неполное окисление (недостаток О2)
2СН4 + 3О2 → 2СО + 4Н2О
СН4 + О2 → С + 2Н2О
В) каталитическое окисление (катализаторы – соединения Mn)
СН3 - СН2 - СН2- СН3 → 2СН3СООН + Н2О
Слайд 15При каталитическом окислении парафинов могут образовываться спирты, альдегиды, карбоновые кислоты.
При
мягком окислении СН4 в присутствии катализатора кислородом при 200 °C
могут образоваться:метанол: 2СН4 + О2 → 2СН3ОН;
формальдегид: СН4 + О2 → СН2О + Н2O;
муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O.
Слайд 16Термические превращения алканов:
Разложение
Реакции разложения происходят лишь под влиянием больших температур.
Повышение температуры приводит к разрыву углеродной связи и образованию свободных
радикалов.CH4 → C + 2H2 (t > 1000 °C)
C2H6 → 2C + 3H2.
Слайд 17Крекинг - термический крекинг и каталитический крекинг на алюмосиликатном катализаторе.
При
нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием
сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции.При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
Расщепление н-бутана на этан и этилен:
С4Н10 → С2Н6 + С2Н4
Расщепление н-гексадекана на н-октан и октен:
C16H34 → C8H18 + C8H16
Слайд 18Дегидрирование
Образование:
1) В углеродном скелете 2 (этан) или 3 (пропан) атома
углерода — получение (терминальных) алкенов, так как других в данном
случае не может получиться; выделение водорода:а) CH3-CH3 → CH2=CH2 + H2 (этан → этен);
б) CH3-CH2-CH3 → CH2=CH-CH3 + H2 (пропан → пропен).
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3.
2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода.
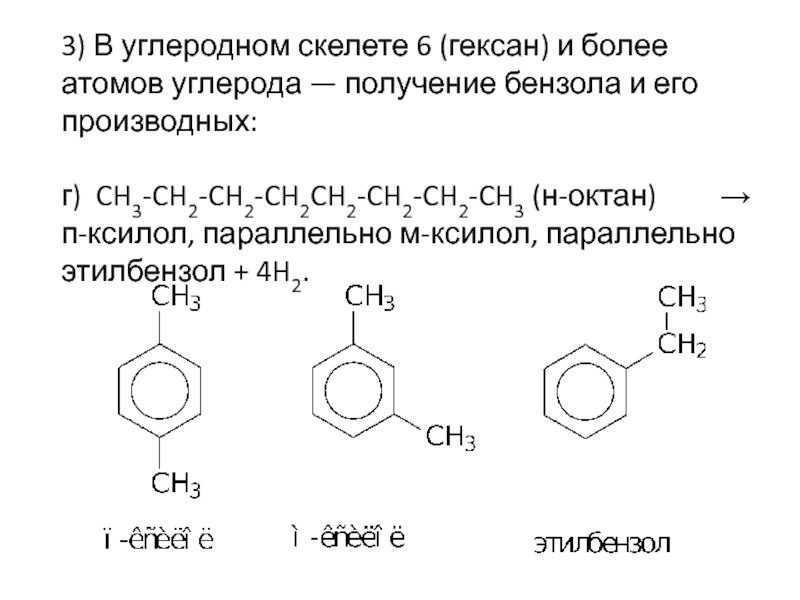
Слайд 193) В углеродном скелете 6 (гексан) и более атомов углерода
— получение бензола и его производных:
г) CH3-CH2-CH2-CH2CH2-CH2-CH2-CH3 (н-октан)
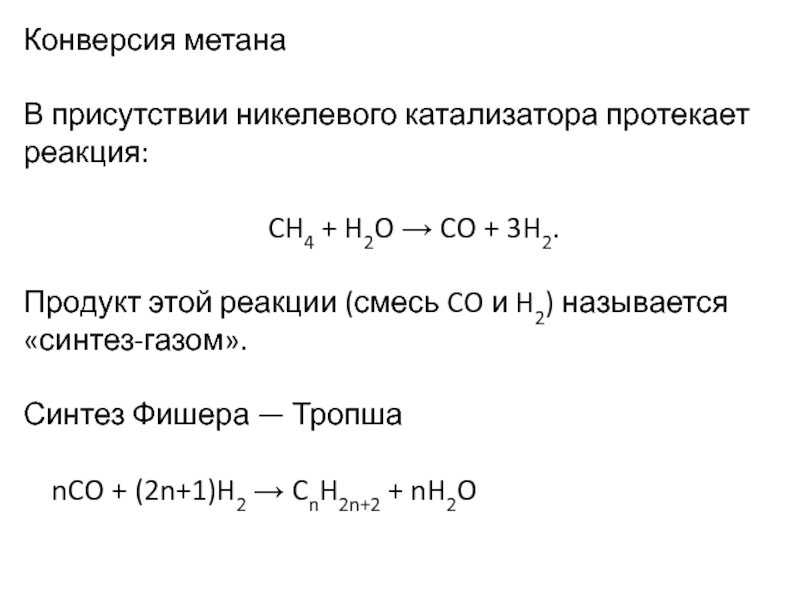
→ п-ксилол, параллельно м-ксилол, параллельно этилбензол + 4H2.Слайд 20Конверсия метана
В присутствии никелевого катализатора протекает реакция:
CH4 +
H2O → CO + 3H2.
Продукт этой реакции (смесь CO и
H2) называется «синтез-газом».Синтез Фишера — Тропша
nCO + (2n+1)H2 → CnH2n+2 + nH2O
Слайд 21Реакции электрофильного замещения
Изомеризация:
Под действием катализатора (например, AlCl3) происходит изомеризация алкана:
например, бутан (C4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из
н-бутана в 2-метилпропан (изобутан).Слайд 22Получение
Главным источником алканов (а также других углеводородов) являются нефть и
природный газ, которые обычно встречаются совместно.
Восстановление галогенпроизводных алканов, спиртов, карбонильных
соединений.Гидрирование непредельных углеводородов:
CnH2n + H2 → CnH2n+2
CnH2n-2 + 2H2 → CnH2n+2
Катализатором реакции являются соединения никеля, платины или палладия.
Слайд 23Газификация твердого топлива (Процессы Бертло, Шрёдера, Бергиуса)
Проходит при повышенной
температуре и давлении.
Катализатор — Ni (для Бертло), Mo (для Шрёдера)
или без катализатора (для Бергиуса):C + 2H2 → CH4
Слайд 24Из солей карбоновых кислот при повышенной температуре (реакция Дюма, пиролиз).
Пиролизом называют термическое разложение веществ без доступа воздуха.
При нагревании
твердых солей карбоновых кислот с щелочами образуется предельный углеводород, содержащий на один атом углерода меньше, чем в кислоте, образующей исходную соль.CH3COONa(тв.) + NaOH/Ca(OH)2(тв.) → Na2CO3 + CH4↑
Слайд 25Из галогеналканов:
А) синтез Вюрца:
СН3 – Cl +
2Na + Cl – CH3 → СН3 – СН3 +
2NaClПрактическое значение этот способ имеет только для получения симметричных алканов с четным числом атомов углерода.
Б) синтез Вюрца – Гриньяра:
СН3 – Cl + Mg →CH3 – Mg – Cl (реактив Гриньяра)
CH3 – Mg – Cl + Cl – CH2 – CH3 + MgCl2
Вместо натрия в этой реакции могут быть использованы и другие металлы, например литий, магний, цинк.
Слайд 26Электролиз солей карбоновых кислот (синтез Кольбе)
2R–COONa +2H2O → R–R +
2CO2 + H2+2NaOH
Разложение карбида Al водой или кислотами
Al4C3 +
12 H2O → 3СН4 + 4Al(OH)3Al4C3 + 12 НCl → 3СН4 + 4AlCl3
Этим способом в лабораторных условиях можно получить метан.