Слайд 1 Федеральное государственное бюджетное учреждение высшего образования
Кемеровский государственный медицинский
университет
кафедра медицинской биохимии
Введение в биохимию
Биохимия белка
Энзимология I
Доцент медицинской биохимии к.м.н.. Е.И. Паличева
Кемерово 2020
Лекция 1
Слайд 2ПЛАН ЛЕКЦИИ
Биохимия- фундаментальная дисциплина медицины
Биохимия белка
Функции белка
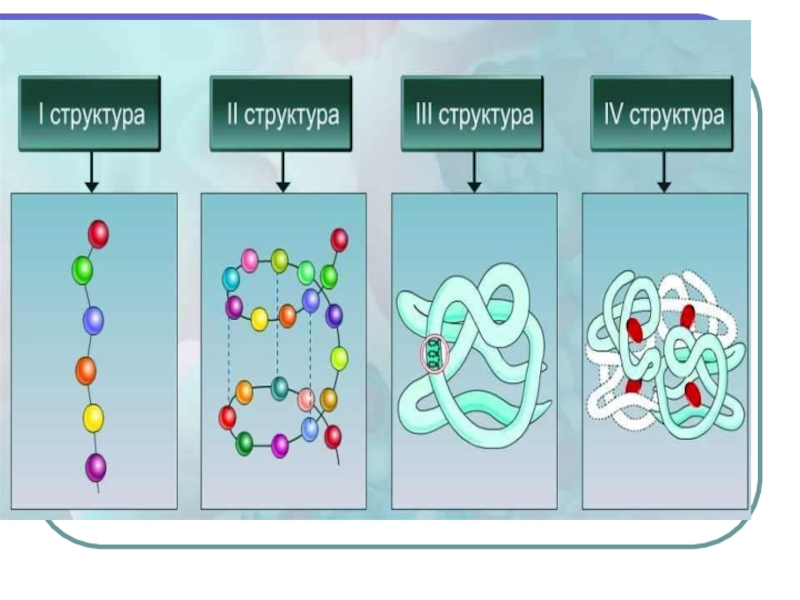
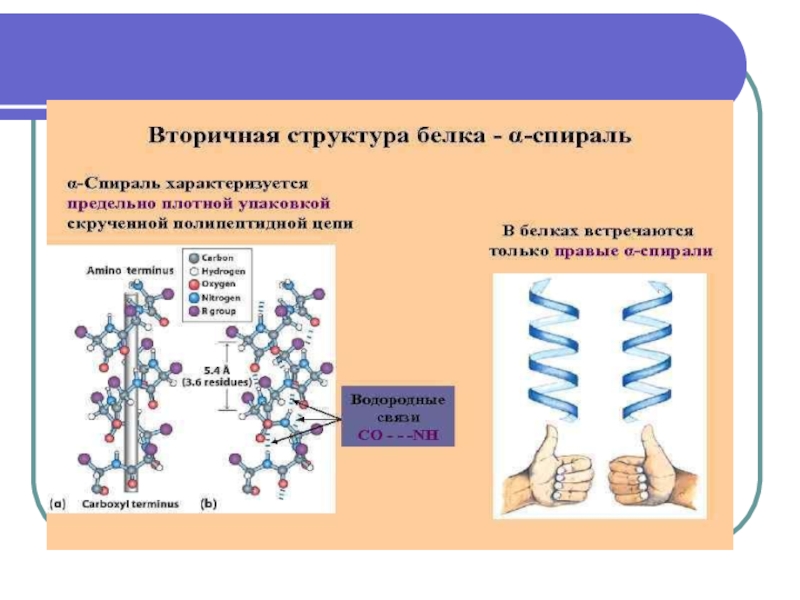
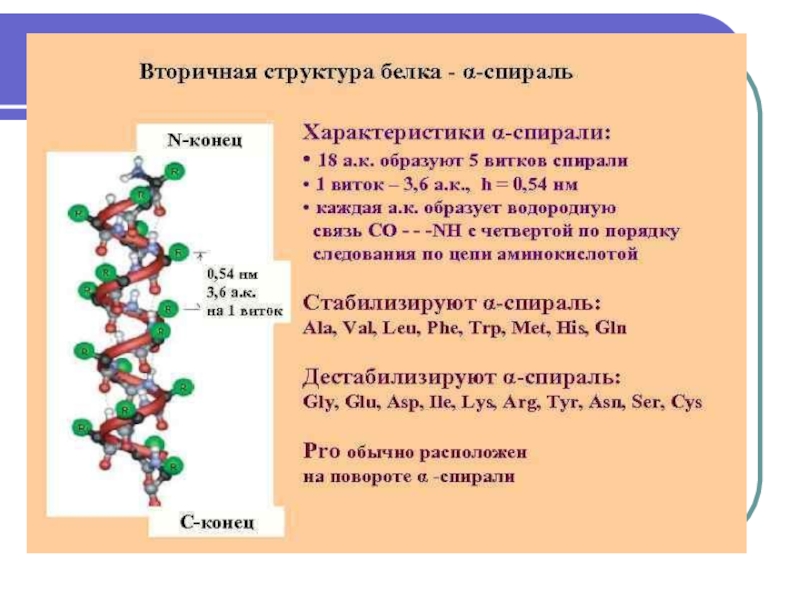
Структурная организация белка
Классификация белка
Введение в медицинскую энзимологию.
Свойства ферментов
строение ферментов
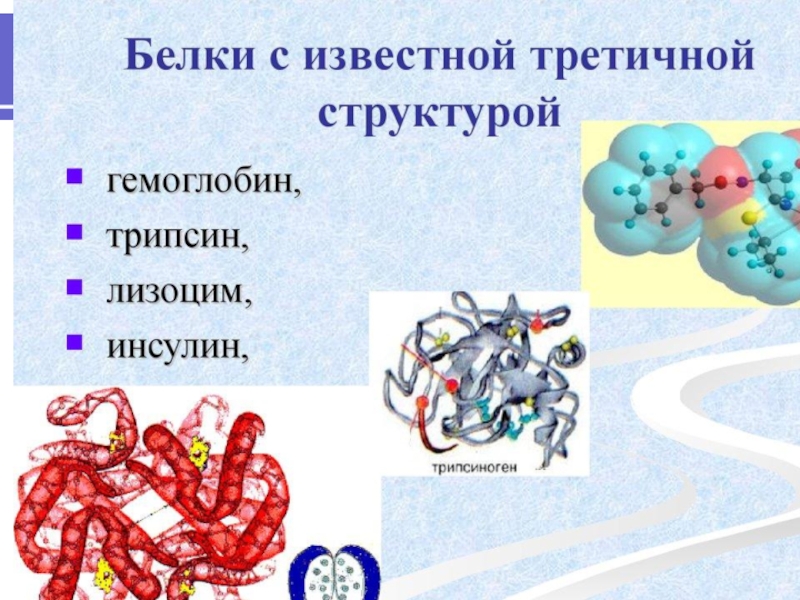
Слайд 5 Биохимия белка
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав
белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы
с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000.
Слайд 6Общая характеристика белков по составу
В зависимости от аминокислотного состава, белки бывают:
полноценными — содержат весь набор аминокислот;
неполноценными — какие-то аминокислоты в их составе
отсутствуют.
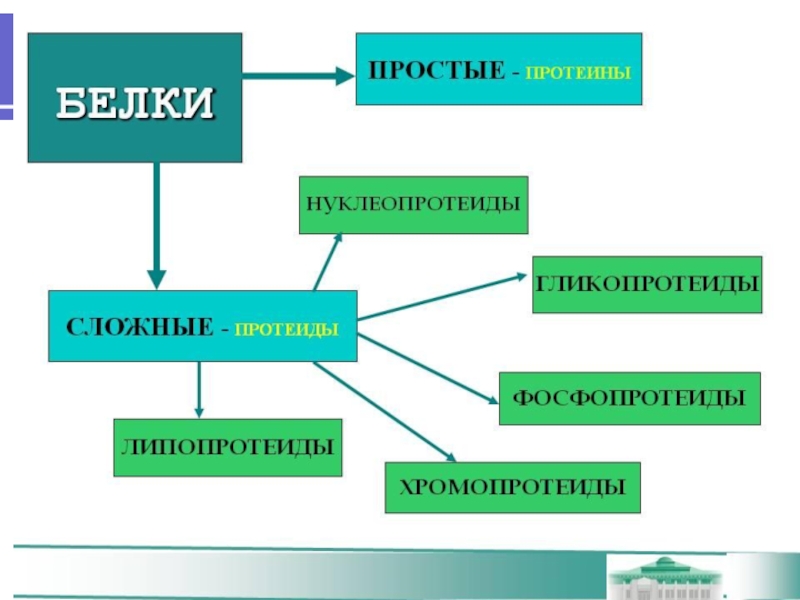
Если белки состоят только из аминокислот, их называют простыми.
Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными.
Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Слайд 8 Общая характеристика аминокислот
Все аминокислоты содержат:
карбоксильную группу (–СООН),
аминогруппу (–NH2),
радикал или R-группу (остальная часть молекулы).
Строение радикала
у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты (R - гидрофобные неполярные и полярные незаряженные), имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы (R- полярные заряженные + и -).
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
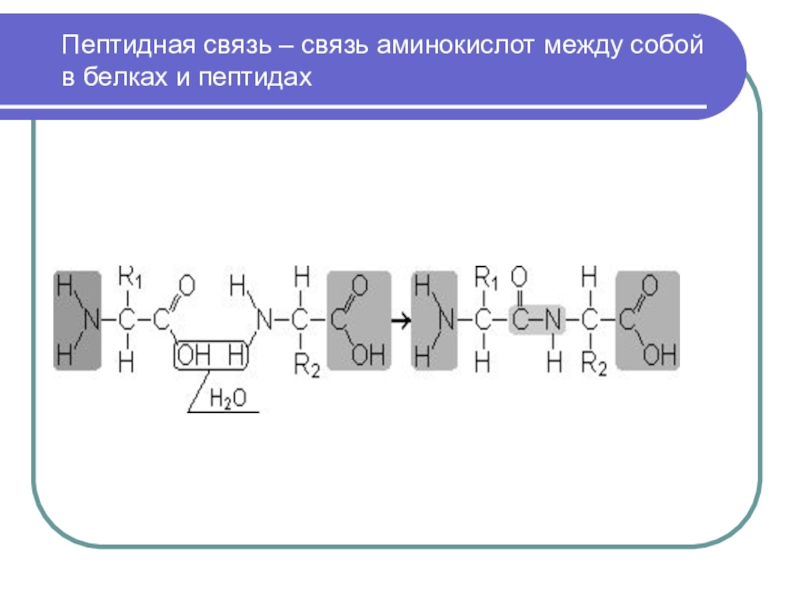
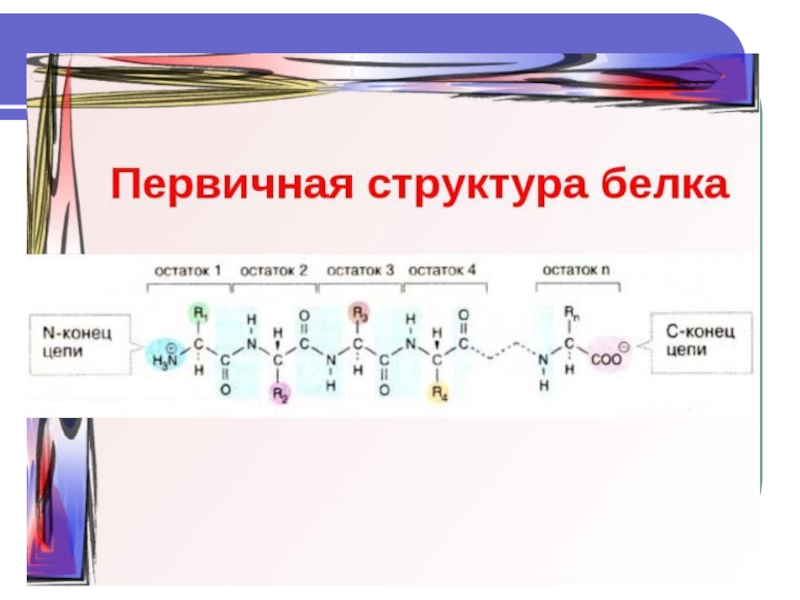
Слайд 9 Пептидная связь – связь аминокислот между собой
в белках и пептидах
Слайд 25Физико-химические свойства белков: ионизация, гидратация, растворимость.
Растворимость. Она зависит от
аминокислотного состава белка и природы растворителя. Водорастворимые белки называются альбуминами,
к ним относятся белки крови и молока. К нерастворимым, или склеропротеинам, относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, который входит в состав шёлка и паутины
Ионизация. Заряд белковой молекулы обусловлен реакцией среды и соотношением ионогенных групп в белковой молекуле.
Гидратация. Молекула белка дифильна, в ней имеются гидрофильные и гидрофобные группы, причем гидрофильные в большинстве нативных белков находятся на поверхности, а гидрофобные внутри белковой молекулы.
Слайд 26Факторы, определяющие стабильность белковых растворов:
Наличие зарядов в белковой молекуле. Одноименные
заряды способствуют растворимости белка, т.к. препятствуют соединению молекул и выпадению
в осадок.
Наличие гидратной оболочки, препятствующей объединению белковых молекул.
Для осаждения белка, его необходимо лишить этих двух факторов устойчивости. Методом осаждения белка является высаливание - осаждение белка с помощью нейтральных солей.
В полунасыщенном растворе (NH4)2-SO4 осаждаются глобулины, а в насыщенном - альбумины.
После удаления осаждающего фактора, белки переходят в растворённое состояние.
Слайд 27Каждый белок характеризуется изоэлектрической точкой (pI) — кислотностью среды (pH)
при которой суммарный электрический заряд молекул данного белка равен нулю
и, соответственно, они не перемещаются в электрическом поле (например, при электрофорезе).
В изоэлектрической точке гидратация и растворимость белка минимальны.
Величина pI зависит от соотношения кислых и основных аминокислотных остатков в белке: у белков, содержащих много кислых аминокислотных остатков, изоэлектрические точки лежат в кислой области (такие белки называют кислыми), а у белков, содержащих больше основных остатков, — в щелочной (основные белки). Значение pI данного белка также может меняться в зависимости от ионной силы и типа буферного раствора, в котором он находится, так как нейтральные соли влияют на степень ионизации химических группировок белка.
Слайд 29 ФЕРМЕНТЫ (ЭНЗИМЫ)
Биологические катализаторы, белковой природы, ускоряющие химические реакции
в клетке.
S + Е Р
где
S- субстрат
Е- фермент
Р- продукт
Слайд 30 ФЕРМЕНТЫ – ЭНЗИМЫ
история открытия
Энзим в переводе из греческого означает «закваска».
Открытию этого вещества человечество обязано голландцу Яну Баптисту Ван-Гельмонту, жившему в XVI веке. В свое время он весьма заинтересовался спиртовым брожением и в ходе исследования нашел неизвестное вещество, ускоряющее этот процесс. Голландец назвал его fermentum, что в переводе означает «брожение».
Затем, почти трема веками позже, француз Луи Пастер, также наблюдая за процессами брожения, пришел к выводу, что ферменты – не что иное, как вещества живой клетки.
А через некоторое время немец Эдуард Бухнер добыл фермент из дрожжей и определил, что это вещество не является живым организмом. Он также дал ему свое название – «зимаза».
Еще несколькими годами позже другой немец Вилли Кюне предложил все белковые катализаторы разделить на две группы: ферменты и энзимы. Причем вторым термином он предложил называть «закваску», действия которой распространяются вне живых организмов.
И лишь в 1897 году решено использовать энзим и фермент как абсолютные синонимы.

Слайд 31Медицинская энзимология
Ферментные широко используют в медицине. Ферменты в медицинской практике
находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств.
Гний, группа заболеваний связанных генетически обусловленным отсутствием или низкой активностью ферментов – это энзимопатология.
Энзимодиагностика
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
· при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
· количество высвобождаемого фермента достаточно для его обнаружения;
· активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений;
· ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
· существуют различия во внутриклеточной локализации ряда ферментов.
Кроме того, ферменты используют в качестве специфических реактивов для определения ряда веществ. Так, глюкозооксидазу применяют для количественного определения глюкозы в моче и крови. Фермент уреазу используют для определения содержания количества мочевины в крови и моче. С помощью различных дегидрогеназ обнаруживают соответствующие субстраты, например пируват, лактат, этиловый спирт и др.

Слайд 32Энзимодиагностика
Заключается в постановке диагноза заболевания (или синдрома) на основе определения
активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на
следующих позициях:
при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
количество высвобождаемого фермента достаточно для его обнаружения;
активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений;
ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
существуют различия во внутриклеточной локализации ряда
ферментов.
Слайд 33Ферменты в лабораторной практике
Кроме того, ферменты используют в качестве специфических
реактивов для определения ряда веществ. Так, глюкозооксидазу применяют для количественного
определения глюкозы в моче и крови. Фермент уреазу используют для определения содержания количества мочевины в крови и моче. С помощью различных дегидрогеназ обнаруживают соответствующие субстраты, например пируват, лактат, этиловый спирт и др.
Слайд 34 энзимотерапия
это лечение с помощью энзимов, лечебная эффективность которых
основана на комплексном воздействии на ключевые процессы, происходящие в организме.
Слайд 35 ПРИМЕРЫ ЭНЗИМОТЕРАПИИ
Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта
(Фестал, Панзинорм форте, Мезим форте, Энзистал, Вобэнзим и т.п.), содержащие
пепсин, трипсин, амилазу и т.п., и используемые для заместительной терапии при нарушениях переваривания веществ в желудочно-кишечном тракте.
Тканевой фермент гиалуронидаза нужна организму для обратимого изменения проницаемости межклеточного вещества, в основе которого находится гиалуроновая кислота. Лекарственную форму гиалуронидазы – лидазу – вводят для размягчения рубцов, появления подвижности в суставах, рассасывания гематом.
Слайд 36ПРИМЕРЫ ЭНЗИМОТЕРАПИИ
Цитохром с – белок, участвующий в процессах тканевого дыхания. Его
применяют при асфиксии новорожденных, астматических состояниях, сердечной недостаточности, различных видах
гепатита и т.п.
Рибонуклеаза и дезоксирибонуклеаза входят в состав глазных капель для лечения вирусных конъюнктивитов. При нанесении на рану они разжижают гной, при ингаляциях уменьшают вязкость слизи, деполимеризуя нуклеиновые кислоты в мокроте.
Трипсин ингалируют при бронхолегочных заболеваниях для разжижения густой и вязкой мокроты.
Коллагеназа, трипсин для ускорения отторжения некротизированных тканей, для очистки трофических язв.
Слайд 37Строение ферментов
В молекуле фермента выделяют несколько функциональных участков.
Активный центр
Регуляторный
центр ( для аллостерических ферментов)
Активный центр —это особая часть молекулы фермента, определяющая
её специфичность и каталитическую активность.[1]
Слайд 38 Активный центр
Активный центр непосредственно осуществляет взаимодействие с молекулой субстрата или
с теми её частями, которые непосредственно участвуют в реакции. Характер
взаимодействия фермента и субстрата говорит о наличии в активном центре ряда структурных групп, соединяющихся с различными участками субстрата.
В состав активного центра могут входить небелковые простетические группы, молекулы некоторых коферментов, неорганические ионы.
Взаимодействие между активным центром фермента и молекулой субстрата осуществляется при их сближении на расстояние порядка 15—20 ангстрем, с увеличением расстояния оно быстро ослабевает.
Слайд 39 структура АКТИВНОГО ЦЕНТРА:
Субстратный участок - отвечает за связь с
субстратом.
Каталитический участок – обеспечивает превращение субстрата в продукт.
Слайд 40Активный центр фермента образован из остатков аминокислот, находящихся в составе
различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных.
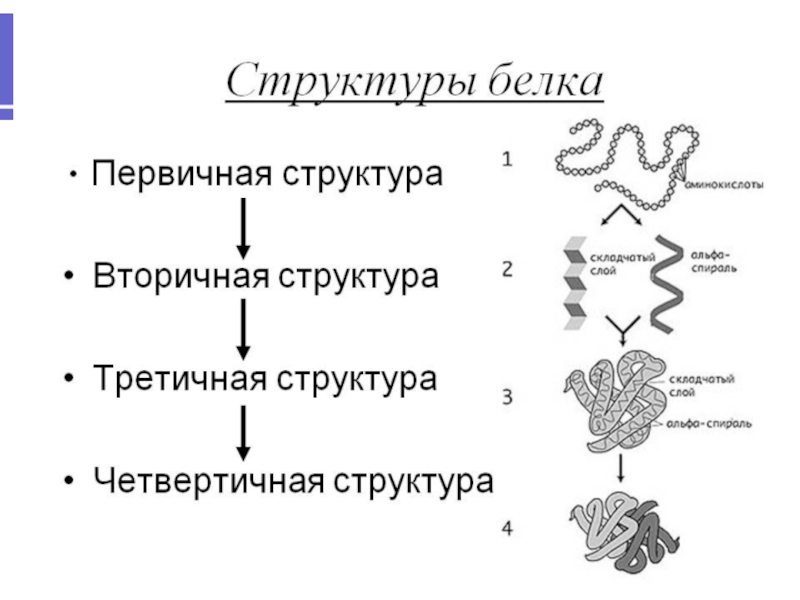
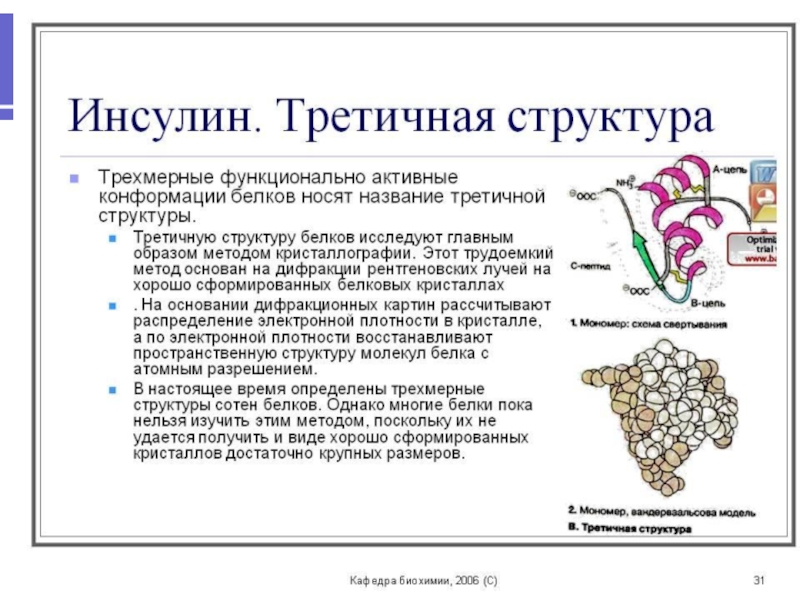
Образуется на уровне третичной структуры белка-фермента.
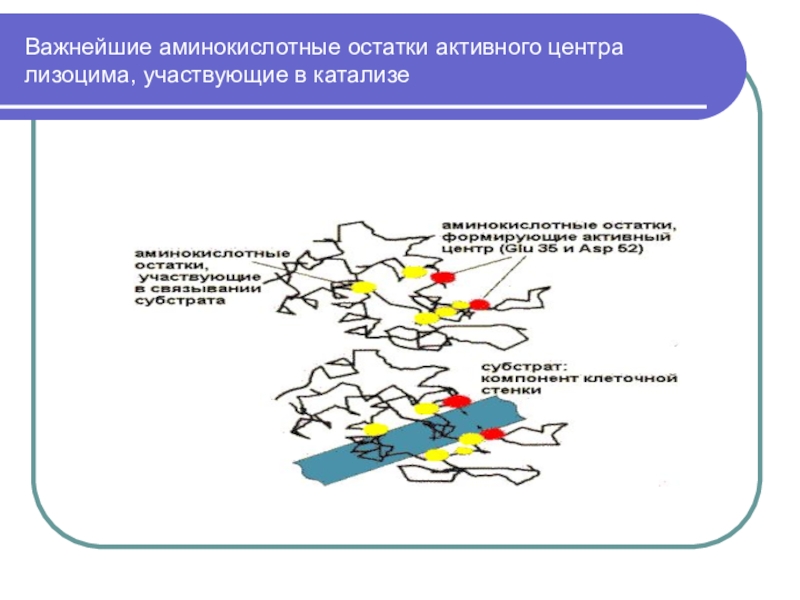
Слайд 41Важнейшие аминокислотные остатки активного центра лизоцима, участвующие в катализе
Слайд 42Структура ферментов
ферменты могут быть простые и сложные
простые состоят только
из белковой
части (АПОФЕРМЕНТА)
в состав сложного фермента ( ХОЛОФЕРМЕНТА)
кроме остатков аминокислот могут входить небелковые простетические группы, молекулы некоторых коферментов, неорганические ионы.
Слайд 43
свойства ФЕРМЕНТОВ
Функции
ферментов сводятся к ускорению химических реакций, отличаясь от других катализаторов
уникальными свойствами:
высокой эффективностью действия;
способностью работать в мягких (физиологических) условиях;
специфичностью действия;
зависимость от количества S и E
способностью к регуляции.
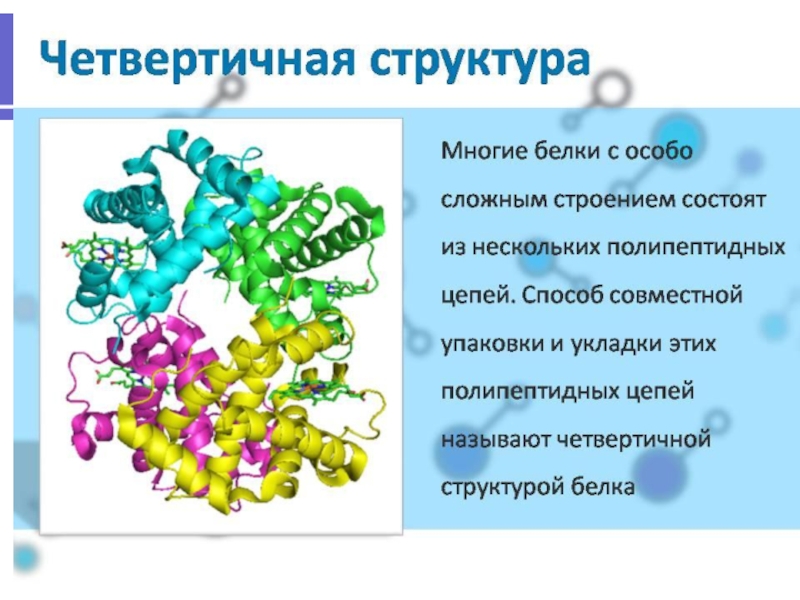
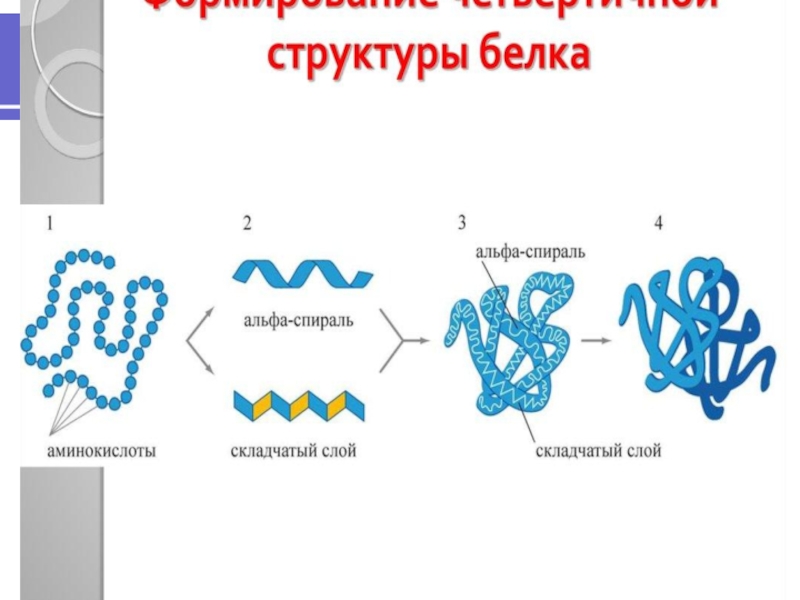
Слайд 44 Структура ферментов
Все ферменты относятся к глобулярным белкам, причем каждый
фермент выполняет специфическую функцию, связанную с присущей ему глобулярной структурой.
Однако активность многих ферментов зависит от небелковых соединений, называемых кофакторами. Молекулярный комплекс белковой части (апофермента) и кофактора называется холоферментом.
Роль кофактора могут выполнять ионы металлов (Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+) или сложные органические соединения. Органические кофакторы обычно называют коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными ковалентными связями - небелковая часть фермента называется простетической группой.
Слайд 45 Роль кофактора в катализе
изменение третичной структуры белка и создание
комплементарности между ферментом и субстратом;
непосредственное участие в реакции в качестве
еще одного субстрата.
выступают как доноры или акцепторы определенных химических групп (в этой роли обычно выступают органические коферменты).
Слайд 46Коферментная функция витаминов
NAD+ , NADP+
Перенос водорода (электронов)
FAD, FMN
Перенос водорода (электронов)
Кофермент А
Активация и перенос ацильных групп
Биотин
Связывание СО2
Пиридоксальфосфат
Перенос аминогрупп
Тетрагидрофолиевая кислота
ТГФК
Перенос одноуглеродных фрагментов
Витамин РР( В5), никотиновая
кислота
Рибофлавин, В2
Пантотеновая кислота, В3
Биотин, витамин Н
Пиридоксин, витамин В6
ФОЛАТ, Витамин В9
Слайд 47 Классификация ферментов
В основе классификации ферментов лежит тип
катализируемой реакции
Оксидоредуктазы - Окислительно-восстановительные реакции.
Трансферазы - Перенос отдельных групп атомов
от донорной молекулы к акцепторной молекуле.
Гидролазы - Гидролитическое расщепление связей
(с участием воды).
Лиазы – Расщепление (образование) связей без участия воды
Изомеразы - Взаимопревращение различных изомеров.
Лигазы (синтетазы) - Образование связей в реакции конденсации двух различных соединений (используется энергия АТР).
Слайд 48 Номенклатура ферментов
В настоящее время известно более 2000 различных
ферментов. Они подразделяются на шесть классов, каждый класс имеет определенный
номер.
Каждый класс ферментов подразделяется на подклассы, которые в свою очередь подразделяются на подподклассы.
Для каждого фермента определенный шифр, состоящий из четырех кодовых цифр, разделенных точками. Первая цифра обозначает номер класса, вторая – номер подкласса, третья – номер подподкласса, четвертая – порядковый номер фермента в данном подподклассе.
пример: 1.1.1.1. – АДГ -алкогольдегидрогеназа
Слайд 49 РЕГУЛЯЦИЯ ферментативных реакций
В живой клетке множество разнообразных соединений, но
реакции между ними не беспорядочны, а образуют строго определенные метаболические
пути, характерные для данной клетки. Индивидуальность клетки в большой степени определяется уникальным набором ферментов, который она генетически запрограммирована производить. Отсутствие даже одного фермента или какой-нибудь его дефект могут иметь очень серьезные отрицательные последствия для организма.
Слайд 50СТАДИИ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
E +S - узнавание ферментом (Е) субстрата
(S)
ES – образование комплекса и химическая модификация
EP
(превращение S в Р)
E+P – Высвобождение Е и Р
Слайд 51Механизмы действия ферментов
Первоначальным событием при действии фермента является его специфическое
связывание с лигандом - субстратом (S). Это происходит в области
активного центра, который формируется из нескольких специфических R-групп аминокислот, определенным образом ориентированных в пространстве.
Слайд 52ТЕОРИЯ ЖЕСТКОЙ МАТРИЦЫ
Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр
фермента строго соответствует конфигурации субстрата и не изменяется при его
присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.
Слайд 53ТЕОРИЯ ИНДУЦИРОВАННОГО ВЗАИМОДЕЙСТВИЯ
В 1958 г. Дениел Кошланд предложил модель индуцированного
взаимодействия.
Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный
центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию.
В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. Модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».
Слайд 54 Регуляция ферментативной активности
Слайд 55ВИДЫ ИНГИБИРОВАНИЯ
Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности.
На основании этого различают обратимое и необратимое ингибирование. По механизму
действия ингибиторы подразделяют на конкурентные и неконкурентные.
Слайд 56Ингибиторы ферментов
Действие ферментов можно полностью или частично подавить (ингибировать) определенными
химическими веществами (ингибиторами). По характеру действия ингибиторы могут быть обратимыми
и необратимыми. В основе этого деления лежит прочность соединения ингибитора с ферментом. Другой способ деления ингибиторов основывается на характере места их связывания. Одни из них связываются с ферментом в активном центре, а другие - в удаленном от активного центра месте. Они могут связывать и блокировать функциональную группу молекулы фермента, необходимую для проявления его активности. При этом они необратимо, часто ковалентно, связываются с ферментом или фермент - субстратным комплексом и необратимо изменяют нативную конформацию. Это, в частности, объясняет действие Hg2+, Pb2+, соединений мышьяка.
Пример, диизопропилфторфосфат ингибирует ферменты, имеющие серин в активном центре. Таким ферментом является ацетилхолинэстераза, катализирующая следующую реакцию:
Слайд 57
Диизопропилфторфосфат ингибирует фермент, ацетилхолинэстеразу, имеющие серин в активном центре.
Реакция
проведения нервного импульса (происходит каждый раз, прежде чем второй импульс
будет передан через синапс).
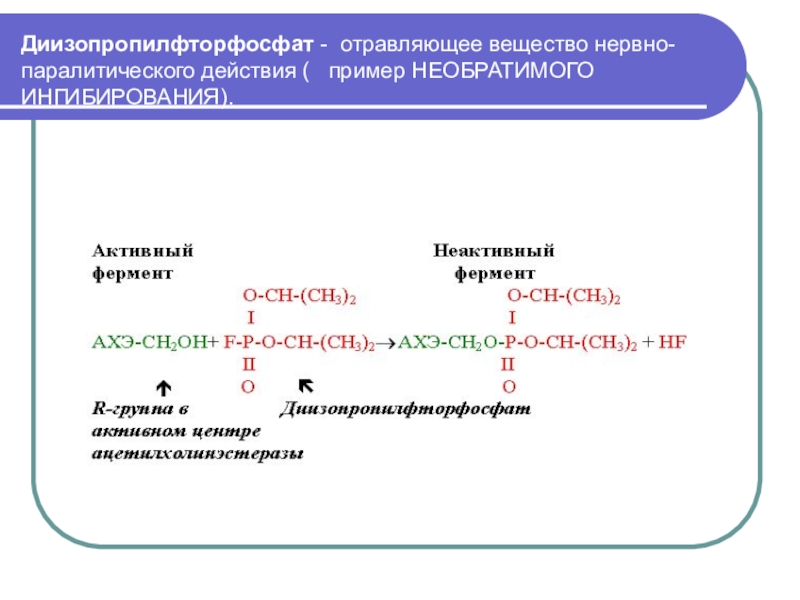
Слайд 58Диизопропилфторфосфат - отравляющее вещество нервно-паралитического действия ( пример НЕОБРАТИМОГО
ИНГИБИРОВАНИЯ).
Приводит к утрате способности нейронов проводить нервные импульсы.
Приводит к
утрате способности нейронов проводить нервные импульсы.
Приводит к утрате способности нейронов проводить нервные импульсы.
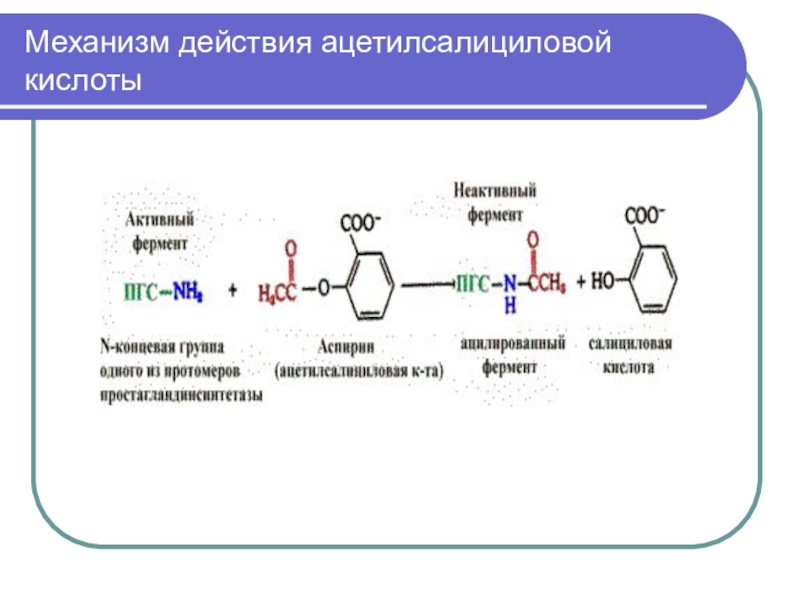
Слайд 59Механизм действия ацетилсалициловой кислоты (необратимое ингибирование)
Терапевтическое действие аспирина как жаропонижающего
и противовоспалительного средства объясняется тем, что аспирин ингибирует фермент, катализирующий
синтез простагландинов.
Простагландины - вещества, участвующие в развитии воспаления. Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента – циклооксигеназы (простагландинсинтетазы).
Слайд 60Механизм действия ацетилсалициловой кислоты
Слайд 61Обратимые ингибиторы
Существует два типа обратимых ингибиторов - конкурентные и неконкурентные.
Конкурентный ингибитор конкурирует с субстратом за связывание с активным центром.
Это происходит потому, что ингибитор и субстрат имеют сходные структуры.
Слайд 62
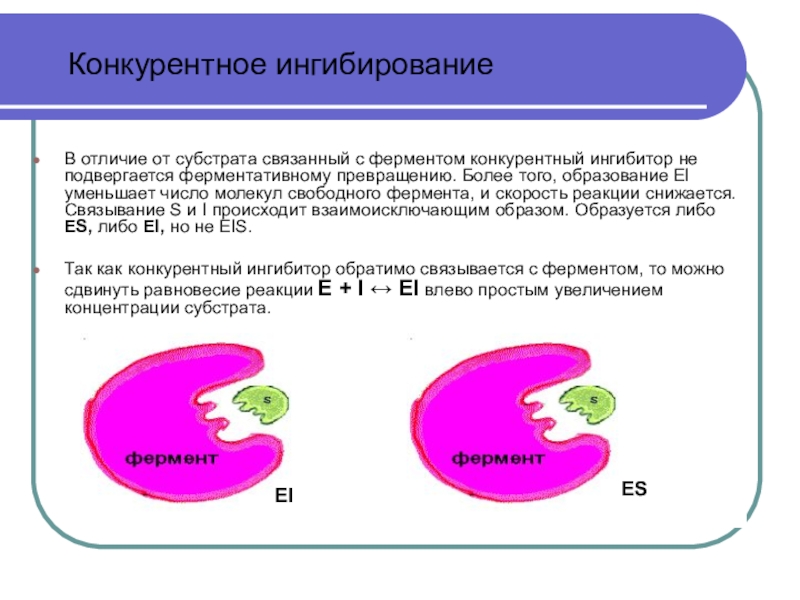
В отличие от субстрата связанный с ферментом конкурентный ингибитор не
подвергается ферментативному превращению. Более того, образование EI уменьшает число молекул
свободного фермента, и скорость реакции снижается. Связывание S и I происходит взаимоисключающим образом. Образуется либо ES, либо EI, но не EIS.
Так как конкурентный ингибитор обратимо связывается с ферментом, то можно сдвинуть равновесие реакции E + I ↔ EI влево простым увеличением концентрации субстрата.
I
Конкурентное ингибирование
EI
ES
Слайд 63Конкурентными ингибиторами являются многие химиотерапевтические средства. Пример: сульфамидные препараты, используемые
для лечения инфекционных болезней.
.
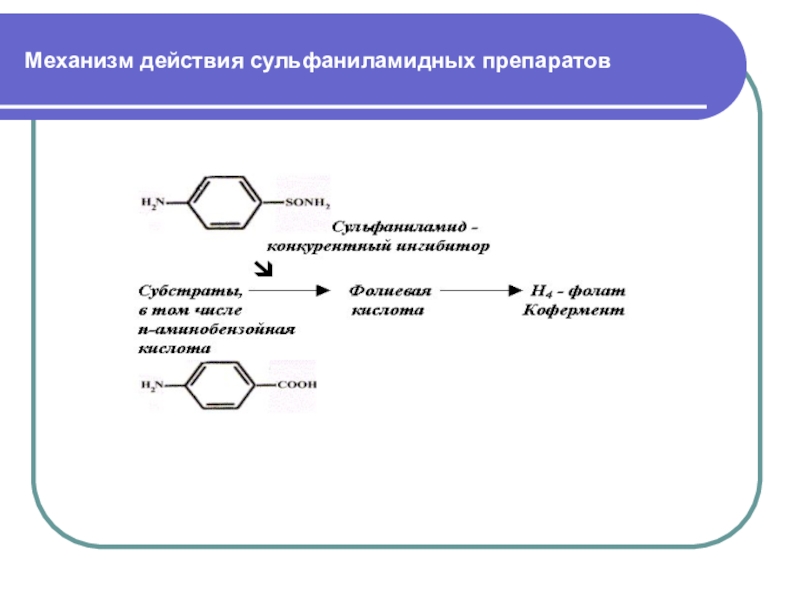
Сульфаниламиды – это структурные аналоги
парааминобензойной кислоты, из которой в клетке микроорганизма синтезируется кофермент (Н4 - фолат - ТГФК), участвующий в биосинтезе нуклеотидов и нуклеиновых оснований. Нарушение синтеза нуклеиновых кислот приводит к нарушению синтеза жизненноважных белков и к гибели микроорганизмов.
Слайд 64Механизм действия сульфаниламидных препаратов
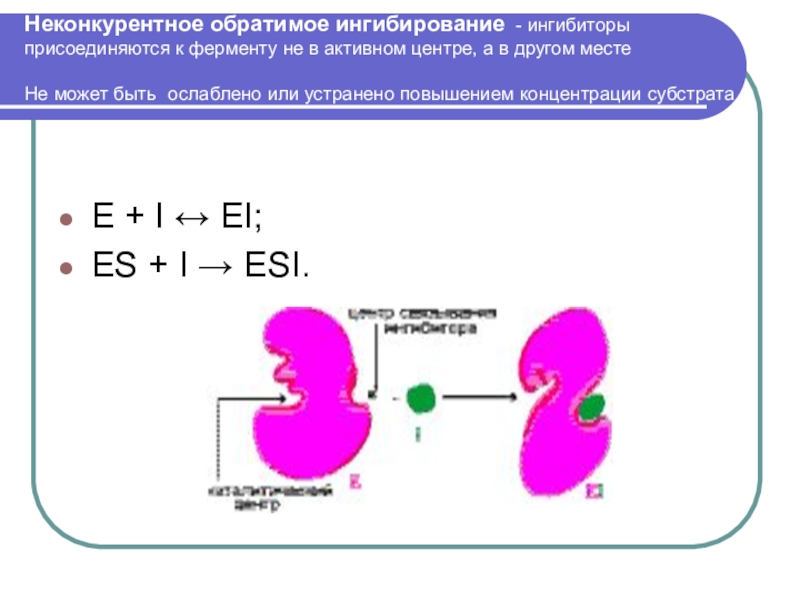
Слайд 65Неконкурентное обратимое ингибирование - ингибиторы присоединяются к ферменту не в
активном центре, а в другом месте
Не может быть ослаблено
или устранено повышением концентрации субстрата
E + I ↔ EI;
ES + I → ESI.
Слайд 66В живой клетке множество разнообразных соединений, но реакции между ними
не беспорядочны, а образуют строго определенные метаболические пути, характерные для
данной клетки. Индивидуальность клетки в большой степени определяется уникальным набором ферментов, который она генетически запрограммирована производить. Отсутствие даже одного фермента или какой-нибудь его дефект могут иметь очень серьезные отрицательные последствия для организма.
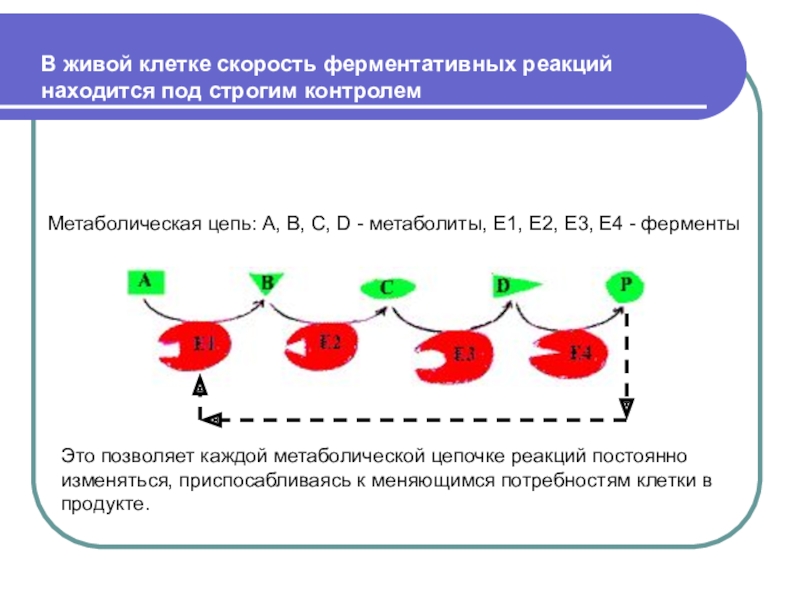
Слайд 67В живой клетке скорость ферментативных реакций находится под строгим контролем
Метаболическая
цепь: А, В, С, D - метаболиты, Е1, Е2, Е3,
Е4 - ферменты
Это позволяет каждой метаболической цепочке реакций постоянно изменяться, приспосабливаясь к меняющимся потребностям клетки в продукте.
Слайд 68В каждой метаболической цепи есть фермент, который задает скорость всей
цепочке реакций.
Он называется регуляторным ферментом. Существует несколько
способов регуляции действия ферментов:
изменение активности фермента при его постоянной концентрации;
изменение концентрации фермента, обычно в результате ускорения (индукции) или торможения (репрессии) синтеза фермента.
Слайд 69Основные способы изменения активности ферментов
.
Аллостерическая регуляция.
Регуляция активности ферментов путем
фосфорилирования-дефосфорилирования (путем ковалентной модификации).
Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте
Активация ферментов путем частичного протеолиза.
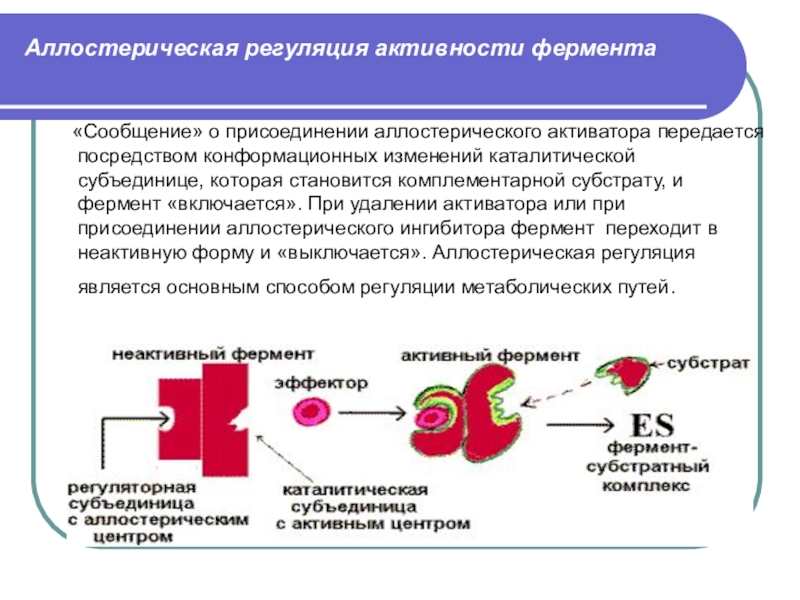
Слайд 70Аллостерическая регуляция активности фермента
«Сообщение» о присоединении аллостерического активатора
передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату,
и фермент «включается». При удалении активатора или при присоединении аллостерического ингибитора фермент переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей.
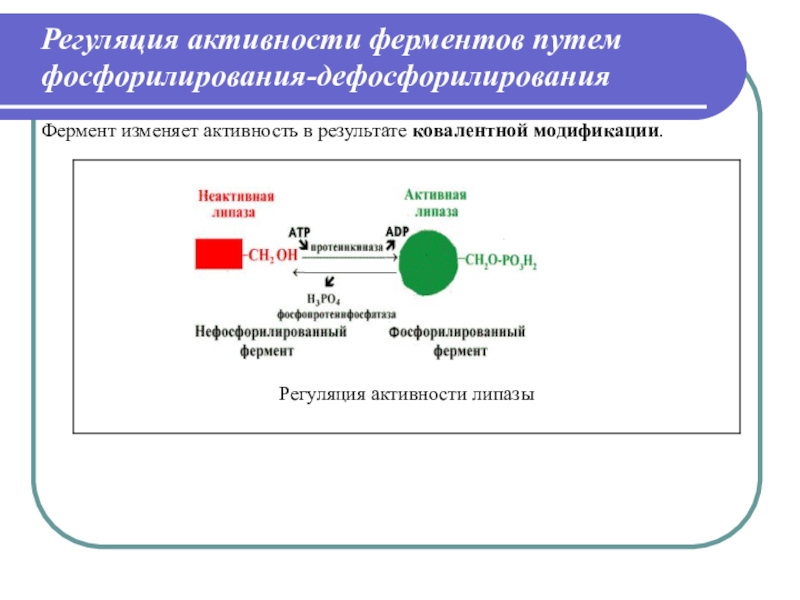
Слайд 71Регуляция активности ферментов путем фосфорилирования-дефосфорилирования
Фермент изменяет активность в результате
ковалентной модификации.
Слайд 72Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте
Этот процесс иногда
начинается с ковалентной или нековалентной модификации одной из субъединиц.
Например,
фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса.
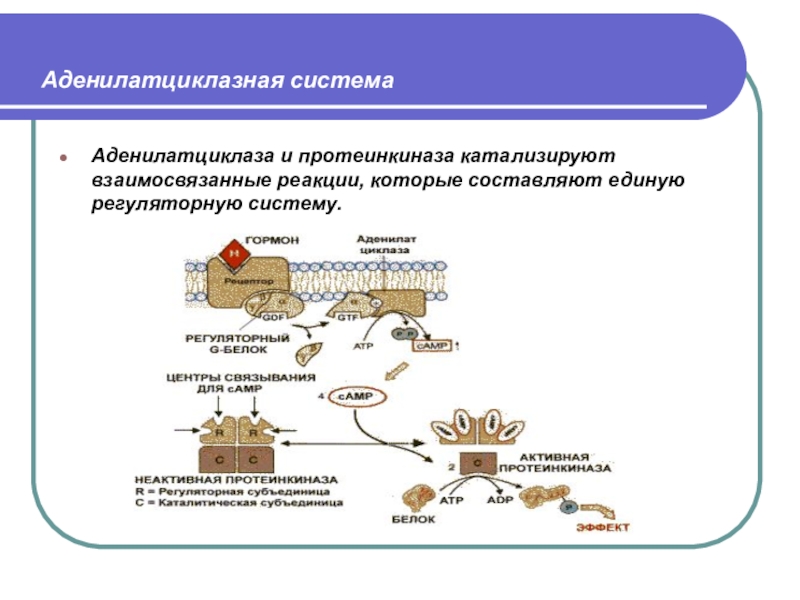
Активация фермента происходит при участии цAMP (циклоаденозинмонофосфорная кислота), которая способна присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса:
R2C2 + 2цАМР 2С + 2(R -цАМР)
Циклический АМР является продуктом АТР, превращение которой катализирует фермент аденилатциклаза:
АТР ц АМР + Н4Р2О7
Слайд 73
Аденилатциклазная система
Аденилатциклаза и протеинкиназа катализируют взаимосвязанные реакции, которые составляют единую
регуляторную систему.
Слайд 74В живой клетке скорость ферментативных реакций зависит от количества ферментов
Количество
фермента в клетке определяется соотношением скоростей его синтеза и распада. Этот способ
регуляция скорости ферментативной реакции является более медленным процессом (проявляется спустя несколько часов), чем регуляция активности фермента (практически мгновенный ответ).
Слайд 75 Контроль количества фермента
Путь регуляции ферментативных реакций через изменение
количества фермента является путем длительной адаптации метаболических процессов в организме,
требует для своего осуществления часы и дни и включения генетического аппарата. Выделяют конститутивные ферменты, которые синтезируются с постоянной скоростью и адаптативные (индуцибельные) ферменты, синтез которых начинается при поступлении в организм субстратов или других регуляторов, необходимых для разблокировки соответствующих генов.
Слайд 76Индуцибельные ферменты - ферменты адаптации
К индуцибельным ферментам относят ферменты метаболизма
чужеродных веществ (монооксигеназы), синтез которых начинается при поступлении в организм
токсических соединений, или ферменты глюконеогенеза, синтез которых усиливается при увеличении потребности организма в глюкозе. Пусковым звеном в этих процессах чаще всего выступают сами субстраты, гормоны (стероидные), которые непосредственно регулируют активность генов, или циклические нуклеотиды (цАМФ, цГМФ), которые активируют целые ферментные каскады.
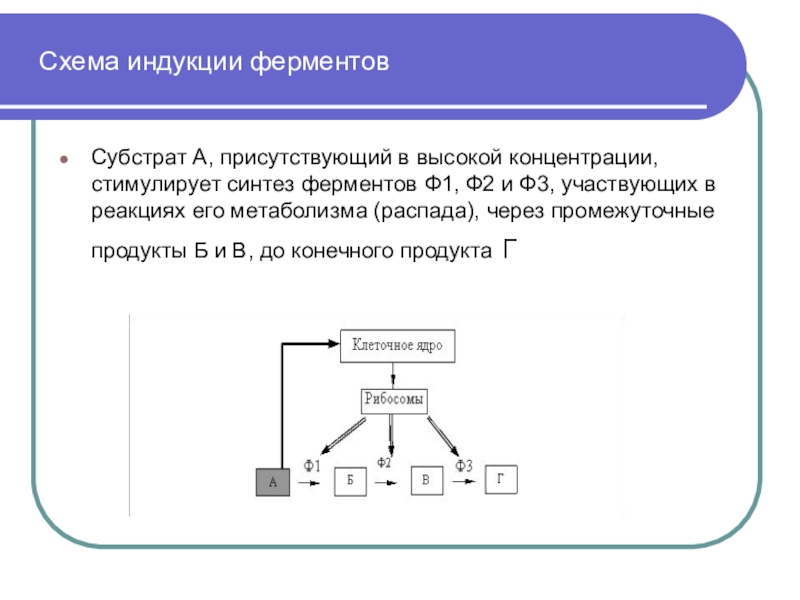
Слайд 77 Схема индукции ферментов
Субстрат А, присутствующий в высокой концентрации, стимулирует
синтез ферментов Ф1, Ф2 и Ф3, участвующих в реакциях его
метаболизма (распада), через промежуточные продукты Б и В, до конечного продукта Г
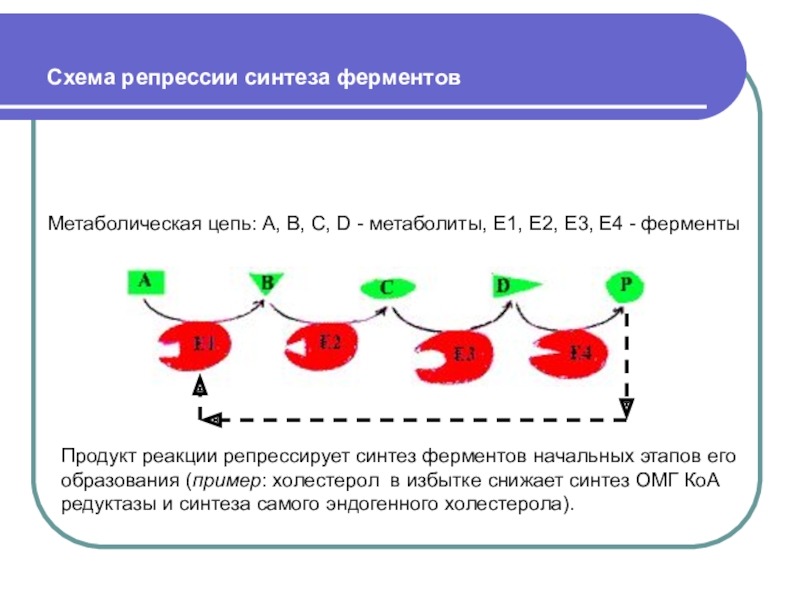
Слайд 78 Схема репрессии синтеза ферментов
Метаболическая цепь: А, В, С, D
- метаболиты, Е1, Е2, Е3, Е4 - ферменты
Продукт реакции
репрессирует синтез ферментов начальных этапов его образования (пример: холестерол в избытке снижает синтез ОМГ КоА редуктазы и синтеза самого эндогенного холестерола).
Слайд 79
Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции
из клетки переходят в активную форму. Неактивный предшественник называется проферментом.
Активация профермента включает модификацию первичной структуры с одновременным изменением конформации.
Пример, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца: трипсиноген энтеропептидаза трипсин + Val-(Acn) -Lys
Расщепление определенных пептидных связей «запускает» новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа.
Активация ферментов путем частичного протеолиза
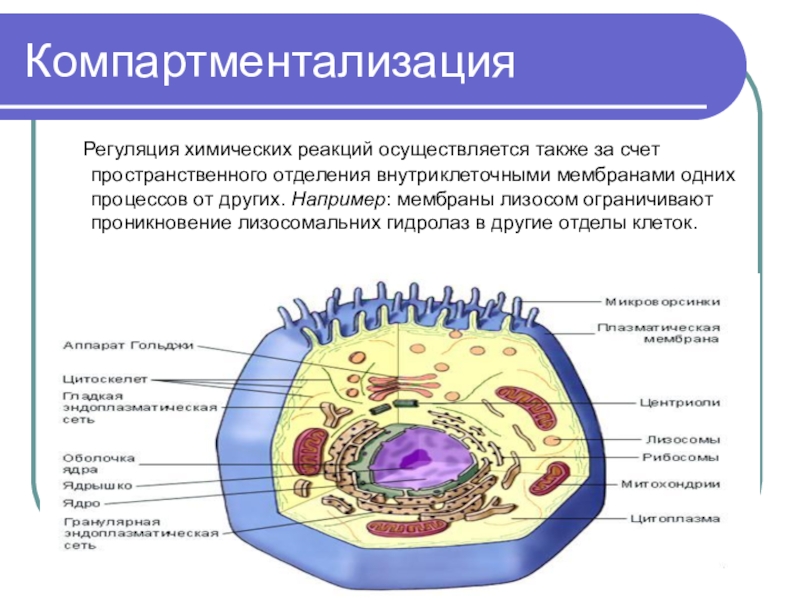
Слайд 80Компартментализация
Регуляция химических реакций осуществляется также за счет пространственного
отделения внутриклеточными мембранами одних процессов от других. Например: мембраны лизосом
ограничивают проникновение лизосомальних гидролаз в другие отделы клеток.
Слайд 81 Изоферменты
Изоферменты - это множественные формы ферментов, которые
катализируют одну и ту же реакцию, но отличаются по физико-химическим
свойствам и локализации в тканях. Для энзимодиагностики проводят определение активности изоферментов.
Пример: Изоферменты лактатдегидрогеназы ЛДГ.
Активность ЛДГ1 и ЛДГ2 увеличивается при инфаркте миокарда, активность ЛДГ4 и ЛДГ5 - при заболеваниях печени и скелетных мышц, активность ЛДГ3 - при заболеваниях почек и селезенки.
Пример:Изоферменты креатинкиназы КК.
В крови чаще всего исследуется форма МВ, активность этой формы увеличивается при инфаркте миокарда.
При патологических состояниях выход фермента в кровь может усилиться в связи с изменением состояния мембраны клетки.
Слайд 82Изменения спектра ЛДГ в онтогенезе
Соотношение разных форм ЛДГ в тканях
не является постоянным и изменяется в соответствии с меняющимися условиями
обитания. Изменения изоэнзимного спектра наблюдаются как при адаптации к меняющимся условиям среды, так и в ходе онтогенеза. Эмбрионы всех млекопитающих проходят стадию развития, когда митохондрии еще не готовы к окислению субстратов. В этих условиях особенно велика роль анаэробного гликолиза. На стадии эмбриона основной формой фермента является тетрамер типа М4 (ЛДГ5) . После рождения постепенно нарабатываются другие формы ЛДГ, и к периоду, соответствующему взрослому организму, устанавливается соотношение разных изоформ, типичное для каждой ткани. Пример: в почках в эмбриональном состоянии обнаружено пять изоформ фермента, в то время как во взрослом организме в почках ЛДГ представлена в основном двумя изоформами.