Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Федеральное государственное образовательное учреждение высшего и
Содержание
- 1. Федеральное государственное образовательное учреждение высшего и
- 2. Лекция 1. Введение, цели и задачи, предмет
- 3. Лекция 1. Введение, цели и задачи, предмет
- 4. Лекция 1. Введение, цели и задачи, предмет
- 5. Лекция 1. Введение, цели и задачи, предмет
- 6. Лекция 1. Введение,
- 7. Лекция 1. Введение, цели и задачи, предмет
- 8. Лекция 1. Введение, цели и задачи, предмет
- 9. Слайд 9
- 10. Слайд 10
- 11. Лекция 1. Введение, цели и задачи, предмет и методы изучения, историяМесто зеленого растения в экономике природы.1.10
- 12. Слайд 12
- 13. Лекция 1. Введение, цели и задачи, предмет
- 14. Лекция 1. Введение, цели и задачи, предмет
- 15. Лекция 2. Физиология растительной клетки. Клетка как
- 16. Общая схема организации растительной клетки. Функции органоидов.Строение
- 17. Нобел, 1970 Физиология растительной клетки.
- 18. Слайд 18
- 19. Протопласты растительных клетокКлетки растений в состоянии тургора (слева) и плазмолиза (справа)
- 20. Quick look: A vacuole is a membrane-enclosed fluid
- 21. Содержимое вакуоли — клеточный сок — представляет
- 22. Plant vacuoles serve as the primary intracellular
- 23. Включения — это компоненты клетки, представляющие собой
- 24. Различные типы крахмальных зерен: у овса (1),
- 25. Кристаллы щавелевокислого кальция в вакуолях растительных клеток: 1
- 26. Слайд 26
- 27. Электронная микрофотография, на которой видны целлюлозные волокна
- 28. Microtubule railroad. Microtubules that lie beneath the
- 29. Модель, демонмтрирующая последовательность дестабилизации сети микротрубочек (МТ)
- 30. Мембранная система растительной клетки (L.A. Staehelin, 1997)
- 31. Слайд 31
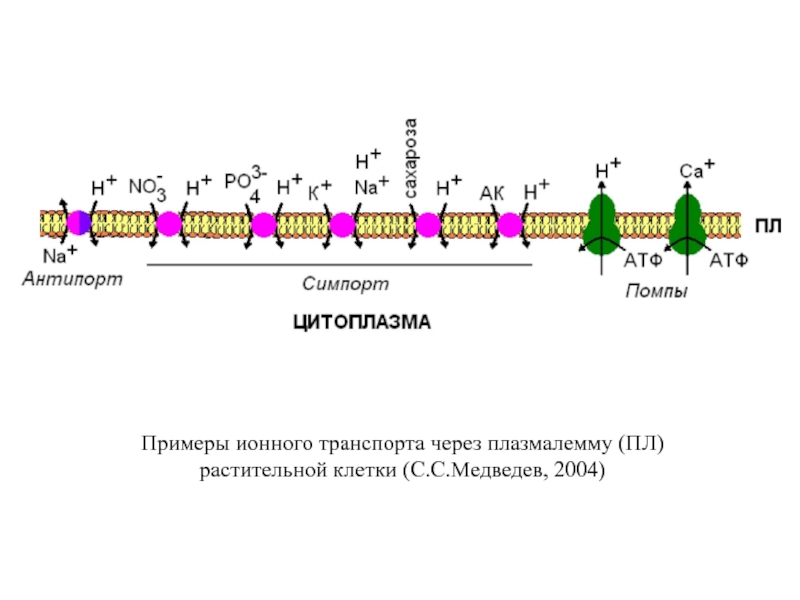
- 32. Типы транспорта веществ через клеточные мембраны растений (самостоятельно)
- 33. Слайд 33
- 34. Примеры ионного транспорта через плазмалемму (ПЛ) растительной клетки (С.С.Медведев, 2004)
- 35. Митоген-активируемые киназы МАРK (КФ 2.7.11.24) отвечают на
- 36. Важно также представлять себе что сигнал, приходящий
- 37. Слайд 37
- 38. Слайд 38
- 39. Аквапорины Peter Agre (профессор биохимии университет
- 40. В настоящее время существует более 200 различных
- 41. Схема образования поры для транспорта воды. Активация
- 42. Структурная модель аквапорина растений (С.С.Медведев, 2004).1-6 —
- 43. In situ локализация транскриптов аквапорина OsPIP2;7 у
- 44. Нобел, 1970 Физиология растительной клетки.
- 45. Зависимость «натяжение» – «деформация» для клеточной стенки
- 46. Продольное натяжение σL= r P/ 2rТангенциальное натяжение
- 47. Свойства водыВ кристаллическом состоянии все молекулы воды
- 48. Поверхностное натяжение и капиллярное поднятие водыКогезия –
- 49. Расчет времени (tc = ½) диффузииДиффузия эффективна на
- 50. Слайд 50
- 51. Численные примеры: А – в пределах клетки (50 мкм), Б в пределах сосуда ксилемы (1 м)АБ
- 52. P имеет то же значение, что и
- 53. Химический потенциал водыХимический потенциал - один из
- 54. Матричный потенциалВодный потенциалВодный потенциал – дефицит давления
- 55. Соотношение Бойля - Вант-ГоффаОбъем тела, окруженного полупроницаемой
- 56. Слайд 56
- 57. Measuring Water PotentialPlant scientists have expended considerable
- 58. One psychrometric technique, known as isopiestic psychrometry, has
- 59. Слайд 59
- 60. Psychrometers can be used to measure the
- 61. Pressure chamber (Ψw measurement)A relatively quick method for
- 62. The pressure chamber method for measuring plant
- 63. The pressure chamber is often described as
- 64. Cryoscopic osmometer (Ψs measurement)The cryoscopic osmometer measures the osmotic potential
- 65. A cryoscopic osmometer measures the concentration of
- 66. Pressure probe (Ψp measurement)If a cell were as
- 67. Use of the micromanometer, a pressure probe,
- 68. For higher plant cells, which are several
- 69. Diagram of the simplest pressure probe (not
- 70. This method has been used to measure Ψp and
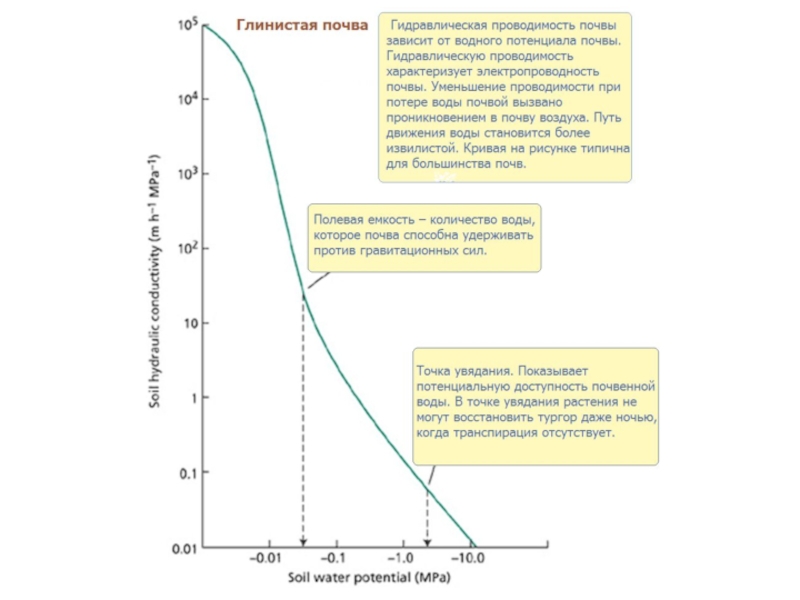
- 71. The Matric PotentialIn discussions of soils, seeds,
- 72. Wilting and PlasmolysisPlasmolysis is the separation of
- 73. Plasmolysis of an epidermis cell of Allium cepa after
- 74. Понятие гидравлической проводимостиРассмотрим клетку с начальным водным
- 75. Следует обратить внимание, что рассмотрена идеальная мембрана,
- 76. Водные потоки в растении зависят от градиента
- 77. В целом растении можно выделить три основных последовательно соединенных гидравлических сопротивления: R1 -
- 78. Слайд 78
- 79. Корневая система растения:1-общий вид, 2-поперечный разрез, 3 и 4 –корневые волоски, 5 – кончик корня
- 80. Слайд 80
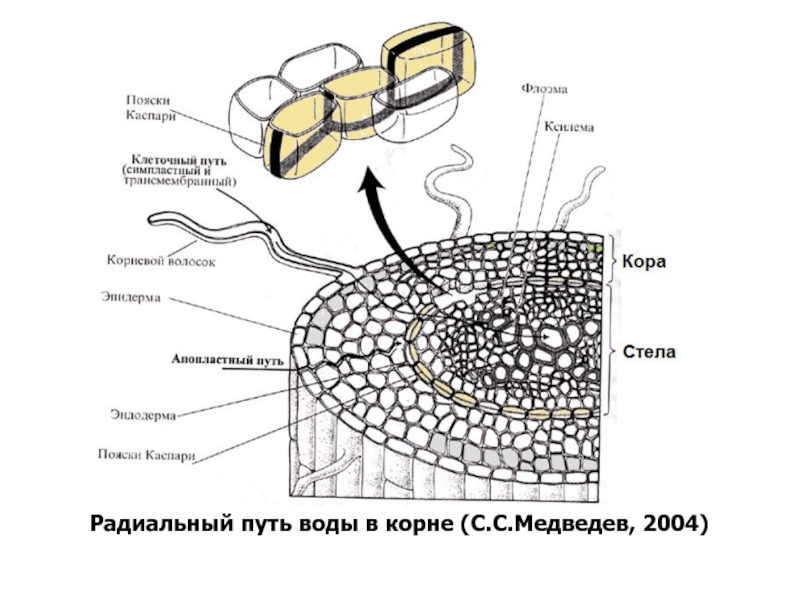
- 81. Радиальный путь воды в корне (С.С.Медведев, 2004)
- 82. Вода движется в основном по апопласту, пока
- 83. Слайд 83
- 84. Слайд 84
- 85. Слайд 85
- 86. Движение воды по сосудам ксилемы происходит в
- 87. Средний поток водного раствора в ксилеме транспирирующего
- 88. Скорость, с которой вода проходит вверх по
- 89. Слайд 89
- 90. Слайд 90
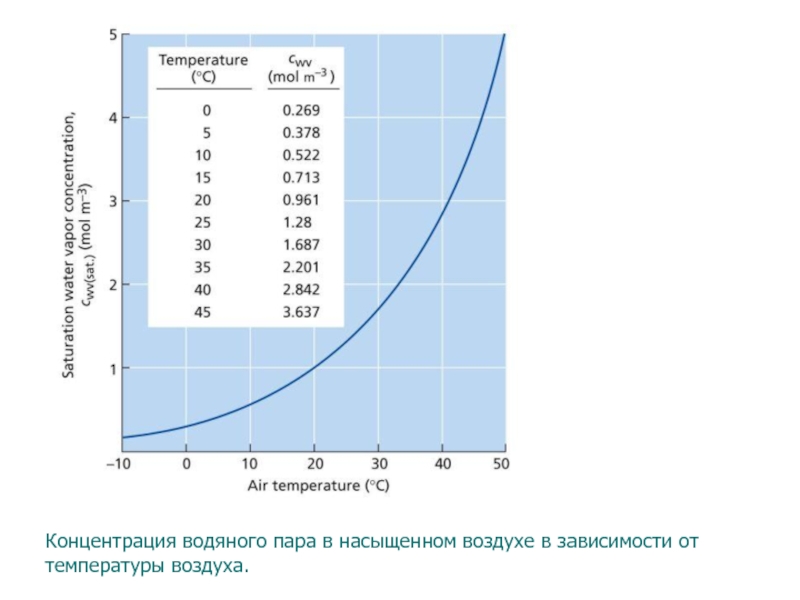
- 91. Концентрация водяного пара в насыщенном воздухе в зависимости от температуры воздуха.
- 92. Натяжение воды , содержащейся в клеточной оболочке
- 93. Поперечный срез листовой пластинки
- 94. Слайд 94
- 95. Транспирация водяного пара. Градиенты Транспирация из листьев
- 96. Схема испарения воды чрез малые отверстия (правило
- 97. Слайд 97
- 98. Слайд 98
- 99. Схема работы устьиц (Taiz,Zeiger, 1998) А- -анионы, К+ - катионы, в основном, калия
- 100. Чем меньше относительная влажность атмосферного воздуха, тем
- 101. Слайд 101
- 102. Устьичная транспирация и механизмы ее регуляцииСхема регуляции
- 103. Суточный ход транспирацииСуточный ход транспирации гомойгироидных (слева)
- 104. Коэффициент транспирации:Отношение количества испарившейся воды на 1
- 105. Слайд 105
- 106. Let's begin by noting that the velocity
- 107. Слайд 107
- 108. Слайд 108
- 109. Слайд 109
- 110. Скорость, с которой вода проходит вверх по
- 111. Taking the viscosity of xylem sap to
- 112. Принимая вязкость ксилемного сока, чтобы быть, что
- 113. Высокое значение Lp высших растительных клеток составляет
- 114. Let’s examine the factors in Web Equation
- 115. Давайте рассмотрим факторы, в веб уравнении 4.4.1
- 116. Vapor pressures and concentrations are equivalent; in
- 117. Vapor давления и концентрации эквивалентны; В нашем
- 118. where R is the gas constant, T is temperature (in degrees
- 119. Web Table 4.4.A shows RH values as a function
- 120. To convert from RH to cwv, we need to know cwv(sat.).
- 121. Textbook Table 4.1 illustrates how RH, cwv, and water
- 122. С помощью этого эксперимента, Диксона убедительно показали,
- 123. Косвенное измерение кавитации в экспериментах с использованием
- 124. Hydraulic compartmentalization of vessel refilling. Left: Living cells
- 125. Слайд 125
- 126. Слайд 126
- 127. Химический потенциал воды и водный потенциал клетки.Зависимость
- 128. Химический потенциал воды и водный потенциал клетки.Изменение
- 129. План лекцииЗначение воды для жизнедеятельности растений. Формы
- 130. План лекцииМеханизмы передвижения воды по растению. Теория
- 131. Транспорт воды по растениюОсновные движущие силы водного
- 132. ТранспирацияЗначение водного потенциала и его компонентов на
- 133. Слайд 133
- 134. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Федеральное государственное образовательное учреждение высшего и профессионального образования «Сибирский федеральный
университет» кафедра физиологии растений и биотехнологии
2007Слайд 2Лекция 1. Введение, цели и задачи, предмет и методы изучения,
история
Физиология растений
План лекции
1. Физиология растений – наука о жизнедеятельности
растительного организма.2. История становления физиологии растений как науки.
3. Предмет, цели и задачи курса.
4. Методы исследования.
5. Место зеленого растения в экономике природы.
6. Население Земли и пищевые ресурсы
1.1
Слайд 3Лекция 1. Введение, цели и задачи, предмет и методы изучения,
история
Физиология растений – наука о жизнедеятельности растительного организма
1.4
fizrast.ru/skachat.html
Физиология растений. Н.И.
Якушкина Е.Ю. Бахтенко. Физиология растений. Н. Д. Алехина, Ю. В. Балнокин. Под ред. И. П. Ермакова.
Физиология растений - С.С. Медведев. 2003
Физиология растений - С.С. Медведев. 2013
Основы биохимии растений - Филипцова Г. Г., Смолич И.И.
Физиология растений – Кузнецов В.В., Дмитриева Г.А.
Слайд 4Лекция 1. Введение, цели и задачи, предмет и методы изучения,
история
Физиология растений – наука о жизнедеятельности растительного организма
Зарубежные учебные издания
в областях Физиологии растений1.5
Слайд 5Лекция 1. Введение, цели и задачи, предмет и методы изучения,
история
Физиология растений – наука о жизнедеятельности растительного организма
Центральный журнал
Материалы
Международной конференции1.6
Слайд 6 Лекция 1. Введение, цели и задачи,
предмет и методы изучения, история
Физиология растений – наука о
жизнедеятельности растительного организма1.2
Эмблемы Обществ физиологов растений и смежных областей
Россия
Скандинавские страны
США
Индия
Малайзия
Япония
Австралия
Израиль
Слайд 7Лекция 1. Введение, цели и задачи, предмет и методы изучения,
история
Место зеленого растения в экономике природы.
1.7
Место растений в современной систематике
(Grzebyk,al.,J. Phycol. 39, 259–267 (2003)
Слайд 8Лекция 1. Введение, цели и задачи, предмет и методы изучения,
история
Место зеленого растения в экономике природы.
1.8
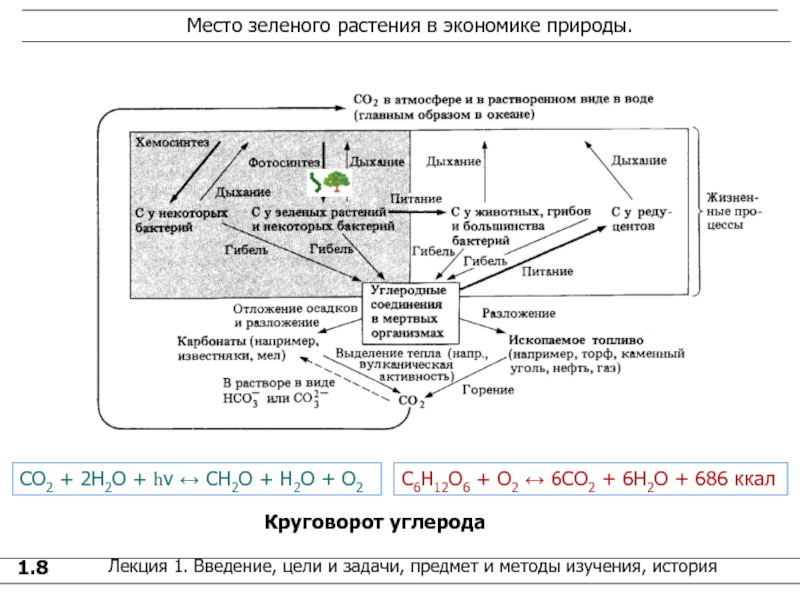
Круговорот углерода
СО2 + 2Н2О +
h СН2О + Н2О + О2 С6Н12О6 + О2 6СО2 + 6Н2О + 686 ккал
Слайд 11Лекция 1. Введение, цели и задачи, предмет и методы изучения,
история
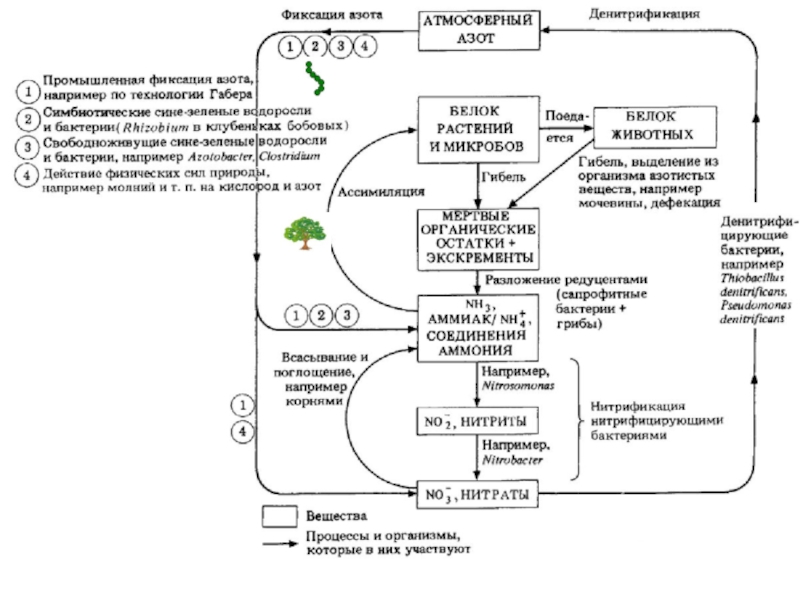
Место зеленого растения в экономике природы.
1.10
Слайд 13Лекция 1. Введение, цели и задачи, предмет и методы изучения,
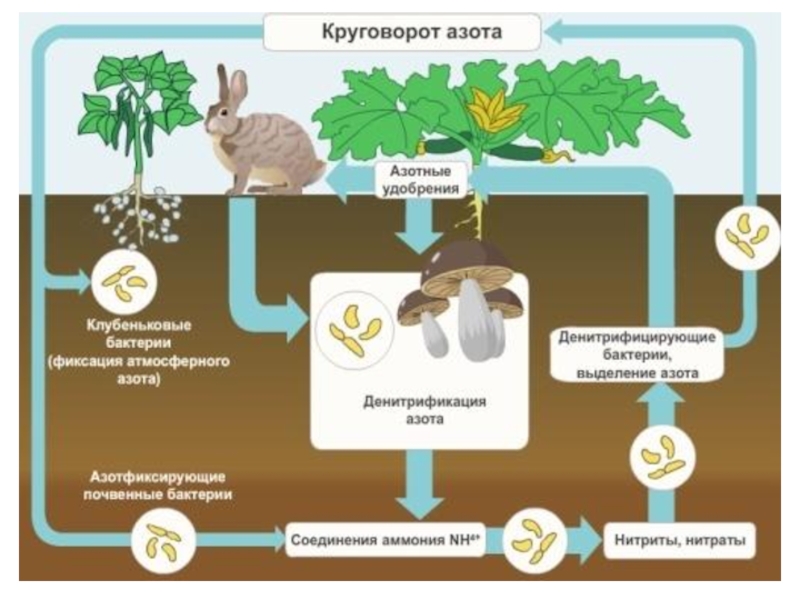
история
Место зеленого растения в экономике природы.
1.11
Фитопланктон и растения путем фотосинтеза
создают органические вещества, которые служат питанием для животных. В естественных экосистемах около 90% растительной органики потребляют микроорганизмы с размерами тела менее 1 мм. Насекомые и другие мелкие животные с размерами до 1 см используют менее 10% органической продукции, а на долю крупных животных приходится примерно 1% органики. В норме в этот 1% должен укладываться и человек. Однако человечество существенно превысило естественный лимит, и с учетом земледелия, скотоводства и лесозаготовок доля человека в потреблении органики составляет около 10% (пунктирная линия). Слайд 14Лекция 1. Введение, цели и задачи, предмет и методы изучения,
история
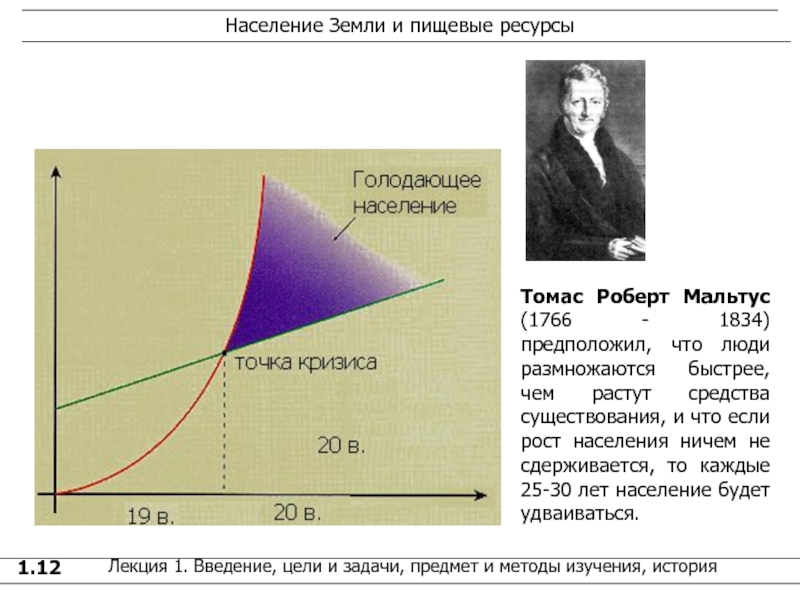
1.12
Томас Роберт Мальтус (1766 - 1834) предположил, что люди размножаются
быстрее, чем растут средства существования, и что если рост населения ничем не сдерживается, то каждые 25-30 лет население будет удваиваться. Население Земли и пищевые ресурсы
Слайд 15Лекция 2. Физиология растительной клетки. Клетка как осмотическая система.
Физиология растений
План
лекции
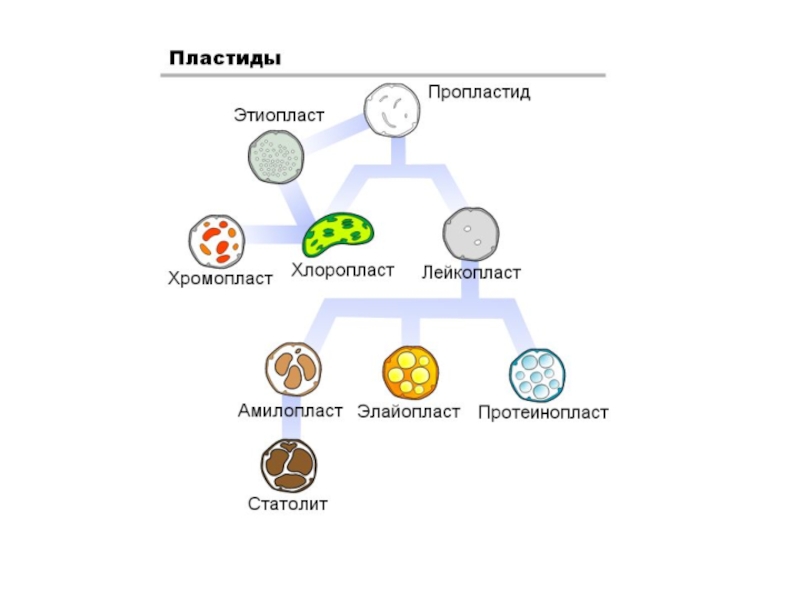
Общая схема организации растительной клетки. Функции органоидов.
Методы исследования растительных клеток.
Основные закономерности поглощения воды клеткой.
Химический потенциал воды и водный потенциал клетки. Растительная клетка - осмотическая система.
2.1
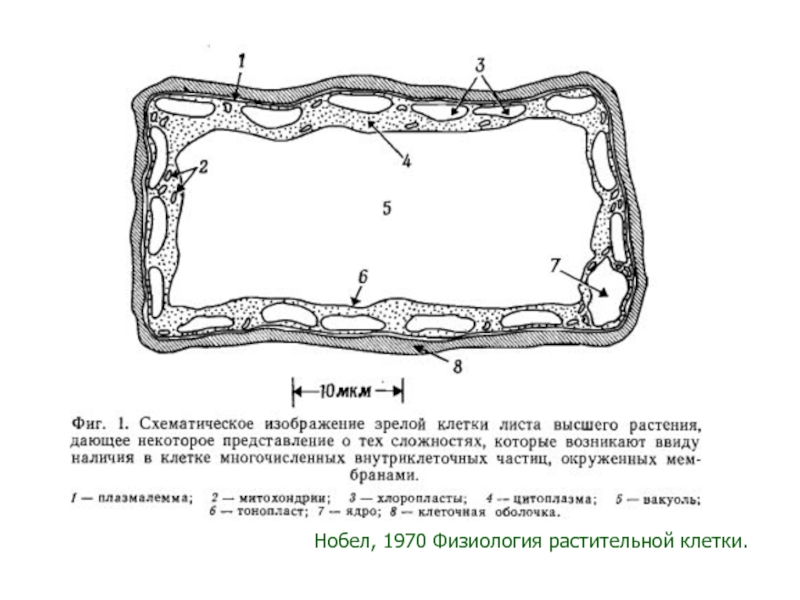
Слайд 16Общая схема организации растительной клетки. Функции органоидов.
Строение растительной клетки
Лекция 2.
Физиология растительной клетки. Клетка как осмотическая система.
2.2
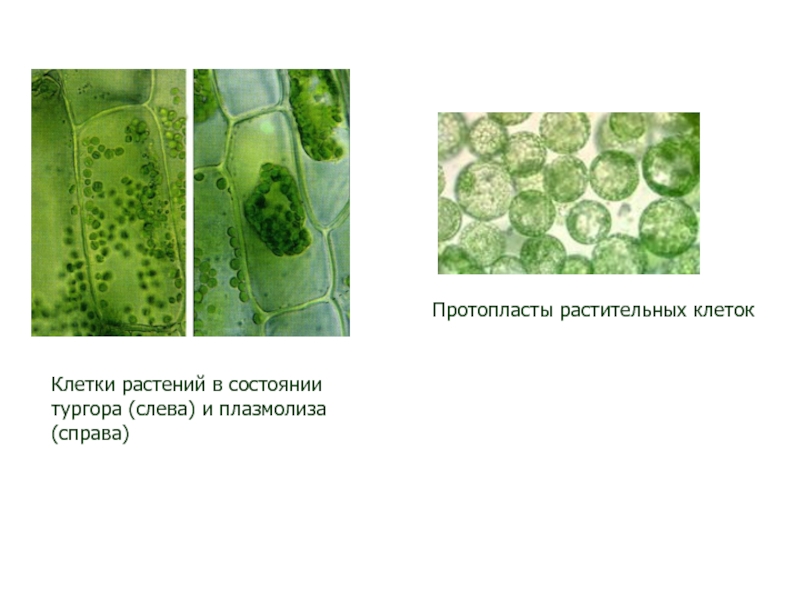
Слайд 19Протопласты растительных клеток
Клетки растений в состоянии тургора (слева) и плазмолиза
(справа)
Слайд 20Quick look: A vacuole is a membrane-enclosed fluid filled sac found
in the cells of plants including fungi. Vacuoles can be large
organelles occupying between 30% and 90% of a cell by volume. Vacuoles appear to have three main functions, they:contribute to the rigidity of the plant using water to develop hydrostatic pressure
store nutrient and non-nutrient chemicals
break down complex molecules.
Вакуоль представляет собой изолированный мембранной, заполненный жидкостью мешочек. Вакуоли найдены в клетках растений, а также в клетках грибов. Вакуоли занимают от 30% до 90% объема клетки.
Три основные функции вакуолей:
Необходимы для создания гидростатического давления (тургора) в клетки;
вместилище питательных и неорганических химических веществ;
Разрушение сложных молекул.
Слайд 21Содержимое вакуоли — клеточный сок — представляет собой слабокислый (pH 2-5)
водный раствор различных органических и неорганических веществ. По химическому составу
и консистенции клеточный сок существенно отличается от протопласта. Эти различия связаны с избирательной проницаемостью тонопласта, выполняющего барьерную функцию. Большинство органических веществ, содержащихся в клеточном соке, относится к группе эргастических продуктов метаболизма протопласта. В зависимости от потребностей клетки они могут накапливаться в вакуоли в значительных количествах либо полностью исчезать. Наиболее обычны различные углеводы, играющие роль запасных энергетических веществ, а также органические кислоты. Вакуоли семян нередко содержат и белки-протеины. Растительные вакуоли часто служат местом концентрации разнообразных вторичных метаболитов — полифенольиых соединений: флавоноидов, антоцианов, таннидов и азотсодержащих веществ — алкалоидов, В клеточном соке растворены также многие неорганические соединения.Иногда вакуоли разрушают токсичные или ненужные клетке вещества. Обычно это выполняется специальными небольшими вакуолями, содержащими соответствующие ферменты. Такие вакуоли получили название лизосомных.
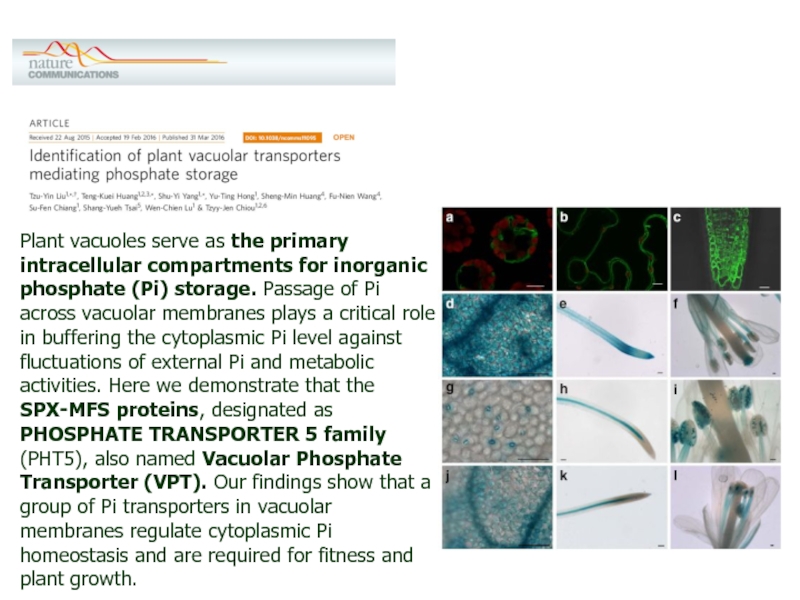
Слайд 22Plant vacuoles serve as the primary intracellular compartments for inorganic
phosphate (Pi) storage. Passage of Pi across vacuolar membranes plays
a critical role in buffering the cytoplasmic Pi level against fluctuations of external Pi and metabolic activities. Here we demonstrate that the SPX-MFS proteins, designated as PHOSPHATE TRANSPORTER 5 family (PHT5), also named Vacuolar Phosphate Transporter (VPT). Our findings show that a group of Pi transporters in vacuolar membranes regulate cytoplasmic Pi homeostasis and are required for fitness and plant growth.Слайд 23Включения — это компоненты клетки, представляющие собой отложения веществ, временно
выведенных из обмена, или конечные его продукты.
Большинство включений видимы
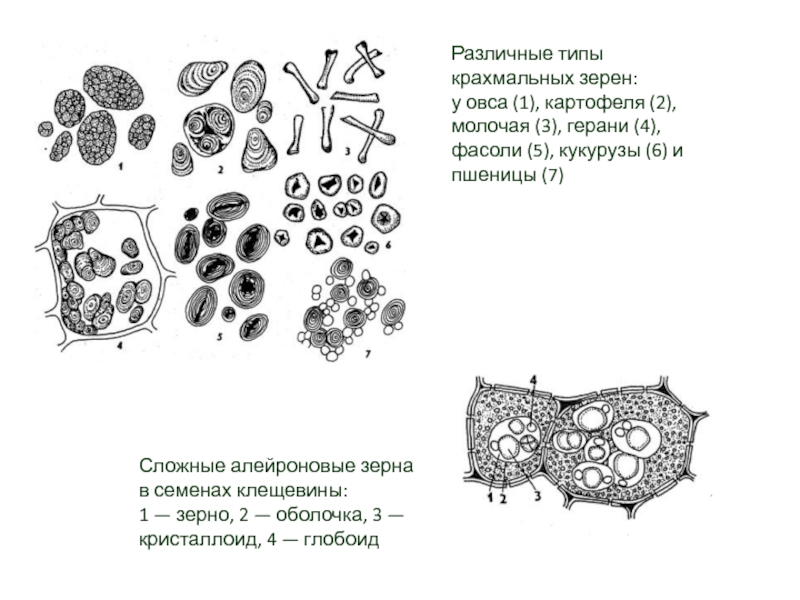
в световой микроскоп и располагаются либо в гиалоплазме и органоидах, либо в вакуоли. Существуют жидкие и твердые включения. К образованию включений ведет избыточное накопление веществ. Очень часто в виде включений откладываются запасные питательные вещества. Главнейшее и наиболее распространенное из них — полисахарид крахмал. Крахмал злаков, клубней картофеля, ряда тропических растений — важнейший источник углеводов в рационе человека. Первичный ассимиляционный крахмал образуется только в хлоропластах. Ночью, когда фотосинтез прекращается, ассимиляционный крахмал ферментативно гидролизуется до сахаров и транспортируется в другие части растения.Слайд 24Различные типы крахмальных зерен: у овса (1), картофеля (2), молочая (3),
герани (4), фасоли (5), кукурузы (6) и пшеницы (7)
Сложные алейроновые
зерна в семенах клещевины:
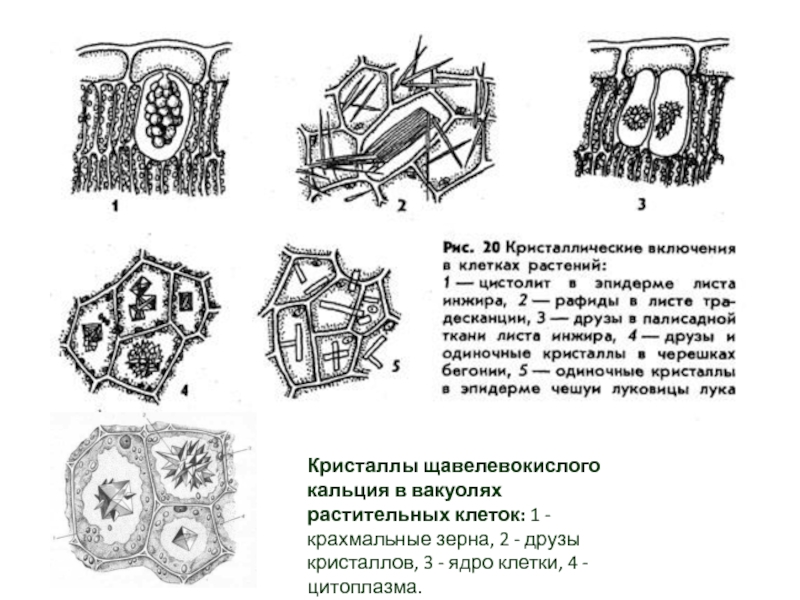
1 — зерно, 2 — оболочка, 3 — кристаллоид, 4 — глобоидСлайд 25Кристаллы щавелевокислого кальция в вакуолях растительных клеток: 1 - крахмальные зерна,
2 - друзы кристаллов, 3 - ядро клетки, 4 -
цитоплазма.Слайд 27Электронная микрофотография, на которой видны целлюлозные волокна в отдельных слоях
клеточной стенки зеленой морской водоросли Chaetomorpha melagonium. Толщина целлюлозных микрофибрилл
составляет 20 нм. Для получения контрастного изображения произведено напыление сплавом платины с золотомСлайд 28Microtubule railroad. Microtubules that lie beneath the plant cell's plasma
membrane serve as tracks for membrane-associated cellulose synthases (rosette structures)
to travel along. As it moves, the synthase deposits a cellulose microfibril into the adjacent cell wall. It is not yet known if there is a direct link between cellulose synthase and microtubule.Science 9 June 2006:
Vol. 312 no. 5779 pp. 1482-1483
DOI: 10.1126/science.1128903
PERSPECTIVE
PLANT SCIENCEMicrotubules Make Tracks for Cellulose
Clive Lloyd
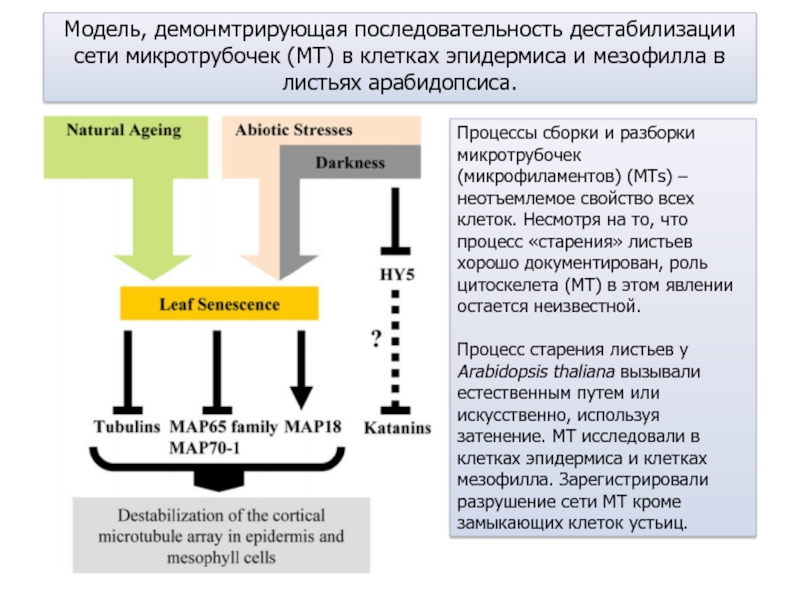
Слайд 29Модель, демонмтрирующая последовательность дестабилизации сети микротрубочек (МТ) в клетках эпидермиса
и мезофилла в листьях арабидопсиса.
Процессы сборки и разборки микротрубочек (микрофиламентов)
(MTs) – неотъемлемое свойство всех клеток. Несмотря на то, что процесс «старения» листьев хорошо документирован, роль цитоскелета (МТ) в этом явлении остается неизвестной.Процесс старения листьев у Arabidopsis thaliana вызывали естественным путем или искусственно, используя затенение. МТ исследовали в клетках эпидермиса и клетках мезофилла. Зарегистрировали разрушение сети МТ кроме замыкающих клеток устьиц.
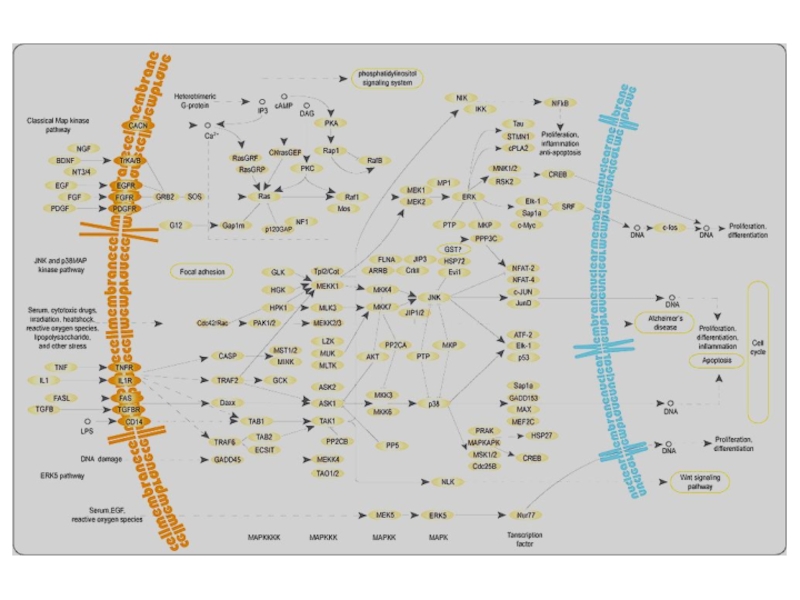
Слайд 35Митоген-активируемые киназы МАРK (КФ 2.7.11.24) отвечают на внеклеточные стимулы (митогены)
и регулируют многие клеточные процессы (экспрессию генов, деление, дифференцировку и
апоптоз). МАРК вовлечены в работу многих неядерных белков — продуктов онкогенов. Внеклеточные стимулы ведут к активации МАРК через сигнальный каскад, который состоит из МАРК, МАРКК (МАР2К) и МАРККК (МАР3К). МАР3К активируется внеклеточными стимулами и фосфорилирует МАР2К, затем МАР2К фосфорилированием активирует МАРК. Такой сигнальный МАРK-каскад консервативен для эукариот от дрожжей до млекопитающих.Слайд 36Важно также представлять себе что сигнал, приходящий к поверхности клеток,
внутри клетки амплифицируется благодаря существованию каскада . Даже очень слабые
сигналы благодаря этому оказываются достаточными, чтобы клетка на них реагировала.Повышение активности МАР-киназ или MAPK происходит под действием РКС [ Azzi A. ea, 1992 ], находящихся "downstream"от c-Raf (онкобелок Raf действует непосредственно "downstream" от Ras и участвуюет в передаче сигнала на ген c-fos [ Angel P. and Karin M., 1991 , Hunter T., 1991 ) [ Davis R.J., 1993 ].
Так как МАР-киназа при этом фосфорилируется одновременно по тирозину и серину, что не может осуществляться РКС, то между PKC и МАР-киназой существуют промежуточные звенья - киназы МАР-киназы ( МАРКК ) с двойной специфичностью (к тирозину и серину) и активирующие ее киназы киназы МАР-киназы ( МАРККК ) [ Davis R.J., 1993 , Gomez N. ea, 1992 ] (рис.13) Некоторые изоформы PKC могут выступать в роли MAP киназ. В настоящее время каскад реакций MAP-киназ разделен на две подгруппы, одна из них контролируется протеинкиназным каскадом, передающим митогенные сигналы ( ERK ), а вторая связана с протеинкиназным каскадом, активируемым стрессом ( SAPK ), под контролем которого находятся ингибирование клеточного роста и воспалительные реакции. Роль МАРККК играет хорошо известный белок RAF .
MAP-киназный каскад
Три семейства, киназ MAPK это серин- треонин протеинкиназы. Они в конечном счете меняют спектр транскрипции в ответ на внешний стимул. Достигнуть этого изменения MAPK может тремя разными способами:
MAPK может сама транслоцироваться в ядро и там фосфорилировать факторы транскрипции. Так фосфорилируются известные факторы белок с-Myc и белок Elk-1 .
2. МАРК может фосфорилировать фактор транскрипции в цитоплазме. После этого фактор проникает в ядро и там активирует транскрипцию определенных генов.
3. МАРК может фосфорилировать ингибитор фактора транскрипции с которым этот фактор связан. Когда фактор связан он неактивен. При фосфорилировании ингибитора фактор освобождается и таким образом активируется. Вот так в самых общих чертах выглядит путь передачи сигнала от ростового фактора. Каскад трех протеинкиназ очень универсально используется в различных цепях передачи сигнала и высоко консервативен в эволюции [ Canman ea 1996 ].
Слайд 39Аквапорины
Peter Agre (профессор биохимии университет Дж. Хопкинса) лауреат
Нобелевской премии по медицине 2003 года. Начиная с 1991 года
разрабатывает универсальные для всех живых организмов мембранные каналы, которые участвуют в транспорте воды.Слайд 40В настоящее время существует более 200 различных аквапоринов.
В растениях ,
аквапорины сгруппированы в пять подсемейств:
Характерные белки плазматической мембраны (Plasma membrane
Intrinsic Protein – PIP)Характерные белки тонопласта, Tonoplast Intrinsic Protein – TIP
Характерные нодулин-26-подобные белки, Nodulin-26 like Intrinsic Protein (NIP) – кроме воды переносят катионы и анионы.
Малые основные внутренние белки, Small basic Intrinsic Protein (SIP)
Внутренний Белок X - ( XIP )
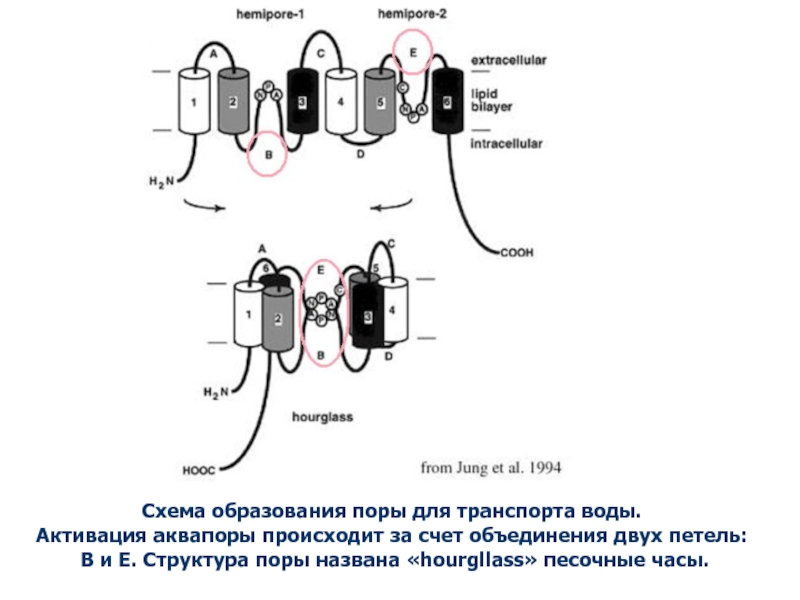
Слайд 41Схема образования поры для транспорта воды.
Активация аквапоры происходит за
счет объединения двух петель:
В и Е. Структура поры названа
«hourgllass» песочные часы.Слайд 42Структурная модель аквапорина растений (С.С.Медведев, 2004).
1-6 — шесть транс мембранных
α-спиралей, НВ и НЕ —две короткие α -спирали.
Лекция 3. Водный
режим растений. Функция и формы воды в растениях. Поглощение воды растением.3.4
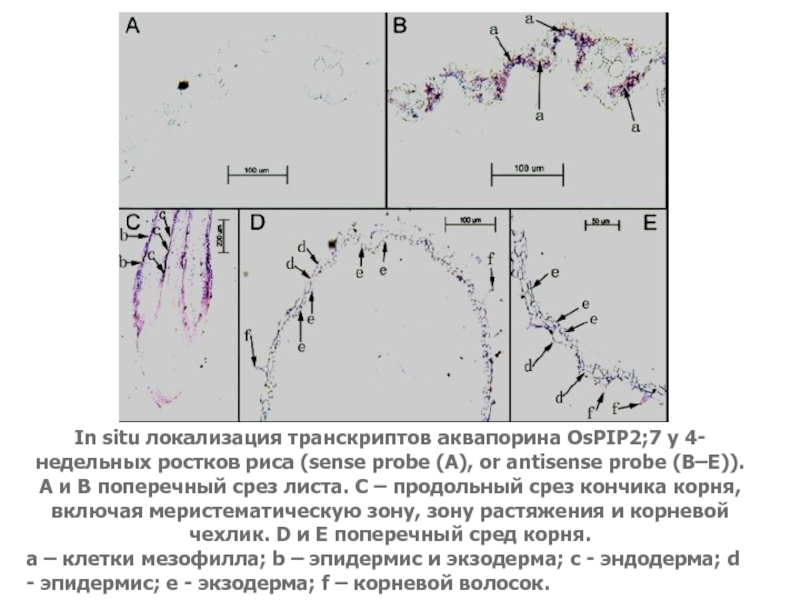
Слайд 43In situ локализация транскриптов аквапорина OsPIP2;7 у 4-недельных ростков риса
(sense probe (A), or antisense probe (B–E)). A и B
поперечный срез листа. C – продольный срез кончика корня, включая меристематическую зону, зону растяжения и корневой чехлик. D и E поперечный сред корня.а – клетки мезофилла; b – эпидермис и экзодерма; c - эндодерма; d - эпидермис; e - экзодерма; f – корневой волосок.
Слайд 45Зависимость «натяжение» – «деформация» для клеточной стенки
Обратимые упругие свойства
материалов, в том числе и клеточных стенок описывает модуль Юнга
(выражается в единицах давления):Модуль Юнга для чистой целлюлозы ~ 105 кг/см2. Это 5% модуля Юнга стали. Для клеточной стенки нитчатой водоросли Nitella его величина 0,07×105 кг/см2.
Тургорное давление (Р), существующее внутри живой растительной клетки, приводит к деформации клетки (изменение линейных размеров тканей растений в зависимости от Р можно увидеть в эксперименте с клубнем картофеля, цветоносом одуванчика, работы устьиц и др.)
Слайд 46Продольное натяжение σL= r P/ 2r
Тангенциальное натяжение σT= r P/
r
r = 0.5 mm
r = 5 мкм
P= 6 бар (1
бар= 0,987 атм)σL= 300 бар; σT= 600 бар
М.Ю. = 7000 кг/см2
Относительное удлинение:
L/L = 306/7000 = 0.044 или 4,4%
Относительное увеличение диаметра ??
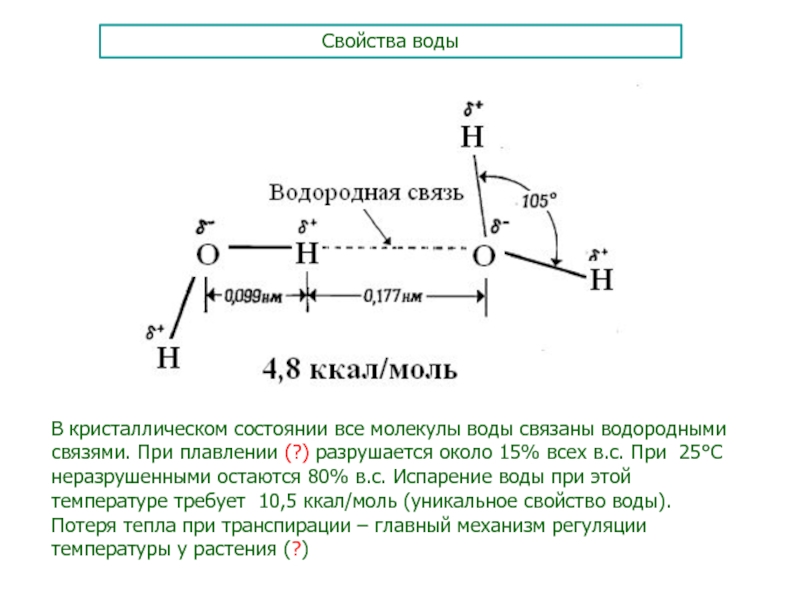
Слайд 47Свойства воды
В кристаллическом состоянии все молекулы воды связаны водородными связями.
При плавлении (?) разрушается около 15% всех в.с. При 25С
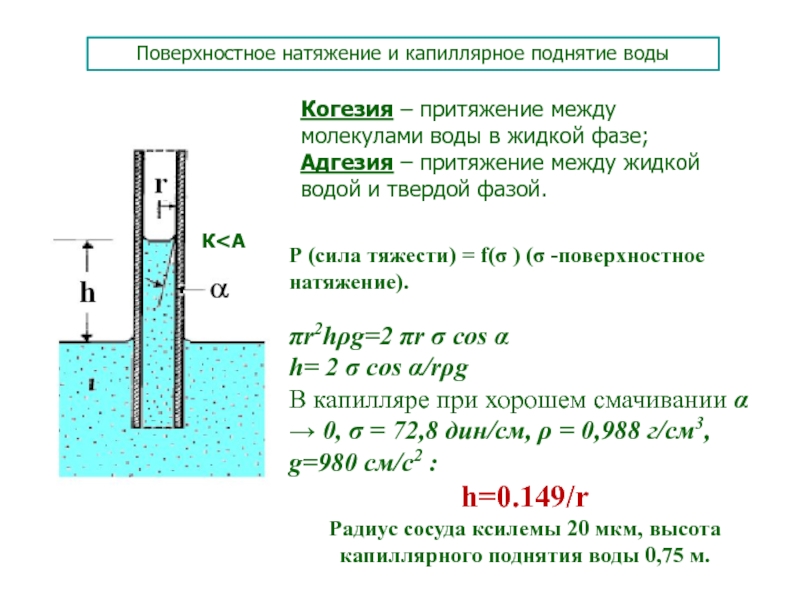
неразрушенными остаются 80% в.с. Испарение воды при этой температуре требует 10,5 ккал/моль (уникальное свойство воды). Потеря тепла при транспирации – главный механизм регуляции температуры у растения (?)Слайд 48Поверхностное натяжение и капиллярное поднятие воды
Когезия – притяжение между молекулами
воды в жидкой фазе;
Адгезия – притяжение между жидкой водой и
твердой фазой.К<А
Р (сила тяжести) = f(σ ) (σ -поверхностное натяжение).
r2hg=2 r σ cos
h= 2 σ cos /rg
В капилляре при хорошем смачивании 0, σ = 72,8 дин/см, = 0,988 г/см3, g=980 см/с2 :
h=0.149/r
Радиус сосуда ксилемы 20 мкм, высота капиллярного поднятия воды 0,75 м.
Слайд 49Расчет времени (tc = ½) диффузии
Диффузия эффективна на короткое расстояние, но
не обеспечивает транспорт на большое расстояние.
Первый закон Фика:
По мере диффузии
вещества от точки старта концентрационный градиент Δcs уменьшается, а диффузионный поток замедляется.Время, необходимое для перемещение в точку пространства, в которой концентрация составит ½ от максимальной (в точке старта) (tc = ½) определяют из уравнения:
Слайд 52
P имеет то же значение, что и Ψp. Это гидростатическое
давление раствора, которое сможет быть как положительным в паренхимной клетке
и отрицательным в клетке ксилемы.Символ называют осмотическим давлением и это отрицательное значение для Ψs.
Осмотическое давление с точки зрения физхимика, зоолога и др. это влияние растворенных веществ на свободную энергию воды. Ψs = –
Термин осмотический потенциал некорректен.
Студенты, изучающие компоненты водного потенциала, сталкиваются с различными обозначениями для одних и тех же величин. Для этого достаточно сравнить два выражения:
Слайд 53Химический потенциал воды
Химический потенциал - один из видов потенциальной энергии,
обладает свойством аддитивности.
Активность воды и осмотическое давление
Уравнение В. Пфеффера, 1877
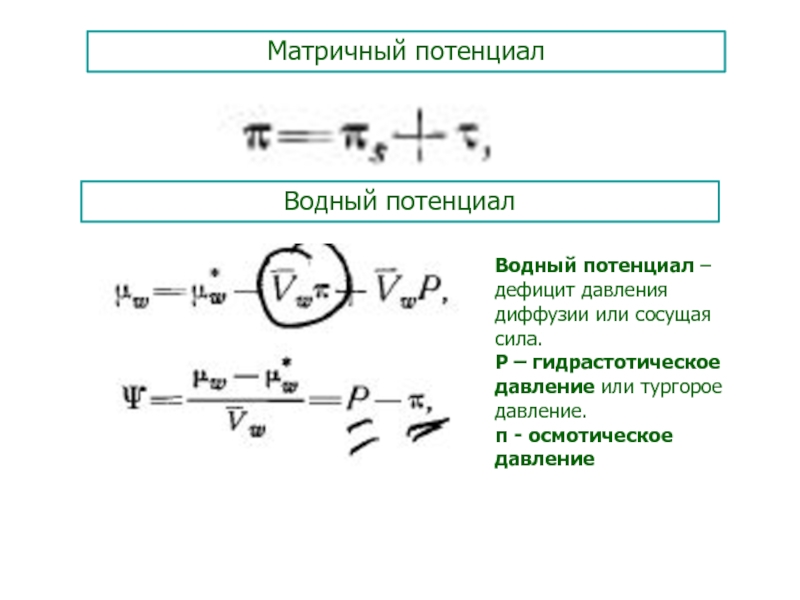
Слайд 54Матричный потенциал
Водный потенциал
Водный потенциал – дефицит давления диффузии или сосущая
сила.
Р – гидрастотическое давление или тургорое давление.
- осмотическое давление
Слайд 55Соотношение Бойля - Вант-Гоффа
Объем тела, окруженного полупроницаемой мембраной, меняется в
зависимости от осмотического давления окружающего раствора. Изменение объема тела в
ответ на изменение осмотического давления описывает соотношение Бойля – Вант-Гоффа:Где 0 – осмотическое давление снаружи
V – объем
b – неактивный объем
nj – число молей в активном объеме
j – осмотический коэффициент
n – кажущееся число осмотически-активных веществ.
Слайд 57Measuring Water Potential
Plant scientists have expended considerable effort in devising
accurate and reliable methods for evaluating the water status of
a plant. Four instruments that have been used extensively to measure Ψw ,Ψs , and Ψp are described here: psychrometer, pressure chamber, cryoscopic osmometer, and pressure probe.Psychrometer (Ψw measurement)
Psychrometry (the prefix "psychro-" comes from the Greek word psychein, "to cool") is based on the fact that the vapor pressure of water is lowered as its water potential is reduced. Psychrometers measure the water vapor pressure of a solution or plant sample, on the basis of the principle that evaporation of water from a surface cools the surface.
Слайд 58One psychrometric technique, known as isopiestic psychrometry, has been used extensively
by John Boyer and coworkers (Boyer and Knipling 1965) and
is illustrated in Web Figure 3.6.A. Investigators make a measurement by placing a piece of tissue sealed inside a small chamber that contains a temperature sensor (in this case, a thermocouple) in contact with a small droplet of a standard solution of known solute concentration (known Ψs and thus known Ψw). If the tissue has a lower water potential than that of the droplet, water evaporates from the droplet, diffuses through the air, and is absorbed by the tissue. This slight evaporation of water cools the drop. The larger the difference in water potential between the tissue and the droplet, the higher the rate of water transfer and hence the cooler the droplet. If the standard solution has a lower water potential than that of the sample to be measured, water will diffuse from the tissue to the droplet, causing warming of the droplet. Measuring the change in temperature of the droplet for several s olutions of known Ψw makes it possible to calculate the water potential of a solution for which the net movement of water between the droplet and the tissue would be zero (Web Figure 3.6.B) signifying that the droplet and the tissue have the same water potential.Слайд 60Psychrometers can be used to measure the water potentials of
both excised and intact plant tissue. Moreover, the method can
be used to measure the Ψs of solutions. This can be particularly useful with plant tissues. For example, the Ψw of a tissue is measured with a psychrometer, and then the tissue is crushed and the Ψs value of the expressed cell sap is measured with the same instrument. By combining the two measurements, researchers can estimate the turgor pressure that existed in the cells before the tissue was crushed (Ψp = Ψw – Ψs).A major difficulty with this approach is the extreme sensitivity of the measurement to temperature fluctuations. For example, a change in temperature of 0.01°C corresponds to a change in water potential of about 0.1 MPa. Thus, psychrometers must be operated under constant temperature conditions. For this reason, the method is used primarily in laboratory settings. There are many variations in psychrometric technique; interested readers should consult Brown and Van Haveren 1972, Slavik 1974, and Boyer 1995.
Слайд 61Pressure chamber (Ψw measurement)
A relatively quick method for estimating the water
potential of large pieces of tissues, such as leaves and
small shoots, is by use of the pressure chamber . This method was pioneered by Henry Dixon at Trinity College, Dublin, at the beginning of the twentieth century, but it did not come into widespread use until P. Scholander and coworkers at the Scripps Institution of Oceanography improved the instrument design and showed its practical use (Scholander et al. 1965).In this technique, the organ to be measured is excised from the plant and is partly sealed in a pressure chamber (Web Figure 3.6.C). Before excision, the water column in the xylem is under tension. When the water column is broken by excision of the organ (i.e., its tension is relieved allowing its Ψp to rise to zero), water is pulled rapidly from the xylem into the surrounding living cells by osmosis. The cut surface consequently appears dull and dry. To make a measurement, the investigator pressurizes the chamber with compressed gas until the distribution of water between the living cells and the xylem conduits is returned to its initial, pre-excision, state. This can be detected visually by observing when the water returns to the open ends of the xylem conduits that can be seen in the cut surface. The pressure needed to bring the water back to its initial distribution is called the balance pressure and is readily detected by the change in the appearance of the cut surface, which becomes wet and shiny when this pressure is attained.
Слайд 62The pressure chamber method for measuring plant water potential. The
diagram at left shows a shoot sealed into a chamber,
which may be pressurized with compressed gas. The diagrams at right show the state of the water columns within the xylem at three points in time: (A) The xylem is uncut and under a negative pressure, or tension. (B) The shoot is cut, causing the water to pull back into the tissue, away from the cut surface, in response to the tension in the xylem. (C) The chamber is pressurized, bringing the xylem sap back to the cut surface. (Click image to enlarge.)Слайд 63The pressure chamber is often described as a tool to
measure the tension in the xylem. However, this is only
strictly true for measurements made on a non-transpiring leaf or shoot (for example, one that has been previously enclosed in a plastic bag). When there is no transpiration, the water potential of the leaf cells and the water potential in the xylem will come into equilibrium. The balancing pressure measured on such a non-transpiring shoot is equal in magnitude but opposite in sign to the pressure in the xylem (Ψp). Because the water potential of our non-transpiring leaf is equal to the water potential of the xylem, one can calculate the water potential of the leaf by adding together Ψp and Ψs of the xylem, provided one collects a sample of xylem sap for determination of Ψs. Luckily Ψs of the xylem is usually small (> –0.1 MPa) compared to typical midday tensions in the xylem (Ψp of –1 to –2 MPa). Thus, correction for the Ψs of the xylem sap is frequently omitted.Balancing pressure measurements of transpiring leaves are more difficult to interpret. The fact that water is flowing from the xylem to the leaf means that differences in water potential must exist. When the transpiring leaf or shoot is cut off, the tension in the xylem is instantly relieved and water is drawn into the leaf cells until the water potentials of the xylem and the leaf cells come into equilibrium. Because the total volume of the leaf cells is much larger than the volume of sap in the xylem, this equilibrium water potential will be heavily weighted towards that of the leaf. Thus, any measurement of the balancing pressure on such a leaf or shoot will result in a value that is approximately the water potential of the leaf, rather than the tension of the xylem. (To be exact, one would have to add the Ψs of the xylem sap to the negative of the balancing pressure to get the leaf water potential.) One can explore the differences between the water potential of the xylem and the water potential of a transpiring leaf by comparing balancing pressures measured on covered (i.e., non-transpiring) versus uncovered (transpiring) leaves.
Pressure chamber measurements provide a quick and accurate way of measuring leaf water potential. Because the pressure chamber method does not require delicate instrumentation or temperature control, it has been used extensively under field conditions (Tyree and Hammel 1972). For a more complete description of the theory and operation of the pressure chamber see Boyer, 1995.
Слайд 64Cryoscopic osmometer (Ψs measurement)
The cryoscopic osmometer measures the osmotic potential of a solution
by measuring its freezing point. Solutions have colligative properties that collectively depend
on the number of dissolved particles and not on the nature of the solute. For example, solutes reduce the vapor pressure of a solution, raise its boiling point, and lower its freezing point. The specific nature of the solute does not matter. One of the colligativeproperties of solutions is the decrease in the freezing point as the solute concentration increases. For example, a solution containing 1 mol of solutes per kilogram of water has a freezing point of –1.86°C, compared with 0°C for pure water.Various instruments can be used to measure the freezing-point depression of solutions (for two examples, see Prager and Bowman 1963, and Bearce and Kohl 1970). With a cryoscopic osmometer, solution samples as small as 1 nanoliter (10–9 L) are placed in an oil medium located on the temperature-controlled stage of a microscope (Web Figure 3.6.D). The very small sample size allows sap from single cells to be measured and permits rapid thermal equilibration with the stage. To prevent evaporation, the investigator suspends the samples in oil-filled wells in a silver plate (silver has high thermal conductivity). The temperature of the stage is rapidly decreased to about –30° C, which causes the sample to freeze. The temperature is then raised very slowly, and the melting process in the sample is observed through the microscope. When the last ice crystal in the sample melts, the temperature of the stage is recorded (note that the melting and freezing points are the same). It is straightforward to calculate the solute concentration from the freezing-point depression; and from the solute concentration (cs), Ψs is calculated as –RTcs .This technique has been used to measure droplets extracted from single cells (Malone and Tomos 1992).
Слайд 65A cryoscopic osmometer measures the concentration of total dissolved solutes
by measuring the freezing-point depression of a solution. (A) Very
small liquid samples are loaded onto the temperature-controlled stage of a microscope. (B) When the temperature is quickly reduced, the samples supercool and freeze. (C) Slowly warming the stage causes the samples to thaw. The temperature at which the last ice crystal melts provides a measure of the melting point of the sample. (Click image to enlarge.)Слайд 66Pressure probe (Ψp measurement)
If a cell were as large as a
watermelon or even a grape, measuring its hydrostatic pressure would
be a relatively easy task. Because of the small size of plant cells, however, the development of methods for direct measurement of turgor pressure has been slow. Using a micromanometer, Paul Green at the University of Pennsylvania developed one of the first direct methods for measuring turgor pressure in plant cells (Green and Stanton 1967). In this technique, an air-filled glass tube sealed at one end is inserted into a cell (Web Figure 3.6.E). The high pressure in the cell compresses the trapped gas, and from the change in volume one can readily calculate the pressure of the cell from the ideal gas law (pressure × volume = constant). This method works only for cells of relatively large volume, such as the giant cell of the filamentous green alga Nitella. For smaller cells, the loss of cell sap into the glass tube is sufficient to deflate the cell and this yields artifactually low pressures.Слайд 67Use of the micromanometer, a pressure probe, to measure cell
turgor pressure.Nitella cells (which are particularly large—about 100 mm in diameter
and many centimeters long) were used for these measurements. (After Green 1968.)Слайд 68For higher plant cells, which are several orders of magnitude
smaller in volume than Nitella, a more sophisticated device, the pressure probe , was
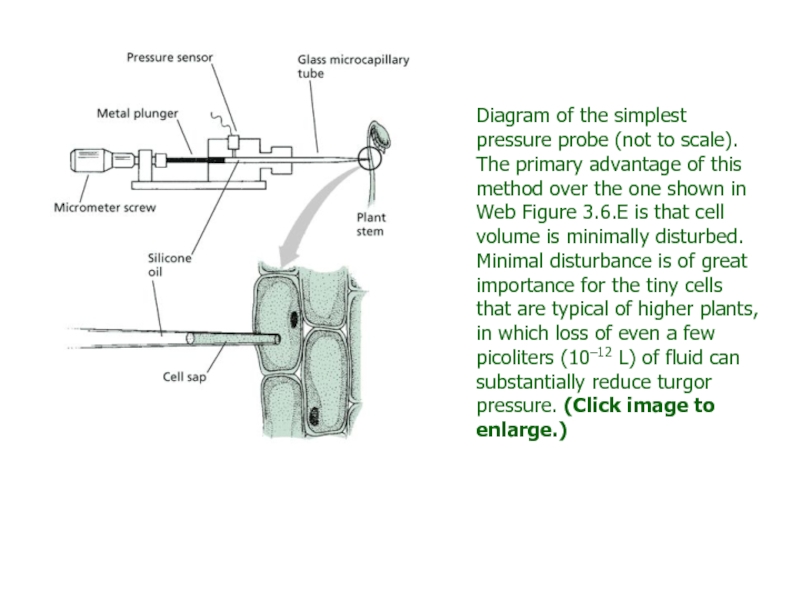
developed by Ernest Steudle, Ulrich Zimmermann, and their colleagues in Germany (Husken et al. 1978). This instrument is similar to a miniature syringe (Web Figure 3.6.F). A glass microcapillary tube is pulled to a fine point and is inserted into a cell. The microcapillary is filled with silicone oil, a relatively incompressible fluid that can be readily distinguished from cell sap under a microscope. When the tip of the microcapillary is first inserted into the cell, cell sap begins to flow into the capillary because of the initial low pressure of that region. Investigators can observe such movement of sap under the microscope and counteract it by pushing on the plunger of the device, thus building up a pressure. In such fashion the boundary between the oil and the cell sap can be pushed back to the tip of the microcapillary. When the boundary is returned to the tip and is held in a constant position, the initial volume of the cell is restored and the pressure inside the cell is exactly balanced by the pressure in the capillary. This pressure is measured by a pressure sensor in the device. Thus the hydrostatic pressure of individual cells may be measured directly.Слайд 69Diagram of the simplest pressure probe (not to scale). The
primary advantage of this method over the one shown in
Web Figure 3.6.E is that cell volume is minimally disturbed. Minimal disturbance is of great importance for the tiny cells that are typical of higher plants, in which loss of even a few picoliters (10–12 L) of fluid can substantially reduce turgor pressure. (Click image to enlarge.)Слайд 70This method has been used to measure Ψp and other parameters of
water relations in cells of both excised and intact tissues
of a variety of plant species (Steudle 1993). The primary limitation of this method is that some cells are too small to measure. Furthermore, some cells tend to leak after being stabbed with the capillary, and others plug up the tip of the capillary, thereby preventing valid measurements. The pressure probe has also been adapted to measure positive and negative values of Ψpin the xylem (Heydt and Steudle 1991). However, technical problems with cavitation (see textbook Chapter 4) limit the measurement of negative Ψp by this technique.Слайд 71The Matric Potential
In discussions of soils, seeds, and cell walls,
one often finds reference to yet another component of Ψw: the
matric potential (Ψm). The matric potential is used to account for the reduction in free energy of water when it exists as a thin surface layer, one or two molecules thick, adsorbed onto the surface of relatively dry soil particles, cell walls, and other materials. The matric potential does not represent a new force acting on water, because the effect of surface interactions can theoretically be accounted for by an effect on Ψs and Ψp (see Passioura 1980; Nobel 1999). In dry materials, however, this surface interaction effect often cannot easily be separated into Ψp and Ψs components in dry materials, so they are frequently bulked together and designated as the matric potential.It is generally not valid to add Ψm to independent measurements of Ψs and Ψp to arrive at a total water potential. This is particularly true for water inside hydrated cells and cell walls, where matric effects are either negligible or they are accounted for by a reduction in Ψp. For instance, the negative pressure in water held by cell wall microcapillaries at the evaporative surfaces of leaves, discussed on p. 75 of the textbook, is sometimes described as a wall matric potential. Care is needed to avoid inconsistencies when accounting for this physical effect in definitions of Ψp, Ψs, and Ψm (Passioura 1980).
Слайд 72Wilting and Plasmolysis
Plasmolysis is the separation of plant cell cytoplasm
from the cell wall as a result of water loss.
It is unlikely to occur in nature, except in severe conditions. Plasmolysis is induced in the laboratory by immersing a plant cell in a strongly saline or sugary solution, so that water is lost by osmosis.If onion epidermal tissue is immersed in a solution of calcium nitrate, cells rapidly lose water by osmosis and the protoplasm of the cells shrinks (Web Figure 3.8.A). This occurs because the calcium and nitrate ions freely permeate the cell wall and encounter the selectively permeable plasma membrane. The large vacuole in the center of the cell originally contains a dilute solution with much lower osmotic pressure than that of the calcium nitrate solution on the other side of the membrane. The vacuole thus loses water and becomes smaller. The space between the cell membrane and the cell wall enlarges and the plasma membrane and the protoplasm within it contract to the center of the cell. Strands of cytoplasm extend to the cell wall because of plasma membrane-cell wall attachment points. Plasmolysed cells die unless they are transferred quickly from the salt or sugar solution to water.
Слайд 73Plasmolysis of an epidermis cell of Allium cepa after addition of calcium
nitrate. Both chloroplast and vacuole become unevenly shaped. Strands of
cytoplasm remain between the shrinking protoplasm and the neighboring cells. (Courtesy of Dr. Peter v. Sengbusch, University of Hamburg.)Слайд 74Понятие гидравлической проводимости
Рассмотрим клетку с начальным водным потенциалом равным –0.2
MPa, погруженной в чистую воду. Вода будет двигаться в клетку
за счет движущей силы ΔΨw = 0.2 Mpa.С какой скоростью перемещается вода?
Скорость зависит от гидравлической проницаемости мембраны (Lp) и движущей силы.
Гидравлическая проницаемость выражает как вода может двигаться через мембрану. Она выражается в единицах объема воды, отнесенных к времени и к движущей силе: m3m–2s–1 MPa–1 or ms–1 MPa–1). Гидравлическая проводимость мембраны 10–6 m s–1 MPa–1. Поток (Jv) можно определить по формуле:
Слайд 75Следует обратить внимание, что рассмотрена идеальная мембрана, т.е. проницаемая только
для воды (но, не для растворенных веществ). Также считают, что
составляющие водного потенциала (ΔΨs и ΔΨp ) равнозначны по отношению к потоку воды.Реальная (неидеальная) мембрана требует более сложного уравнения и разделения водных потоков, которые зависят от ΔΨs и by ΔΨp (Nobel 1999).
В рассмотренном примере Jv выражается как
0.2 x 10–6 m s–1. Это начальная максимальная скорость транспорта. По мере роста водного потенциала скорость падает (падает движущая сила (ΔΨw)) по экспоненциальному закону.
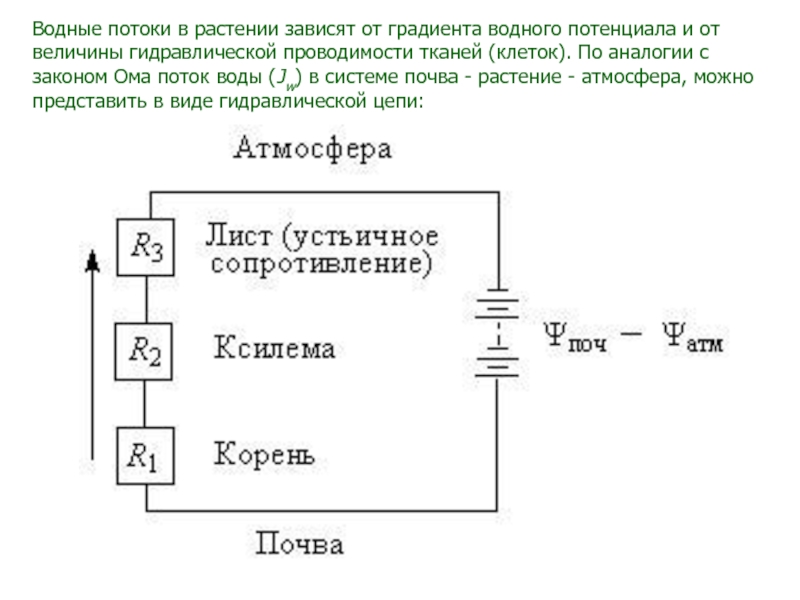
Слайд 76Водные потоки в растении зависят от градиента водного потенциала и
от величины гидравлической проводимости тканей (клеток). По аналогии с законом
Ома поток воды (Jw) в системе почва - растение - атмосфера, можно представить в виде гидравлической цепи:Слайд 77В целом растении можно выделить три основных последовательно соединенных гидравлических сопротивления: R1 - участок от поверхности
клеток эпидермиса до сосудов ксилемы, R2 - сопротивление элементов ксилемы, R3 - сопротивление при
испарении воды в атмосферу из листьев.Поскольку , а R (гидравлическое сопротивление) –
величина обратная kw (гидравлическая проводимость), имеем:
,
где - суммарный градиент водного потенциала всей цепи,
R - суммарное сопротивление всех элементов цепи.
Слайд 79Корневая система растения:
1-общий вид, 2-поперечный разрез, 3 и 4 –корневые
волоски, 5 – кончик корня
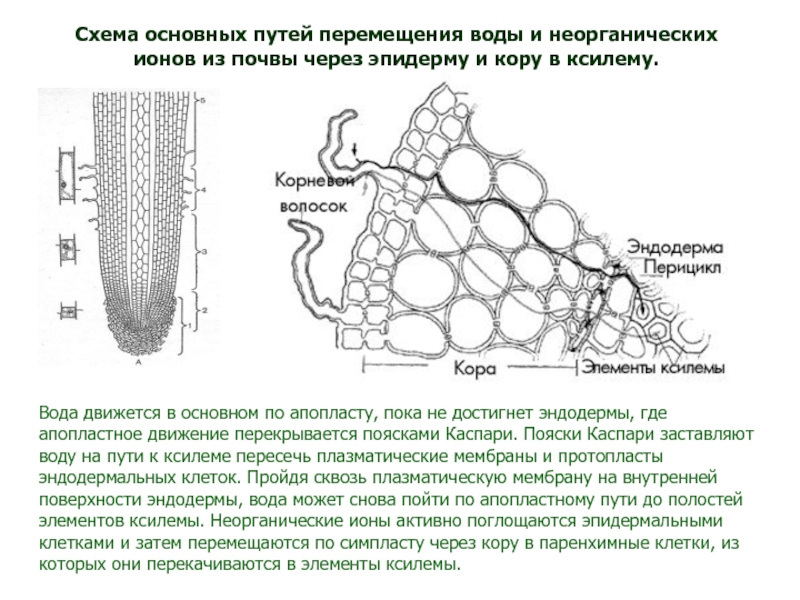
Слайд 82Вода движется в основном по апопласту, пока не достигнет эндодермы,
где апопластное движение перекрывается поясками Каспари. Пояски Каспари заставляют воду
на пути к ксилеме пересечь плазматические мембраны и протопласты эндодермальных клеток. Пройдя сквозь плазматическую мембрану на внутренней поверхности эндодермы, вода может снова пойти по апопластному пути до полостей элементов ксилемы. Неорганические ионы активно поглощаются эпидермальными клетками и затем перемещаются по симпласту через кору в паренхимные клетки, из которых они перекачиваются в элементы ксилемы.Схема основных путей перемещения воды и неорганических ионов из почвы через эпидерму и кору в ксилему.
Слайд 86Движение воды по сосудам ксилемы происходит в соответствии с законом
Пуазейля
Ламинарное движение жидкости в цилиндре пропорционально квадрату его радиуса, градиенту
гидростатического давления и обратно пропорционально вязкости раствораСлайд 87Средний поток водного раствора в ксилеме транспирирующего дерева составляет
0,1
см/сек или 3,6 м/час.
(Как можно измерить скорость движения воды
?) При радиусе элемента ксилемы 20 мкм и вязкости 0,010 П (Пуаз) градиент давления составляет:
-0,002 бар/см или -0,2 бар/м
При заданной скорости движения воды через поры клеточной оболочки с радиусом 5 нм потребуется градиент давления
-30000 бар/см.
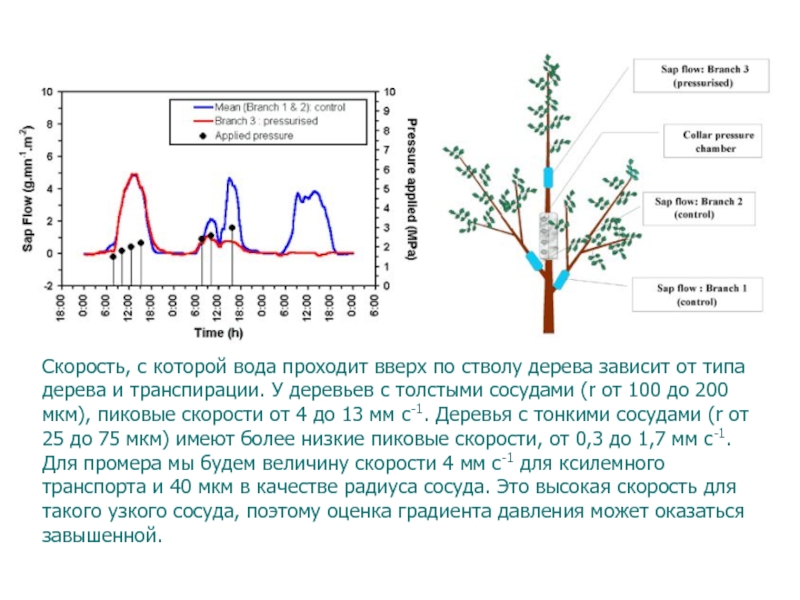
Слайд 88Скорость, с которой вода проходит вверх по стволу дерева зависит
от типа дерева и транспирации. У деревьев с толстыми сосудами
(r от 100 до 200 мкм), пиковые скорости от 4 до 13 мм с-1. Деревья с тонкими сосудами (r от 25 до 75 мкм) имеют более низкие пиковые скорости, от 0,3 до 1,7 мм с-1.Для промера мы будем величину скорости 4 мм с-1 для ксилемного транспорта и 40 мкм в качестве радиуса сосуда. Это высокая скорость для такого узкого сосуда, поэтому оценка градиента давления может оказаться завышенной.
Слайд 92Натяжение воды , содержащейся в клеточной оболочке клеток листа.
Главный вклад
в общий водный потенциал клеточной стенки (кл. ст.) вносит матричный
потенциал.Для количественных оценок используют уравнение для силы поверхностного натяжения в цилиндре со смачиваемыми стенками в условиях адгезии:
Поверхностное натяжение σ воды составляет 7,28×10-5 бар/см, промежутки между фибриллами целлюлозы клеточной оболочки достигают 10 нм, угол стремится к 0. Натяжение или отрицательное гидростатическое давление составит 291 бар. Для водного потенциала при ОВВ 95% равному -69 бар, достаточно, чтобы радиус капилляров был в пределах 20-25 нм. В расчеты может внести коррективы концентрация раствора. Тогда диаметр капилляров снова придется уменьшить.
Слайд 95Транспирация водяного пара. Градиенты
Транспирация из листьев зависит от двух
основных факторов: разница в концентрации паров воды между воздушными промежутками
листьев и наружного воздуха и, диффузионного resisitance (г) этого пути. Эта концепция транспирации аналогичен потоку электронов в электрической цепи. Действительно, электрическим аналогом широко используется в качестве модели для потери паров воды от листа.В этом аналоге, сопротивления, связанные с каждой стороны пути; Основными из них являются сопротивление устьичной поры (rs) и сопротивление за счет слоя неперемешиваемого воздуха на поверхности листа (rb) (так называемый пограничный слой). Интенсивность транспирации (Е, в моль · м-2 с-1) может быть связано с диффузионным сопротивлением (R, в см-1) по следующей формуле:
Слайд 96Схема испарения воды чрез малые отверстия (правило Стефана)
Листья в полевых
условиях при 20 градусах Цельсия и скорости ветра 5 км
час могут испарять 0,02 г/см2 часОпределение количества устьиц на единицу поверхности листа. Различия верхней и нижней сторон листа.
Слайд 100Чем меньше относительная влажность атмосферного воздуха, тем ниже его водный
потенциал. Если водный потенциал воздуха меньше водного потенциала подустьичных полостей,
то молекулы воды испаряются нару- жу. Основным фактором, влияющим на открывание и закрывание устьиц, является содержание воды в листе, в том числе и в замыкающих клетках устьиц. Высокая оводненность замыкающих клеток приводит к открыванию устьиц. При недостатке воды замыкающие клетки выпрямляются – и устьичная щель закрывается. Кроме того, по мере увеличения водного дефицита в тканях растения повышается концентрация ингибитора роста абсцизовой ки- слоты. Она подавляет деятельность Н+ -насосов в плазмалемме замыкающих клеток, которые участвуют в Н+ /К+ обмене, вследствие чего снижается их тургор и устьица закрываются. Абсцизовая кислота также ингибирует синтез фермента α-амилазы, что приводит к снижению гидролиза крахмала, поэтому сосущая сила замыкающих клеток уменьшается – и устьица закрываются.Слайд 102Устьичная транспирация и механизмы ее регуляции
Схема регуляции работы устьиц (В.В.Полевой,
1998)
Лекция 4. Водный режим растений. Транспирация. Экология водного режима.
4.7
Слайд 103Суточный ход транспирации
Суточный ход транспирации гомойгироидных (слева) и пойкилогидроидных растений
(справа) (В.В.Полевой, 1998)
Лекция 4. Водный режим растений. Транспирация. Экология
водного режима.4.8
Слайд 104Коэффициент транспирации:
Отношение количества испарившейся воды на 1 г фиксированного СО2
при фотосинтезе.
200 – 800 у С3 растений;
200 – 350 у
С4 растений430 – 150 у САМ.
Слайд 106Let's begin by noting that the velocity with which water
travels up the trunk of a tree depends on both
the type of tree and the transpirational demand placed on the xylem. For trees with wide vessels (radii of 100 to 200 µm), peak velocities of 16 to 45 m h–1 (4 to 13 mm s–1) have been measured. Trees with smaller vessels (radii of 25 to 75 µm) have lower peak velocities, from 1 to 6 m h–1 (0.3 to 1.7 mm s–1). For our calculation we will use a figure of 4 mm s–1 for the xylem transport velocity and 40 µm as the vessel radius. This is a high velocity for such a narrow vessel, so it will tend to exaggerate the pressure gradient required to support water flow in the xylem.A version of Poiseuille’s equation (see textbook Equation 4.2) can be used to estimate the pressure gradient (ΔΨp/Δx) needed to move water at this velocity (4 × 10–3 m s–1) through a pipe of radius (r) 40 µm. By dividing textbook Equation 4.2 by the cross-sectional area (πr2 ) of the xylem vessel, we find that the rate of transport (Jv, in m s–1) is given by the following equation:
Слайд 110Скорость, с которой вода проходит вверх по стволу дерева зависит
от типа дерева и транспирации. У деревьев с толстыми сосудами
(r от 100 до 200 мкм), пиковые скорости от 4 до 13 мм с-1. Деревья с тонкими сосудами (r от 25 до 75 мкм) имеют более низкие пиковые скорости, от 0,3 до 1,7 мм с-1.Для промера мы будем величину скорости 4 мм с-1 для ксилемного транспорта и 40 мкм в качестве радиуса сосуда. Это высокая скорость для такого узкого сосуда, поэтому оценка градиента давления может оказаться завышенной.
Версия уравнения Пуазейля может быть использована для оценки градиента давления (ΔΨp/Δx)
, необходимое для перемещения воды при этой скорости (4 × 10-3 мс-1) через трубу радиуса (R) 40 мкм. Разделив учебник уравнение 4,2 по площади поперечного сечения (πr2) от ксилемы судна, мы находим, что скорость переноса (СП, в МС-1) задается следующим уравнением:
Слайд 111Taking the viscosity of xylem sap to be that of
water (10–3 Pa s), we find that the pressure gradient required
is 2 × 104 Pa m–1 (or 0.02 MPa m–1). This is the pressure gradient needed to overcome the viscous drag that arises as water moves through an ideal vessel at a rate of 4 mm s–1. Real vessels have irregular inner wall surfaces and constrictions, such as perforati on plates, at the points where vessel elements meet. Tracheids, with their smaller diameters and pitted walls, offer even greater resistance to water flow. Such deviations from an ideal pipe will increase the frictional drag above that calculated from Poiseuille's equation, but since we selected a low value for vessel radius, our estimate of 0.02 MPa m–1should be in the correct range for pressure gradients found in real trees.Let's now compare this value (0.02 MPa m–1) with the driving force that would be necessary to move water at the same velocity through a layer of living cells. We will ignore water movement in the apoplast pathway in this example and focus on water moving from cell to cell, crossing the plasma membrane each time. As we described in textbook Chapter 3, the velocity (Jv) of water flow across a membrane depends on the membrane hydraulic conductivity (Lp) and on the difference in water potential (ΔΨw) across the membrane:
Слайд 112Принимая вязкость ксилемного сока, чтобы быть, что из воды (10-3
Па с), мы находим, что градиент давления требуется, это 2
× 104 Па м-1 (или 0,02 МПа м-1). Это градиент давления для преодоления вязкого сопротивления, которая возникает как вода движется через идеального судна в размере 4 мм с-1. Реальные сосуды имеют нерегулярные внутренних поверхностей и сужения стенок, такие как perforati на пластинах, в точках, где элементы сосудов встречаются. Трахеид, с их меньшие диаметры и без косточек стены, предлагают даже большее сопротивление потоку воды. Такие отклонения от идеального трубы увеличит сопротивление трения выше, что рассчитанная по уравнению Пуазейля, но так как мы выбрали низкое значение для радиуса сосуда, наша оценка 0,02 МПа м-1 должно быть в правильном диапазоне для градиентов давления, найденного в реальных деревьев .Давайте теперь сравнить эту величину (0,02 МПа м-1) с движущей силы, которая была бы необходима для перемещения воды с той же скоростью через слой живых клеток. Мы будем игнорировать движение воды в апопласт пути в этом примере и сосредоточиться на воде движущегося от клетки к клетке, пересекая плазменной мембране каждый раз. Как описано в главе 3 учебника, скорость (СП) потока воды через мембрану, зависит от гидравлической проводимости мембраны (LP), а на разнице в водном потенциале (ΔΨw) через мембрану:
Слайд 113Высокое значение Lp высших растительных клеток составляет около 4 ×
10-7 мс-1 МПа-1. Таким образом, для перемещения воды через мембрану
в 4 × 10-3 мс-1 потребует движущую силу (ΔΨw) из 104 МПа (разделен 4 × 10-3 мс-1 по 4 × 10-7 мс-1 МПа-1 ). Это движущая сила необходима для перемещения воды через одной мембраны. Для перемещения в камере, вода должна пересечь по меньшей мере, две мембраны, так что общее движущей силой по одной ячейки будет 2 × 104 МПа. Если оценить длину клеток за 100 мкм (10-4 м, щедрым оценкам), то градиент потенциала воды необходимы для воды двигаться со скоростью 4 мм с-1 через слой клеток будет 2 × 104 МПа деленное на 10-4 м, или 2 × 108 МПа м-1. Это огромное движущей силой, и это показывает, что расход воды через ксилемы чрезвычайно более эффективным, чем поток воды через мембраны клеток. Сравнивая двух движущих сил (для открытого сосуда и клетки транспорта), мы видим, что эти два пути показать разницу в 1010 Это огромная разница действительно.A high value for the Lp of higher plant cells is about 4 × 10–7 m s–1 MPa–1. Thus, to move water across a membrane at 4 × 10–3 m s–1 would require a driving force (ΔΨw) of 104 MPa (4 × 10–3 m s–1 divided by 4 × 10–7 m s–1 MPa–1). This is the driving force needed to move the water across a single membrane. To move through a cell, water must cross at least two membranes, so the total driving force across one cell would be 2 × 104 MPa. If we estimate the cell length as 100 µm (10–4 m, a generous estimate), then the water potential gradient needed for water to move at a velocity of 4 mm s–1 through a layer of cells would be 2 × 104 MPa divided by 10–4 m, or 2 × 108 MPa m–1. This is an enormous driving force, and it illustrates that water flow through the xylem is exceedingly more efficient than water flow across the membranes of cells. Comparing the two driving forces (for open vessel and cell transport), we see that the two pathways show a difference of a factor of 1010. This is a huge difference indeed.
Слайд 114Let’s examine the factors in Web Equation 4.4.1 in greater
detail. The difference in water vapor concentration is expressed as cwv
(leaf) – cwv (air). (Sometimes vapor pressures are used instead of concentrations, and the difference is called the water vapor pressure deficit. Water vapor pressure (pwv) is measured in kilopascals (kPa) and is proportional to water vapor concentration (Web Table 4.4.A) wherecwv (leaf) is the water vapor concentration inside the leaf and cwv (air) is the water vapor concentration of the air outside the leaf, both expressed in moles per cubic meter (mol m–3). Resistance (r) is the inverse of conductance; that is, resistance = 1/conductance. Thus, a high resistance is the same as a low conductance. Expression of this value in terms of resistances is preferred over expression in terms of conductances in some instances because resistances in series may be summed to calculate a total resistance, as in the above equation, whereas a similar calculation of conductances in series is more complicated. In the leaf, the total resistance is due mostly to the diffusion limitation imposed by the stomatal pore, but other parts of the pathway for water vapor loss, such as the boundary layer (which we will discuss shortly), may contribute significantly to r.Слайд 115Давайте рассмотрим факторы, в веб уравнении 4.4.1 более подробно. Разница
в концентрации паров воды выражается в виде CWV (лист) -
CWV (воздух). (Иногда давление паров используются вместо концентрации, а разница называют дефицит давление водяного пара. Давление паров воды (СПВ) измеряется в кПа (кПа) и пропорциональна концентрации паров воды (веб Таблица 4.4.A), где CWV (лист) является концентрация паров воды внутри листа и CWV (воздуха) является концентрация водяного пара в воздухе за пределами листа, как выражается в моль на кубический метр (моль м-3). Сопротивление (г) является обратным проводимость, то есть сопротивление = 1 / проводимость Таким образом, высокое сопротивление такое же, как низкой проводимости Экспрессия этого значения в плане предпочтительнее, чем выражение через проводимостей в некоторых случаях сопротивлений, так как сопротивление в серии, может быть выражена.. рассчитать общее сопротивление, как и в приведенном выше уравнении, тогда как аналогичный расчет проводимостей в серии является более сложным. в листе, общее сопротивление обусловлено в основном к диффузии ограничение, налагаемое на устьичного поры, но другие части пути для потери воды пара, например, пограничного слоя (который мы обсудим в ближайшее время), может внести существенный вклад в р.Слайд 116Vapor pressures and concentrations are equivalent; in our analysis we
will use the latter. The water vapor concentration of bulk
air (cwv (air)) can be readily measured, but that of the leaf (cwv (leaf)) is more difficult to assess. We can estimate it by assuming that the air space in the leaf is close to water potential equilibrium with the cell wall surfaces. This approximation is not strictly true, because water is diffusing away from these surfaces. However, it introduces little error because the major resistance to vapor loss is at the stomatal pore. Moreover, the volume of air space inside the leaf is small, whereas the wet surface from which water evaporates is comparatively large. Air space volume is about 5% of the total leaf volume for pine needles, 10% for corn leaves, 30% for barley, and 40% for tobacco leaves. The internal surface area from which water evaporates may be from 7 to 30 times the external leaf area. This high ratio of surface area to volume makes for rapid vapor equilibration inside the leaf.Making the assumption of equilibrium, we can calculate the water vapor concentration in the leaf air spaces if we know (1) the water potential of the leaf (which is the same as the water potential of the wall surfaces from which water is evaporating) and (2) the leaf temperature. Let’s take as an example a leaf with a water potential of –1.0 MPa. To reach vapor equilibrium, water evaporates from the cell wall surfaces until the water potential of the air inside the leaf equals the water potential of the leaf. The water potential of the air is given by the following equation:
Слайд 117Vapor давления и концентрации эквивалентны; В нашем анализе мы будем
использовать последний. Концентрация паров воды из объемной воздуха (CWV (воздуха))
может быть легко измерено, но что из листа (CWV (листьев)) является более трудно оценить. Мы можем оценить его, предполагая, что воздушное пространство в листе близко к воде потенциального равновесии с клеточной стенки поверхностей. Это приближение не совсем верно, так как вода диффундирует от этих поверхностей. Тем не менее, он вводит маленькую ошибку, потому что основным устойчивость к потере пара в устьичного поры. Кроме того, объем воздушного пространства внутри листа мала, в то время как мокрой поверхности, с которой вода испаряется сравнительно велика. Объем воздушного пространства составляет около 5% от общего объема листьев для хвои, 10% для листьев кукурузы, 30% ячменя и 40% для листьев табака.Площадь внутренней поверхности, с которой вода испаряется, может составлять от 7 до 30 раз внешней поверхности листьев. Это высокое отношение площади поверхности к объему составляет для быстрого уравновешивания пара внутри листа.Делая предположение о равновесии, мы можем рассчитать концентрацию паров воды в лист воздушных пространств, если мы знаем (1) водный потенциал листьев (что то же самое, как водного потенциала поверхности стен, из которых вода испаряется) и (2) температура листьев. Давайте возьмем в качестве примера лист с водного потенциала -1,0 МПа. Для достижения равновесия паров, вода испаряется из клеточной поверхности стен, пока вода потенциал воздуха внутри листа не совпадает с водой потенциал листа.Водный потенциал воздуха задается следующим уравнением:
Слайд 118where R is the gas constant, T is temperature (in degrees Kelvin), V–w is the partial
molar volume of liquid water, and RH is the relative humidity of
the air. Relative humidity is the water vapor concentration expressed as a fraction of the saturation water vapor concentration, cwv(sat.):где R газовая постоянная, Т температура (в градусах Кельвина), V-W является парциальный мольный объем жидкой воды, и относительной влажности относительная влажность воздуха. Относительная влажность концентрация водяного пара выражены в виде доли от концентрации насыщения паров воды, CWV (СБ):
ОВ изменяется между 0 и 1; RH умноженное на 100 является относительная влажность в процентах.
RH varies between 0 and 1; RH multiplied by 100 is the percentage relative humidity.
Слайд 119Web Table 4.4.A shows RH values as a function of water potential,
calculated from Web Equation 4.4.2. This table shows that the
air spaces of living leaves must have a high RH, a value of nearly 1 (100%), when water potentials are in the physiological range. Moreover, outside air, with RH of, for example, 0.5 (50%), has a remarkably low water potential.Веб таблице приведены значения 4.4.A RH в зависимости от водного потенциала, рассчитанной по уравнению Web 4.4.2. Эта таблица показывает, что воздушные пространства на живые листья должны быть высокий уровень относительной влажности, значение почти на 1 (100%), когда вода потенциалы в физиологическом диапазоне. Кроме того, наружный воздух с относительной влажности, например, 0,5 (50%), имеет чрезвычайно низкий потенциал воды.
Примечание: Эти данные по 20 ° C. aCalculated помощью веб уравнение 4.4.2, со значением 135 МПа для RT / VW.
Слайд 120To convert from RH to cwv, we need to know cwv(sat.). The saturation water
vapor concentration is strongly dependent on temperature. As the air temperature rises,
the water-holding capacity of air increases sharply, (see Web Figure 4.4.A below). In the range of 10 to 35°C, an increase in air temperature of 12°C doubles the water vapor concentration of saturated air. This is an important observation. If our leaf with a water potential of –1.0 MPa warms up abruptly from 20 to 32°C, the relative humidity in the leaf air space drops abruptly from 99.3 to almost 50%. This drop in RH results because the water-holding capacity of the air, cwv(sat.), doubles. As a result of the drop in RH, water will evaporate in the air space until RH returns to a value of 99.3% and the air is again in water potential equilibrium with the leaf. As a consequence of this change in temperature, cwv(leaf) (the water vapor concentration of the leaf air space) increases from 0.95 to 1.87 mol m–3, which makes for a steeper concentration difference driving the diffusional loss of water from the leaf. For this reason, leaf temperature is an important determinant of the transpiration rate.Для преобразования ОВ в CWV, мы должны знать CWV (СБ). Концентрация насыщения паров воды сильно зависит от температуры. При повышении температуры воздуха, емкость влагоудерживающий воздуха увеличивается резко, (см Web Рисунок 4.4.A ниже). В диапазоне от 10 до 35 ° С, увеличения температуры воздуха 12 ° С удваивает концентрации паров воды из насыщенного воздуха. Это важное наблюдение. Если наш лист с водного потенциала -1,0 МПа разогревает резко от 20 до 32 ° С, относительная влажность в воздушном пространстве листа резко падает от 99,3 до почти 50%. Это капля в RH приводит, потому что водоудерживающая способность воздуха, CWV (СБ), удваивается. В результате падения RH, вода будет испаряться в воздушном пространстве до тех пор, относительной влажности не возвращается к значению 99,3%, и воздух снова в водный потенциал равновесии с листа. Как следствие этого изменением температуры, CWV (лист) (концентрация водяного пара в воздушном пространстве листа) возрастает от 0,95 до 1,87 моль м-3, что делает для более крутым разницы концентрации движущей диффузионное потерю воды из листьев . По этой причине, температура листьев является важным фактором, определяющим скорость транспирации.
Слайд 121Textbook Table 4.1 illustrates how RH, cwv, and water potential change at
various points in the transpiration pathway. We see that cwv decreases along
each step of the pathway from the cell wall surface to the bulk air outside the leaf. Keep in mind that RH can increase along part of this pathway because the external air temperature may be lower than the temperature of the leaf. The important points to remember are (1) that the driving force for water loss from the leaf is the absolute concentration difference (difference in cwv, not in RH), and (2) that this difference depends on leaf temperature.Учебник Таблица 4.1 иллюстрирует, как относительная влажность, изменение потенциала CWV, и воды в различных точках в транспирации пути. Мы видим, что CWV уменьшается вдоль каждого шага пути от поверхности клеточной стенки к объемной воздуха за пределами листа. Следует помнить, что относительная влажность может увеличить вдоль части этого пути, потому что температура наружного воздуха может быть ниже, чем температура листа. В важные моменты, чтобы помнить, являются: (1) что движущей силой для потери воды из листа разница абсолютная концентрация (разница в CWV, а не в RH), и (2) что это различие зависит от температуры листа.
Слайд 122С помощью этого эксперимента, Диксона убедительно показали, что листовые ветви
подвергали давлении 3 атм, тем не менее возможность использовать воду
из внешнего сосуда (под давлением) камеры при атмосферном давлении.Слайд 123Косвенное измерение кавитации в экспериментах с использованием барокамеру воротник в
ореховое дерево. Камера давления воротника обеспечивает способ создания внешнего давления
на участке филиала. Это внешнее давление, применяются в течение 2 мин. интервалы в этих экспериментах, передается в проводящей системы, и это может вызвать различную степень кавитации. В первый день, давление от 1 до 2 МПа применялся без влияния на время сокодвижения. На второй день, более высокое давление применялись и никаких изменений в сокодвижения не наблюдалось ниже давления 2,4 МПа. Для давлений между 2,4 и 2,6 МПа, то кавитации индуцировали, как показано снижением потока сока, по сравнению с контрольными ветвей. Около 4 часов вечера был применен давление 3 МПа. Для ореха, сосуды полностью cavited при этом давлении и не более сокодвижение не occurrs. Нет сокодвижение не наблюдалось через оказывают давление отрасли на третий день, показали, что discountinuity водяного столба, вызванного кавитации был постоянным (Ameglio др., 1994).Слайд 124Hydraulic compartmentalization of vessel refilling. Left: Living cells adjacent to the
embolized vessel create a driving gradient that draws water into
the vessel lumen (blue arrows). Droplets are retained on the wall due to the nonzero contact angle (θ). Low permeability of the secondary wall prevents tension in adjacent vessels from being transmitted. Influx of water into the lumen compresses the gas phase (black arrows), forcing it into solution (yellow arrows). The dissolved gas then diffuses away from the refilling vessel, where it may be carried off by the transpiration stream. Right: Bordered pit geometry (inverted funnel with angle α) prevents water from entering the pit channel before the lumen is entirely filled. The upper conduit is actively refilling and the water is under positive pressure; the lower vessel is under tension. Arrows indicate the effects of hydrostatic pressure (black) and surface tension force (red) on the gas/liquid interface. (Figure reprinted from Holbrook and Zwieniecki 1999.)Гидравлический компартментализация судна заправки. Слева: Живые клетки, прилегающие к эмболизированной судна создать вождения градиент, который привлекает воду в просвет сосуда (синие стрелки). Капельки сохраняются на стену в связи с ненулевым углом контакта (θ). Низкая проницаемость вторичной стенки предотвращает напряжение в соседних сосудов с передачей. Приток воды в просвет сжимает газовую фазу (черные стрелки), заставляя его в раствор (желтые стрелки).Растворенный газ затем диффундирует в сторону от заправки судна, где она может быть уносимой потоком транспирации. Справа: Граничит геометрия яма (перевернутая воронка с углом α) предотвращает попадание воды в пит-канал перед просвет полностью заполнено.Верхний канал активно заправки и вода при положительном давлении; нижняя судно находится под напряжением. Стрелки указывают эффекты гидростатического давления (черный) и силы поверхностного натяжения (красный) на границе газ / жидкость. (Рисунок перепечатана из Холбрук и Zwieniecki 1999)
Слайд 127Химический потенциал воды и водный потенциал клетки.
Зависимость транспорта воды от
водного потенциала растительной клетки и внешней среды (С.С.Медведев, 2004)
Лекция 2.
Физиология растительной клетки. Клетка как осмотическая система.2.4
Слайд 128Химический потенциал воды и водный потенциал клетки.
Изменение осмотических величин при
переходе клетки от полного тургора к началу плазмолиза и наоборот
(В.В.Полевой, 1989)Лекция 2. Физиология растительной клетки. Клетка как осмотическая система.
2.5
Слайд 129План лекции
Значение воды для жизнедеятельности растений.
Формы воды в клетке.
Водные характеристики почвы.
Корневая система как орган потребления воды.
Формирование корневого
давления Лекция 3. Водный режим растений. Функция и формы воды в растениях. Поглощение воды растением.
Физиология растений
3.1
Слайд 130План лекции
Механизмы передвижения воды по растению. Теория сцепления
Транспирация. Виды и
механизм транспирации.
Устьичная транспирация и механизмы ее регулирования
Суточные колебания
транспирацииОсобенности водного обмена у растений различных экологических групп
Роль растений в круговороте воды в биосфере
Лекция 4. Водный режим растений. Транспирация. Экология водного режима.
Физиология растений
4.1
Слайд 131Транспорт воды по растению
Основные движущие силы водного потока в растении
(С.С.Медведев, 2004)
Лекция 4. Водный режим растений. Транспирация. Экология водного
режима.4.2
Слайд 132Транспирация
Значение водного потенциала и его компонентов на пути транспорта воды
от почвы до атмосферы (С.С.Медведев, 2004)
Лекция 4. Водный режим
растений. Транспирация. Экология водного режима.4.3