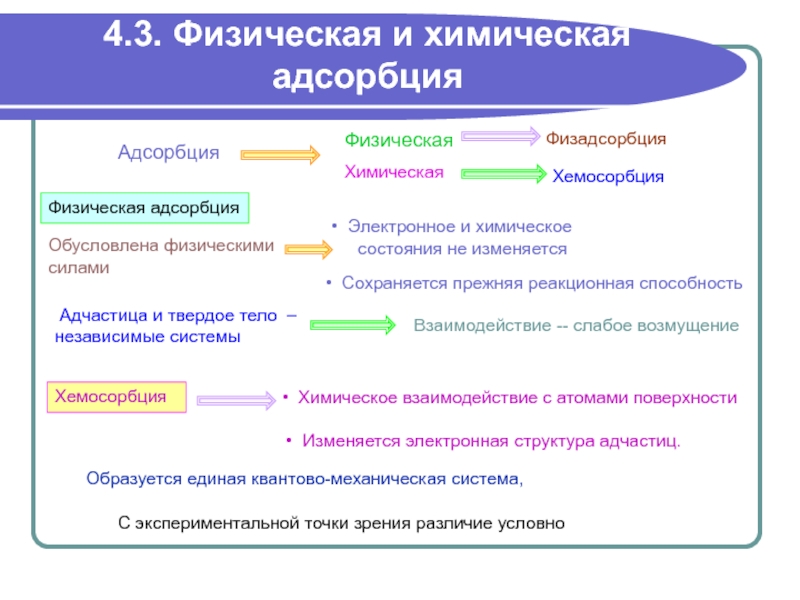
химическое
состояния не изменяется
Химическое взаимодействие с
атомами поверхности Изменяется электронная структура адчастиц.
Адчастица и твердое тело –
независимые системы
Взаимодействие -- слабое возмущение
Образуется единая квантово-механическая система,
С экспериментальной точки зрения различие условно
Адсорбция
Физическая
Химическая
Хемосорбция
Физическая адсорбция
Хемосорбция
Сохраняется прежняя реакционная способность