Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физика молекул ЛЕКЦИЯ № 7 от 22 сентября 200 5 г. ПЛАН Физика молекул 1) Типы
Содержание
- 1. Физика молекул ЛЕКЦИЯ № 7 от 22 сентября 200 5 г. ПЛАН Физика молекул 1) Типы
- 2. Физика молекулТипы связей атомов в молекуле1?Для простоты
- 3. Физика молекулТипы связей атомов в молекулеЧтобы стать
- 4. Физика молекулТипы связей атомов в молекулеДиполь-дипольная –
- 5. Физика молекулКвантовая теория молекул Рассмотрим этот вопрос
- 6. Физика молекулКвантовая теория молекул Ядра имеют массу
- 7. Физика молекулКвантовая теория молекул Один атом расположен
- 8. Физика молекулКвантовая теория молекул Энергия, обусловленная электронной
- 9. Физика молекулКвантовая теория молекул Асимптотическое значение энергии
- 10. Физика молекулЭнергия молекулОсновное изменение энергии молекулы происходит,
- 11. Физика молекулЭнергия молекулКолебательную энергию молекулы можно рассчитать,
- 12. Физика молекулЭнергия молекулКривая потенциальной энергии молекулы нами
- 13. Физика молекулЭнергия молекулОбратимся к вопросу о вращательной
- 14. Физика молекулЭнергия молекулДля вращательного квантового числа правило
- 15. Физика молекулЭнергия молекулПоясним сказанное рисунком. 3?
- 16. Физика молекулАтомные спектрыРассмотрим этот вопрос на примере
- 17. Физика молекулАтомные спектрыДадим несколько определений. Потенциал возбуждения
- 18. Физика молекулАтомные спектрыЕсли атом водорода переходит из
- 19. Физика молекулАтомные спектрыВвиду дискретности энергетического спектра, спектры
- 20. Физика молекулАтомные спектрыглавное квантовое число, соответствующее состоянию
- 21. Физика молекулАтомные спектрыE,эВm=n+1, n+2,…- это главное квантовое
- 22. Физика молекулАтомные спектрыУчитывая известное нам квантование энергии
- 23. Физика молекулАтомные спектрыСпектры водородоподобных ионов тоже линейчатые,
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Физика молекул
ПЛАН
Физика молекул
1) Типы связей атомов в молекуле
2) Энергия молекул
3)
Атомные, молекулярные и рентгеновские спектры
Слайд 2Физика молекул
Типы связей атомов в молекуле
1?
Для простоты мы будем рассматривать
только двухатомные молекулы.
1-й тип – ионная связь или гетерополярная
– это чисто кулоновское взаимодействие (Na, KCl, KBr, HСl и другие);2-й тип – ковалентная или атомная или гомеополярная (H2, O2, N2, CN, Si в кристалле
3-й тип – диполь-дипольная или Ван-дер-Ваальса (молекулы инертных газов).
Ионная – эта связь возникает между электроположительными и электроотрицательными атомами.
Пример NaCl. Натрий имеет электронную конфигурацию Na11=KL3S1 с двумя заполненными оболочками и одним электроном в третьей оболочке.
Остановимся немного подробней на каждой из них.
Слайд 3Физика молекул
Типы связей атомов в молекуле
Чтобы стать ионом с устойчивой
конфигурацией неона, он отдает этот один электрон и становится положительным
ионом. Хлор, которому не хватает одного электрона до заполнения под-оболочки S в третьей оболочке (n=3), легко принимает один электрон от натрия, становясь отрицательным ионом. Образуется молекула NaCl, в которой взаимодействуют два иона противоположных знаков (притягиваются).Энергия связи последнего электрона Na +5.1 эВ, энергия сродства у Cl -3.8 эВ. Энергия притяжения Na+ и Cl- -5.5 эВ. Баланс энергий +5.1эВ – 3.8 эВ – 5.5 эВ = -4.2 эВ. Энергия выделяется – молекула устойчива.Ковалентная – этот тип связи присущ всем молекулам простых газов, например, H2. Каждый из атомов водорода отдает по одному электрону в «общее пользование», т.е. их обнаружить одинаково вероятно вблизи каждого из ядер атомов. Энергия выделяется – молекула устойчива.
Слайд 4Физика молекул
Типы связей атомов в молекуле
Диполь-дипольная – этот тип связи
присущ всем молекулам на ранней стадии их образования, когда атомы
еще расположены относительно далеко друг от друга. На этой стадии электронные оболочки перекрываются очень слабо. Энергия связи этого типа очень мала. Диполь из сближающихся атомов образуется за счет колебаний электронных оболочек – это мгновенные диполи. Их направления все время меняются, но при сближении они всегда ориентированы друг к другу разноименными полюсами, т.е. атомы притягиваются друг к другу. При дальнейшем сближении атомов электронные оболочки все более перекрываются и формируется основной тип связи. Для инертных газов при их охлаждении это тип связи является основным при образовании молекулы. Энергия выделяется – молекула устойчива.Остановимся на закономерностях образования связей атомов в молекулах.
Слайд 5Физика молекул
Квантовая теория молекул
Рассмотрим этот вопрос на примере образования
простой молекулы с гомеополярной связью - молекулы водорода.
В 1927 году
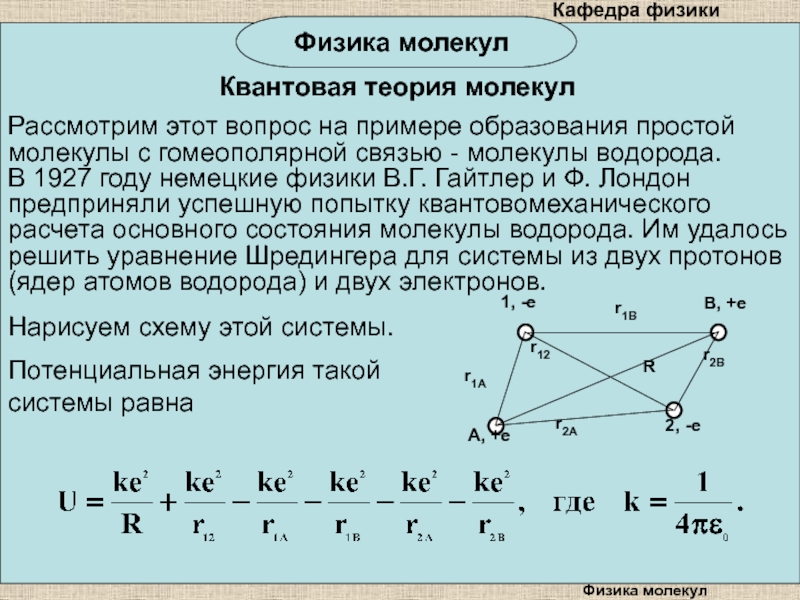
немецкие физики В.Г. Гайтлер и Ф. Лондон предприняли успешную попытку квантовомеханического расчета основного состояния молекулы водорода. Им удалось решить уравнение Шредингера для системы из двух протонов (ядер атомов водорода) и двух электронов. Нарисуем схему этой системы.
Потенциальная энергия такой системы равна
Слайд 6Физика молекул
Квантовая теория молекул
Ядра имеют массу в 1840 раз,
превышающую массу электрона. Поэтому они движутся гораздо медленнее электронов и,
в первом приближении, их можно считать неподвижными(Екин=0). В этом приближении уравнение Шредингера имеет видгде 1 - оператор Лапласа, содержащий координаты одного из электронов; 2- оператор Лапласа, содержащий координаты другого электрона.
Получающиеся из уравнения Шредингера собственные пси-функции являются стандартными только при собственных значениях энергии, зависящих от расстояния между ядрами – E=E(R). Причем, в случаях параллельной и анти-параллель-ной ориентаций спинов электронов, характер этих зависимостей существенно различен.
Слайд 7Физика молекул
Квантовая теория молекул
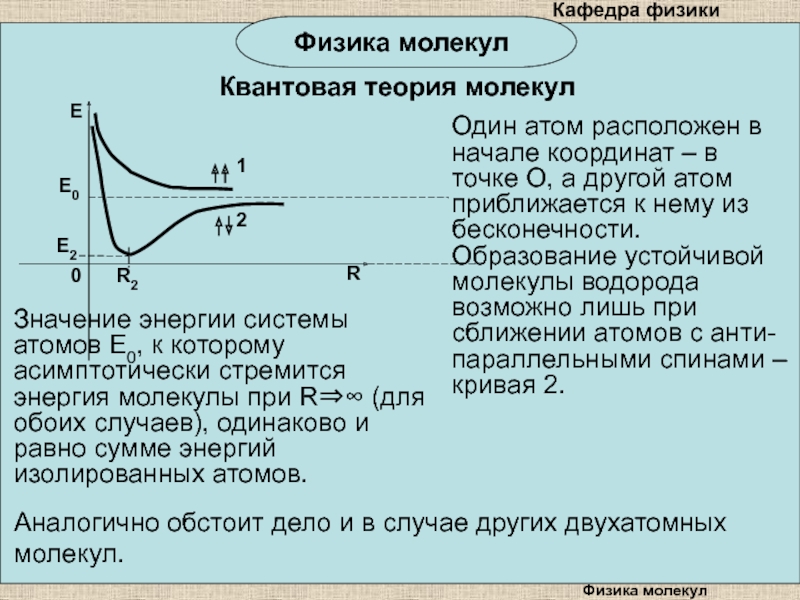
Один атом расположен в начале координат
– в точке О, а другой атом приближается к нему
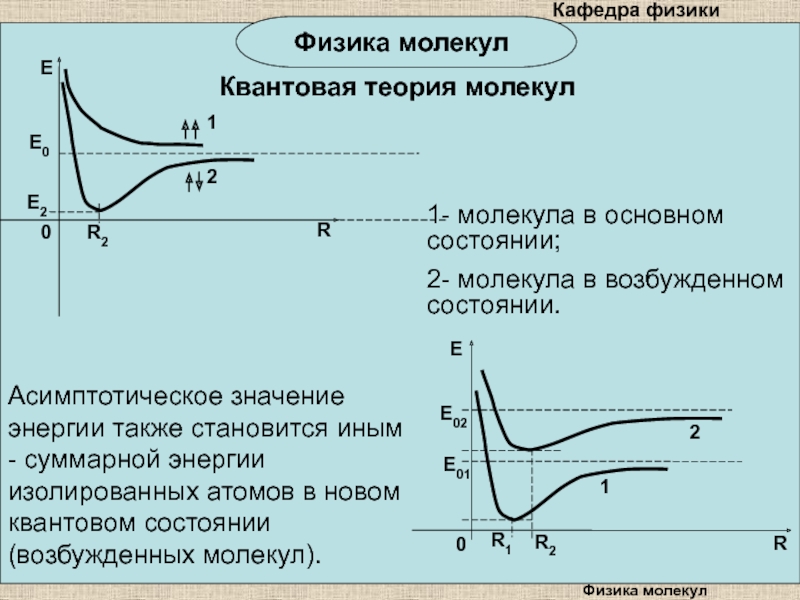
из бесконечности. Образование устойчивой молекулы водорода возможно лишь при сближении атомов с анти-параллельными спинами – кривая 2.Значение энергии системы атомов E0, к которому асимптотически стремится энергия молекулы при R (для обоих случаев), одинаково и равно сумме энергий изолированных атомов.
Аналогично обстоит дело и в случае других двухатомных молекул.
Слайд 8Физика молекул
Квантовая теория молекул
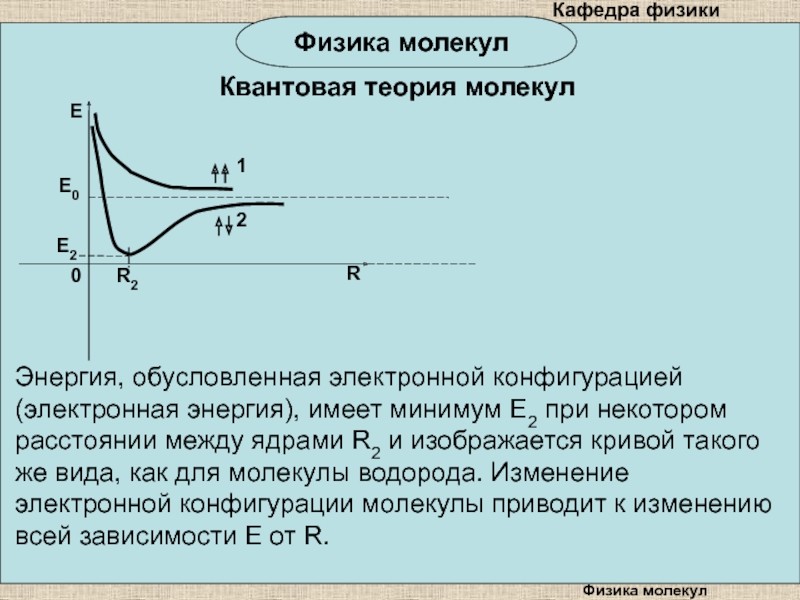
Энергия, обусловленная электронной конфигурацией (электронная энергия),
имеет минимум E2 при некотором расстоянии между ядрами R2 и
изображается кривой такого же вида, как для молекулы водорода. Изменение электронной конфигурации молекулы приводит к изменению всей зависимости E от R.Слайд 9Физика молекул
Квантовая теория молекул
Асимптотическое значение энергии также становится иным
- суммарной энергии изолированных атомов в новом квантовом состоянии (возбужденных
молекул).1- молекула в основном состоянии;
2- молекула в возбужденном состоянии.
Слайд 10Физика молекул
Энергия молекул
Основное изменение энергии молекулы происходит, как и в
атоме, в результате изменений электронной конфигурации, образующей внешнюю часть молекулы.
Однако, при заданной электронной конфигурации ядра молекулы могут различным образом колебаться и вращаться относительно общего центра масс. 2?Введем обозначения: Ee – энергия, обусловленная электронной конфигурацией (электронная энергия); EV - энергия, соответствующая колебаниям молекулы (колебательная или вибрационная энергия); Er - энергия, связанная с вращением молекулы (вращательная или ротационная энергия).
В первом приближении отдельные виды молекулярных движений – движение электронов, колебание и вращение молекулы – можно считать независимыми друг от друга. Поэтому полную энергию молекулы можно представить в виде E=Ee+EV+Er.
Слайд 11Физика молекул
Энергия молекул
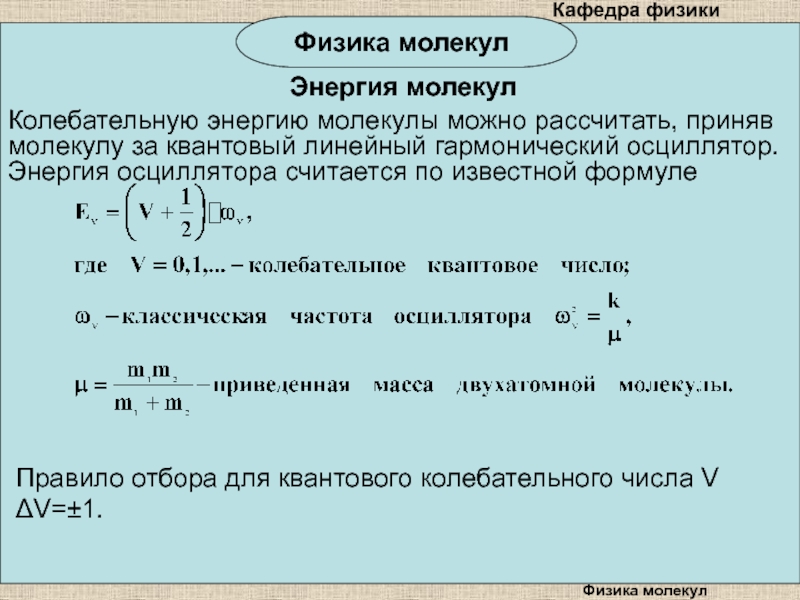
Колебательную энергию молекулы можно рассчитать, приняв молекулу за
квантовый линейный гармонический осциллятор. Энергия осциллятора считается по известной формуле
Правило отбора для квантового колебательного числа V V=1.
Слайд 12Физика молекул
Энергия молекул
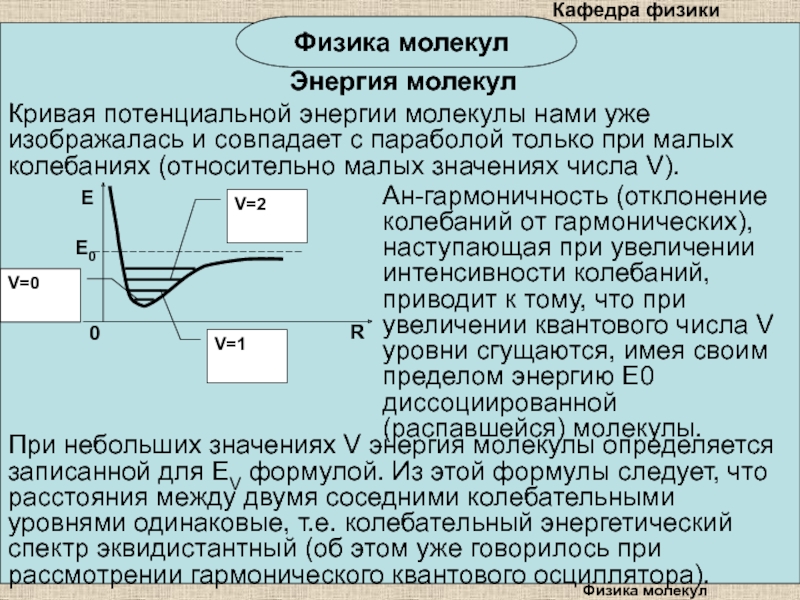
Кривая потенциальной энергии молекулы нами уже изображалась и
совпадает с параболой только при малых колебаниях (относительно малых значениях
числа V).Ан-гармоничность (отклонение колебаний от гармонических), наступающая при увеличении интенсивности колебаний, приводит к тому, что при увеличении квантового числа V уровни сгущаются, имея своим пределом энергию E0 диссоциированной (распавшейся) молекулы.
При небольших значениях V энергия молекулы определяется записанной для EV формулой. Из этой формулы следует, что расстояния между двумя соседними колебательными уровнями одинаковые, т.е. колебательный энергетический спектр эквидистантный (об этом уже говорилось при рассмотрении гармонического квантового осциллятора).
Слайд 13Физика молекул
Энергия молекул
Обратимся к вопросу о вращательной энергии. Энергия системы,
имеющей момент инерции I и вращающейся с угловой скоростью r,
равнагде M=Ir- момент импульса системы.
В квантовой механике момент импульса квантуется и может принимать значения, соответствующие выражению
вращательное квантовое число.
Следовательно, вращательная энергия молекулы может иметь отдельные значения, т.е. вращательная энергия квантуется
где I =d2- момент инерции молекулы, - приведенная масса, d- межядерное расстояние.
Слайд 14Физика молекул
Энергия молекул
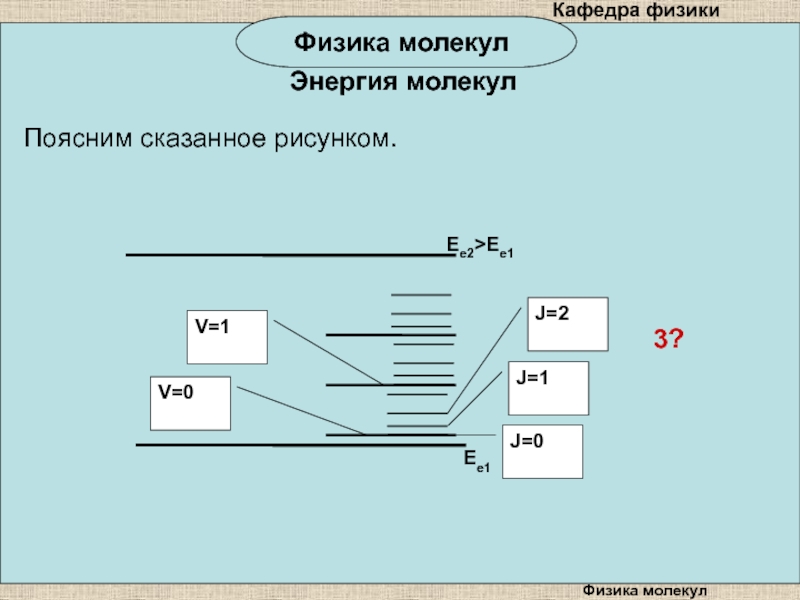
Для вращательного квантового числа правило отбора - J=1.
Итак, полная энергия молекулы равна
Опыт и теория показывают, что
расстояния между вращательными энергетическими уровнями Er значительно меньше расстояний между колебательными уровнями EV, которые в свою очередь значительно меньше, чем расстояния между электронными уровнями Ee, т.е. Ee>>EV>>Er. С ростом вращательного квантового числа J разность энергий между двумя соседними энергетическими
уровнями Er увеличивается.
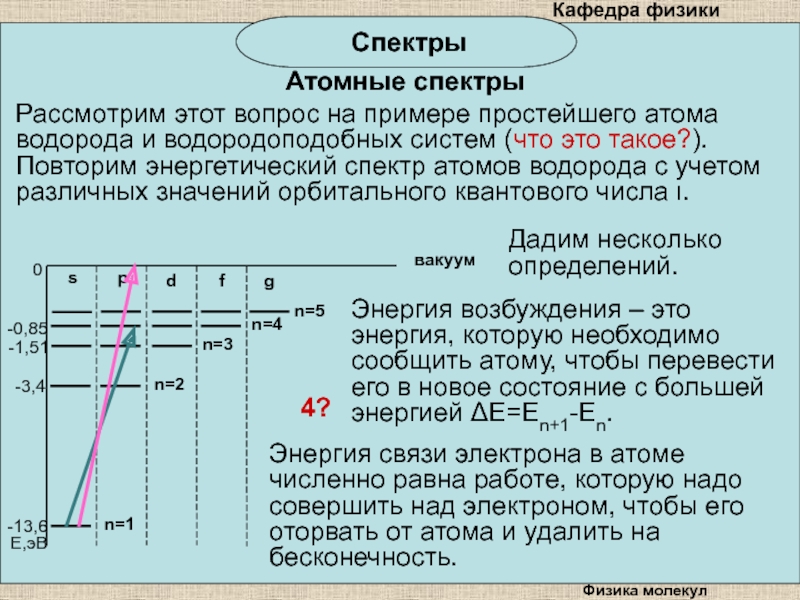
Слайд 16Физика молекул
Атомные спектры
Рассмотрим этот вопрос на примере простейшего атома водорода
и водородоподобных систем (что это такое?). Повторим энергетический спектр атомов
водорода с учетом различных значений орбитального квантового числа .4?
Дадим несколько определений.
Энергия возбуждения – это энергия, которую необходимо сообщить атому, чтобы перевести его в новое состояние с большей энергией E=En+1-En.
Энергия связи электрона в атоме численно равна работе, которую надо совершить над электроном, чтобы его оторвать от атома и удалить на бесконечность.
Слайд 17Физика молекул
Атомные спектры
Дадим несколько определений.
Потенциал возбуждения – это разность
потенциалов между двумя точками внешнего электрического поля, пройдя которую свободный
электрон приобретает энергию qU, достаточную для возбуждения атома водорода при столкновении с ним (или другого какого-то атома). qUвоз=Eвоз, Uвоз= Eвоз/q.Слайд 18Физика молекул
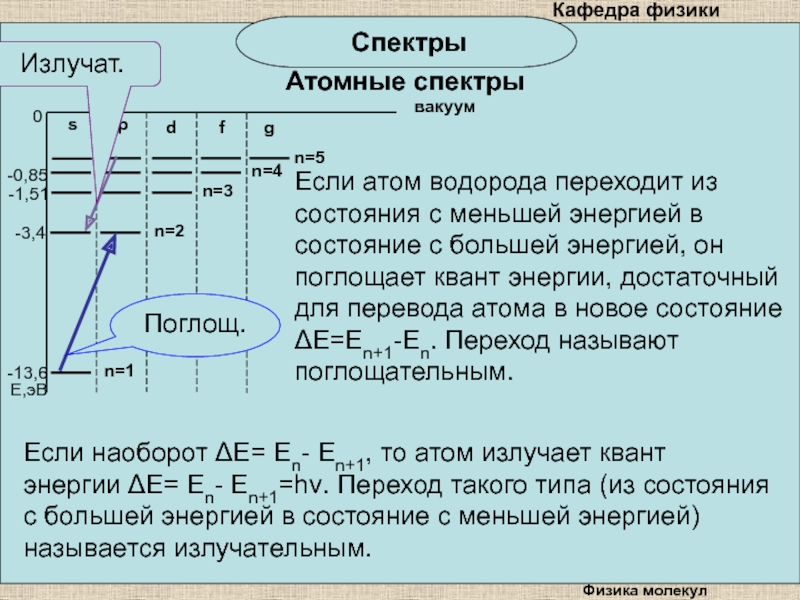
Атомные спектры
Если атом водорода переходит из состояния с меньшей
энергией в состояние с большей энергией, он поглощает квант энергии,
достаточный для перевода атома в новое состояние E=En+1-En. Переход называют поглощательным.Поглощ.
Излучат.
Если наоборот E= En- En+1, то атом излучает квант энергии E= En- En+1=h. Переход такого типа (из состояния с большей энергией в состояние с меньшей энергией) называется излучательным.
Слайд 19Физика молекул
Атомные спектры
Ввиду дискретности энергетического спектра, спектры поглощения спектры излучения
будут представлять собой совокупность отдельных линий, соответствующих фотонам с различными
длинами волн. Такие спектры называют линейчатыми или дискретными. Все невзаимодействующие атомы имеют линейчатые спектры.Впервые формулу для линий в видимой части спектра излучения атомов водорода в 1885 году предложил Бальмер (швейцарский физик), поэтому совокупность наблюдаемых линий спектра называется серией Бальмера. Формула Бальмера имеет вид
некоторая константа.
Позже эта формула была обобщена и имеет вид
Слайд 20Физика молекул
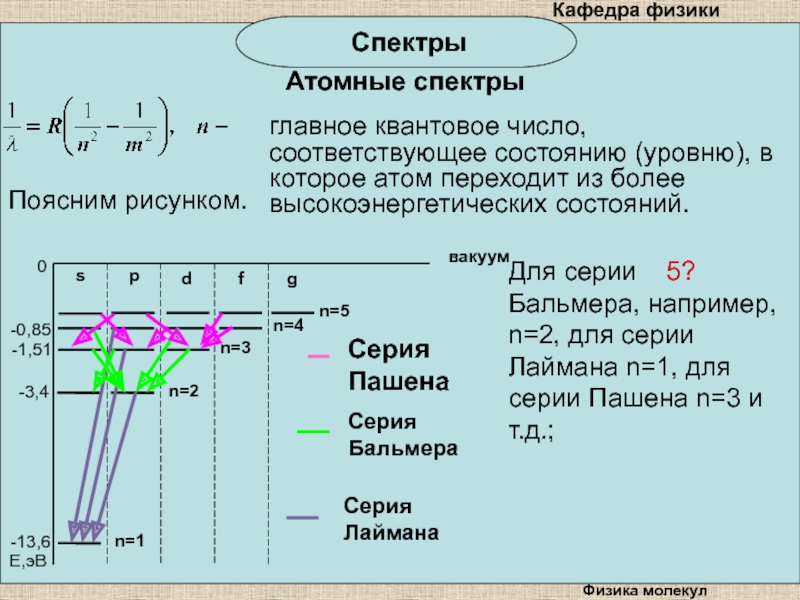
Атомные спектры
главное квантовое число, соответствующее состоянию (уровню), в которое
атом переходит из более высокоэнергетических состояний.
Поясним рисунком.
Для серии
5? Бальмера, например, n=2, для серии Лаймана n=1, для серии Пашена n=3 и т.д.; Слайд 21Физика молекул
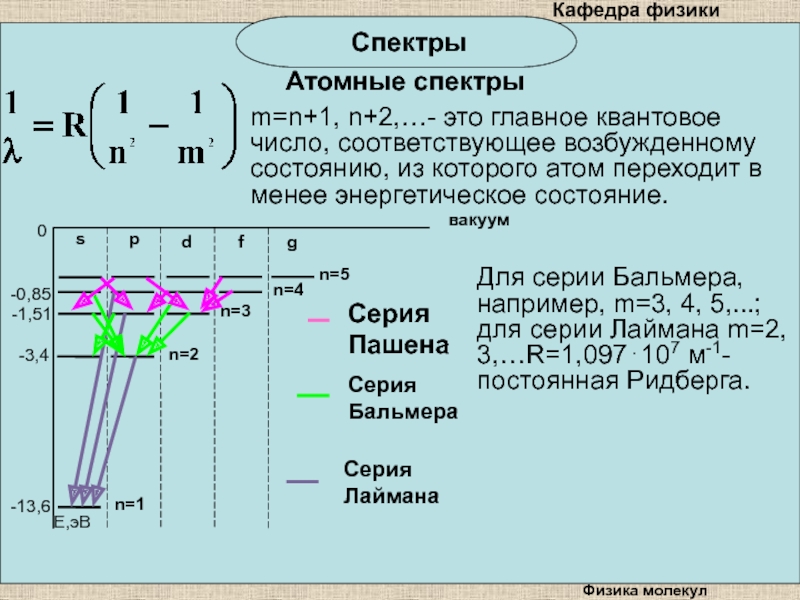
Атомные спектры
E,эВ
m=n+1, n+2,…- это главное квантовое число, соответствующее возбужденному
состоянию, из которого атом переходит в менее энергетическое состояние.
Для
серии Бальмера, например, m=3, 4, 5,...; для серии Лаймана m=2, 3,…R=1,097107 м-1- постоянная Ридберга. Слайд 22Физика молекул
Атомные спектры
Учитывая известное нам квантование энергии атома водорода, мы
эту формулу можем получить следующим образом:
Каждая из серий имеет
границы: коротковолновую - m, 1/min=R/n2 и длинноволновую – m=n+1,Слайд 23Физика молекул
Атомные спектры
Спектры водородоподобных ионов тоже линейчатые, но более сложные
по структуре – числу линий и их расположении по длинам
волн. Это обусловлено тем, что их ядра имеют заряд, более одного протона, т.е. Z>1.Обобщенная формула для линий спектров водородоподобных ионов имеет вид
Все энергии (возбуждения, ионизации и т.д.) для водородоподобных ионов отличаются в Z2 раз от аналогичных для атома водорода.