Слайд 1ФИЗИКАЛЫҚ ЖӘНЕ КОЛЛОИДТЫҚ ХИМИЯ ПӘНІ
1-ші БӨЛІМ:
ФИЗИКАЛЫҚ ХИМИЯҒА КІРІСПЕ
Слайд 2 “Физикалық химия” деген сөзді алғаш рет ғылыми термин ретінде қолданған
— М. В. Ломоносов. Ол әлемде бірінші болып 1752 жылы
физикалық химиядан 4 сағаттық лекция оқыған.
Ломоносовтан кейін, Харьковтегі политехникалық институттың профессоры Н. Н. Бекетов 1865 жылы физхимия лекциясын біршама молайтып, тұрақты оқи бастаса, Москва мемлекеттік университетінің профессоры Н. Н. Любавин (1845—1918) орыс тіліндегі бірінші оқулықты құрастырған. Оның “Физикалық химия” еңбегі 1877 жылы басылады да, толықтырылып “Техникалық химия” деген атпен 1904 –1914 жылдары 6 томдық болып шығады.
Слайд 3 Шет елдік ғалымдар да физхимияның дамуына өз үлестерін қосты. Мысалы,
Д. Дальтон зерттеулері атом құрылысы, М. Фарадей еңбегі электрохимия хақында
болса, Д. Гиббс химиялық термодинамиканы қалыптастырушылардың бірі, В. Нернст термодинамика мен электрохимияға бірдей еңбек сіңірсе, С, Аррениус электролиттік диссоциация теориясын ұсынды, Я. Вант-Гофф ерітінділерді, химиялық кинетика мен тепе-теңдікті, В. Оствальд электрохимия мен адсорбцияны зерттеді.
Физхимияның үлкен бір тарауы, қазір өз алдына жейе ғылым атанған коллоидтық химияның қалыптасып дамуына Т. Грэм, М. Смолуховский, А. Эйнштейн, Ж- Перрен, Г. Сведберг, Г. Кройт және орыс ғалымдары Ф. Рейс, И. Борщов, Б. Дерягин, Н. Песков т. б. зор үлес қосты.
XX ғасырда пайда болған квантты-механикалық толқынды теория жалпы табиғаттану іліміне, әсіресе, физика мен химияға жаңа ұғымдар әкелді (Н. Бор, М. Планк, Шредингер, Паули). Квантты-механикалық теорияны пайдалаңып, атом және молекула, кристалл қүрылысын ашып қана қоймай, ондағы кейбір деректерді есептеп, анықтауға, химиялық байланыс табиғатын түсіндіруге болады.

Слайд 4 Қазақстандағы химия ғылымының дамуы С. М. Киров атындағы мемлекеттік университетіндегі
химия факультеті (1934) мен республика Ғылым Академиясының Химия ғылымдары институтының
(1940) ашылуымен байланысты. Республикамыздағы химия ғылымы көш басында қышқылдар мен негіздердің жаңа теориясын ұсынған М. И. Усанович, фосфат тыңайтқышының технологиясын зерттеген Ә. Бектұров, аналитикалық химия саласында М. Т. Козловский, жалпы химияда Б. Бірімжанов, органикалық химияда Е. Әзірбаев, катализде Д. В. Сокольский және көптеген химик-ғалым, ұстаздар болды. Б. А. Жұбанов, Е. Е. Ерғожин, Е. Ә. Бектұров, сияқты ғалымдар оны онан әрі дамытып келеді.
Слайд 5Физикалық химия бірнеше тарауға бөлінеді:
Зат қурылысы — атомдар мен молекулалар арасындағы
ішкі құрылыс пен олардың өзара қатынастарын, физикалық және химиялық қасиеттерін
зерттейтін тарау. Мұнда молекула геометриясы, молекуланың ішкі қозғалысы мен оған әсер етуші күш табиғаты және сол сияқты молекулалар арасында күштер зерттеледі.
Химиялык термодинамика — әр түрлі жағдайлардағы физикалық және химиялық өзгерістердің жылу балансын есептеп, өзгерістердің бағыты мен мүмкіндігін анықтайтын бөлім. Химиялық термодинамиканың көмегімен физикалық және химиялық тепе-теңдіктің негізгі заңдылығы анықталып, температура, қысым, концентрация сияқты өлшемдердің бірі не бірнешеуі өзгергендегі тепе-теңдік заңдылығынын құбылысы, түрленуі, қалайша алмасатыны зерттеледі.
Слайд 6Ерітінді бөлімінде еріткіш пен еритін заттардың табиғаты, олардың қүрылысы қарастырылады, еру
кезінде болатын өзгерістер мен ондағы химиялық реакциялардың ерекшелігі көрсетіледі.
Электрохимия материяның
электрлік және химиялық түрдегі қозғалысының бір турден екінші түрге өту заңдылығың, құрылысы мен электролиттік ерітінділердің қасиеттерін, электролиз, процестерін, электрохимиялық элемент жұмыстарын, металдардың электрохимиялық тотығуын (коррозиясын), заттарды электр көмегімен алу әдістерін зерттейді.
Химиялық кинетика мен катализ бөлімінде химиялық реакциялардың жылдамдығы мен олардың молекулалык механизміне арналған жалпы мәселелер, гетерогенді процестер мен олардын жылдамдығына температура, қысым, еріткіш, катализаторлардың әсерлері қарастырылады.
Слайд 7Заттың агрегаттық күйі оның негізгі физика-химиялық сипаттамасы. Заттар сыртқы ортаға
(температура мен қысым) байланысты төрт түрлі аграгеттық күйде бола алады:
газ, сұйық (бу), қатты және плазма.
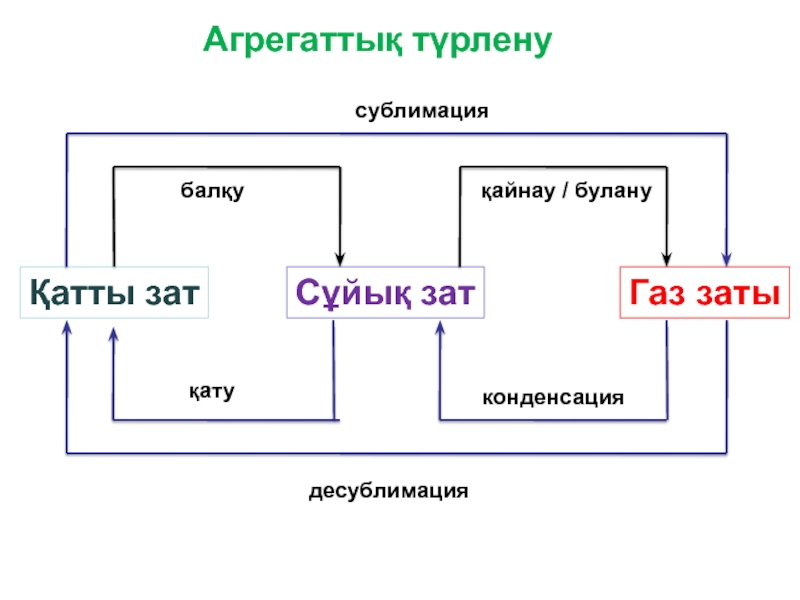
Заттың бір агрегаттық күйден екінші күйге ауысуы агрегаттық түрлену деп аталады. Көптеген заттар белгілі бір температура мен қысымда бірден үш күйде бола алады. Мысалы, су – ол бу, сұйық және қатты мұз күйінде болуы мүмкін. Кейбір заттар тек бір не екі күйге ұшырайды. Мысалы мышьяк, йод және нафталин қатты күйден бірден газға айналуы мүмкін. Ал кальций карбонаты сұйық және газ күйінде бола алмайды. Қатты затты сұйық күйге ауыстырмай бірден газға айналдыру әдісі – айдау, ал процестің өзі сублимация деп аталады.
Заттардың бір агрегаттық күйден екінші күйге ауысуы жүйе энергиясының өзгеруімен жүреді. Мысалы, балқу, булану кездерінде жылу сіңіріліп, ал конденсациялану және кристалдану кездерінде жылу бөлініп шығатын болады. Қатты және сұйық күй заттардың конденсацияланған күйлері деп аталады. Заттың қатты күйден сұйық күйге ауысуына, сұйық күйден газ күйіне ауысуына қарағанда, энергия аз жұмсалады. Олай болса, балқу жылуы оның булану жылуынан әрқашан аз болады.

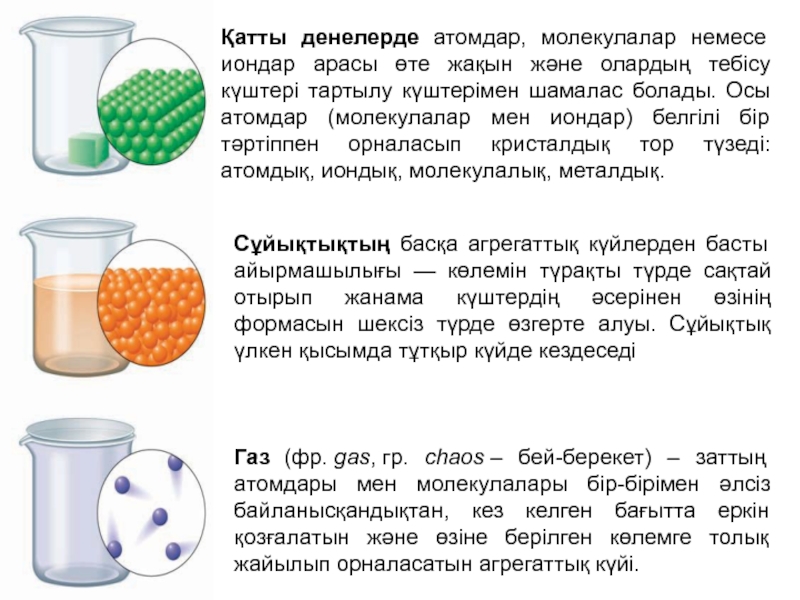
Слайд 8Газ (фр. gas, гр. chaos – бей-берекет) – заттың атомдары мен молекулалары бір-бірімен
әлсіз байланысқандықтан, кез келген бағытта еркін қозғалатын және өзіне берілген
көлемге толық жайылып орналасатын агрегаттық күйі.
Сұйықтықтың басқа агрегаттық күйлерден басты айырмашылығы — көлемін түрақты түрде сақтай отырып жанама күштердің әсерінен өзінің формасын шексіз түрде өзгерте алуы. Сұйықтық үлкен қысымда тұтқыр күйде кездеседі
Қатты денелерде атомдар, молекулалар немесе иондар арасы өте жақын және олардың тебісу күштері тартылу күштерімен шамалас болады. Осы атомдар (молекулалар мен иондар) белгілі бір тәртіппен орналасып кристалдық тор түзеді: атомдық, иондық, молекулалық, металдық.
Слайд 9Агрегаттық түрлену
Қатты зат
Сұйық зат
Газ заты
балқу
қайнау / булану
қату
конденсация
сублимация
десублимация
Слайд 10Кез келген агрегаттық күйде болатын заттың табиғатын, құрамын, құрылысын және
заттарды идентификациялауда заттың жеке физикалық қасиеттерінің маңызы зор, мысалы диполь
моменті, диэлектрлік өткізгіштік, рефракция құбылысының, оның негізінде затың сыну көрсеткіші деп аталатын физикалық шамасы анықталады. Мысалы, сыну көрсеткіші арқылы май, сыра, жеміс пен көкеніс шырындардың, арақ-шараптардың сапасын білуге, қан, асқазан шырындарын талдауға қолданады.
Слайд 11i2
i1
1
2
Жарық сәулесі екі мөлдір біртекті орталардың (1 және 2) бөлу
шекарасымен қиылысқанда, сәуленің бағыты сыну заңы бойынша өзгереді.
i1 –
түсу бұрышы
i2 – сыну бұрышы
n2_1 – сынудың салыстырмалы көрсеткіші (коэффициенті)
1)
Слайд 12Жарықтың толқындық теориясы сыну көрсеткіші мен екі ортадағы жарықтық толқындардың
таралу жылдамдықтарының (1 және 2) арасындағы қарапайым байланысты анықтайды:
2)
Сыну көрсеткішіне
заттың физика-химиялық қасиеттерімен қатар ортаның сыртқы факторлары әсер етеді. Толқындық теория сыну көрсеткішін вакуумдағы және белгілі ортадағы жарықтың жылдамдықтарымен байланыстырады:
Слайд 13Заттың сыну көрсеткіші оның табиғатымен анықталады, бірақ сыртқы ортаның температурасына
және жарық толқынының ұзындығына, заттың тығыздығы мен поляризациялануына тәуелді болады.
Толқын ұзындыңы төменгі индексінде, ал температураны жоғарғы индексінде көрсетеді:
яғни 25 температурада толқын ұзындығы 480нм (4800A) болатын кадмийдің көк сызығына сәйкес келетін сыну көрсеткіші.
Оптикалық анизотропты заттардың сыну көрсеткішін анықтау арқылы минералдардың идентификациясын өткіздеді.
Заттың тығыздығының өзгеруімен қатар оның сыну көрсеткіші де өзгереді, яғни тығыздық артқан сайын сыну көрсеткішінің мәні де артады және бұл тура пропорционалды тәуелділікті белгілі функция түрінде көрсетуге болады:
3)
Мұндағы f(n) – сыну көрсеткішінің белгілі функциясы, d – заттың тығыздығы, r – меншікті рефракция деп аталатын және сол затқа тән болып келетін тұрақты коэффициент. Меншікті рефракция n және d-мен салыстырғанда сыртқы ортаның температурасына және заттың агрегаттық күйіне тәуелді емес.
Слайд 14Ньютон жарықтың сынуын жарықтық бөлшектерінің затпен тартылуы деп қарастырғандықтан, және
деп есептеген. Бұл функцияның математикалық
нәтижесін Лаплас тауып, меншікті рефракцияның мәнін келесі формуламен есептеуге ұсынды:
4)
Ньютон – Лаплас теңдеуі деп аталады
XIX ғас. басында Ньютон – Лаплас формуласының газдарға қолданылуы тиімділігі дәлелденді. 1863ж. Гладстон мен Даль сұйықтарды қыздыру барысында Ньютон – Лапластың меншікті рефракциясы тұрақсыз болады екенін дәлелдеп, сұйықтар үшін келесі қарапайым теңдеуді ұсынды:
Гладстон – Даль теңдеуі
5)
Слайд 151880 ж. Г.А.Лорентц пен Л.Лоренц әрқайсысы жеке және әртүрлі жолдармен
f(n) функциясы келесі түрге ие болады деп бір шешімге келді:
Сонда меншікті рефракция келесі түрге ие болады:
Лорентц – Лоренц теңдеуі
6)
Г.А.Лорентц өз теңдеуін Максвеллдің электромагниттік теориясының негізінде шығарды. Сонымен қатар 6-ші теңдеудің формуласын Клаузиус – Мосоттидің диэлектрліктердің электрлік поляризациясы теориясынан алуға болатынын көрсетілген.
Слайд 16Электр өрісінде молекуланың бағытталуы және атомдар мен электрондардың қозғалуы поляризация
(П) деп аталады. Молекуланың поляризациясы электрондық (Пэл), атомдық (Пат) және
бағытталған (Пор) поляризациялардың қосындысынан тұрады:
Поляризация шамасы молекуланың поляризациялану мүмкіндігіне (α) тәуелді:
Электр өрістің әсерінен молекуланың деформациясын сипаттайтын пропроционалдық коэффициент α – поляризациялану деп аталады. Атомдық және электрондық α температураға тәуелді емес, ал αор абсолюттік температураға кері пропорционал, себеі молекулалардың ретсіз жылулық қозғалысы ориентацияны яғни бағытталуды бұзады.
Диэлектриктің поляризациясы Дебай теңдеуімен анықталады:
мұндағы ε – заттың диэлектрлік өткізгіштігі
М – заттың молекулярлық салмағы
d – заттың тығыздығы
7)
Слайд 17Молекуланың поляризациясы температураға тәуелділігі келесі теңдеумен өрнектеледі:
NA – Авогадро саны
(6,024*1026)
µ – молекуланың диполь моменті
– Больцман тұрақтысы (1,38*10-23 Дж/град)
7-ші және
8-ші теңдеулерді өзара теңестіру нәтижесінде Клаузиус – Мосотти теңдеуін алуға болады:
8)
9)
Полярлы емес молекулалардың поляризациясы (П) температураға тәуелді емес, себебі олардың диполь моменті 0-ге тең:
Слайд 18Диполь моменті – диполь молекуласының (полярлы молекула) негізгі векторлық сипаттамасы.
Егер молекуланың оң және теріс зарядтардың орталықтары сәйкес келмесе, қандай
да бір қашықтықта орналасса, онда ол диполь қасиетіне ие болып, полярлы молекула деп аталады. Молекуланың полярлығының өлшемі ретінде диполь моменті () алынады. Дипольдің электрлік моменті оның заряды (e) мен диполь ұзындығының (l) көбейтіндісіне тең шама:
Тәжірибе жүзінде молекуланың диполь моменті диэлектрлік өткізгіштік арқылы анықтауға болады. Заттың диэлектрлік өткізгіштігі () – вакууммен салыстырғандағы белгілі заттың ортасында зарядтардың әрекеттесуі неше есе әлсіздеу екенін көрсететін сан. Сонымен қатар шамасы молекуланың геометриялық құрылымы туралы маңызды информацияны береді. Мысалы (CO2) 0D сызықты молекула, (SO2) 1,61D үшбұрышты молекула болады.
Слайд 198-ші теңдеуден П шамасы арқылы молекуланың диполь моментін анықтауға болады.
Поляризация шамасын табу үшін зерттелетін заттың диэлектрлік өткізгіштікпен тығыздығын бірнеше
температураларда өлшейді де, алынған шамалар бойынша график сызылып, шамасы анықталады:
П
В = tg
Слайд 20ат шамасы молекуланың поляризациясында (П) 5 – 8% ғана құрайды,
сондықтан оны ескермеуге де болады, және коэффицент А=RM тең деп
есептегенде , d, n шамалары тек бір температураның мәнінде өлшенеді:
RM – заттың молярлық рефракциясы сол заттың электрондық поляризациясын (Пэл) сипаттайды. Молярлық рефракция заттың агрегаттық күйіне және температураға тәуелді емес. Молярлық рефракция меншікті рефракциясының заттың молекулалық салмағына көбейтіндісіне тең болады:
10)
Лорентц – Лоренц (6-ші) теңдеуді қолдана отырып, молярлық рефракция формуласын түрлендіреміз:
11)
Газдар үшін:
12)
Слайд 21Химиялық термодинамика және термохимия
Слайд 22Жоспар
Термодинамикалық жүйе, олардың жіктелуі, жүйенің экстенсивті және интенсивті қасиеттері. Жүйенің
күйі.
Жүйенің күй функциялары (U – ішкі энергия, H –
энтальпия, S – энтропия, G – Гиббс энергиясы) және термодинамика заңдары.
Слайд 23Термодинамика (“термо” – жылу, “динамика” – қозғалыс) – энергияның бір
түрден басқа түрге айналу заңдылықтарын зерттейтін ғылым
Слайд 24Химиялық термодинамиканың зерттеу объектісі –
термодинамикалық жүйе (химиялық реакция, үдеріс,
химиялық зат)
Айналадағы ортадан ойша бөлінген дене немесе өзара
әрекеттескен денелер
тобы термодинамикалық жүйе деп аталады.
Кейбір интенсивті
қасиеттері
кеңістікте үздіксіз
өзгеретін жүйе –
үздіксіз (шексіз)
Жүйе ішінде
бөлу беті болмай,
барлық нүктелерінде
қасиеттері бірдей жүйе – гомогендік жүйе
Жүйеде
бөлу беті
болса
– гетерогенді жүйе
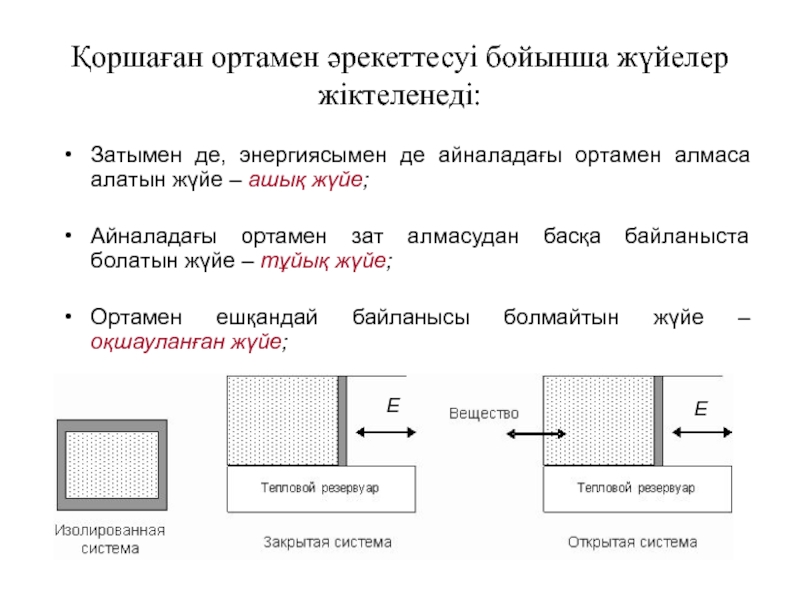
Слайд 25Қоршаған ортамен әрекеттесуі бойынша жүйелер жіктеленеді:
Затымен де, энергиясымен де айналадағы
ортамен алмаса алатын жүйе – ашық жүйе;
Айналадағы ортамен зат алмасудан
басқа байланыста болатын жүйе – тұйық жүйе;
Ортамен ешқандай байланысы болмайтын жүйе – оқшауланған жүйе;
Е
Е
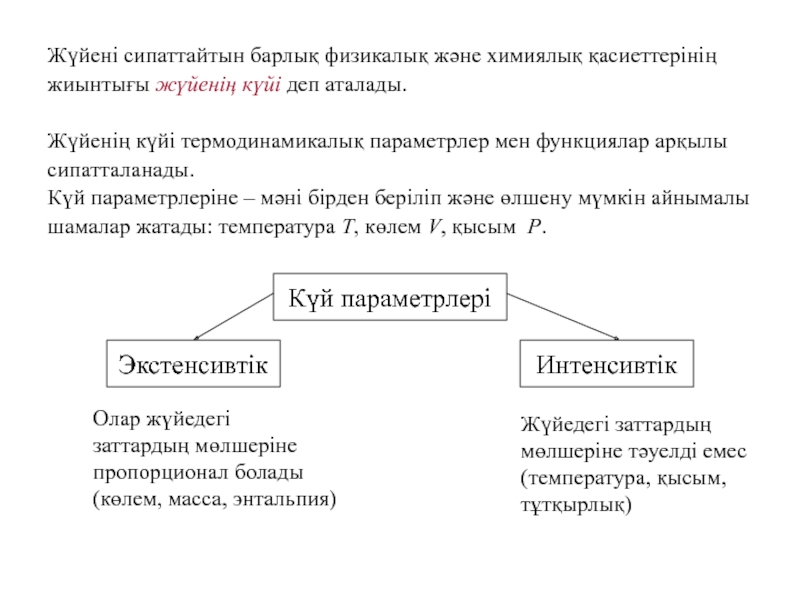
Слайд 26Жүйені сипаттайтын барлық физикалық және химиялық қасиеттерінің
жиынтығы жүйенің күйі
деп аталады.
Жүйенің күйі термодинамикалық параметрлер мен функциялар арқылы
сипатталанады.
Күй
параметрлеріне – мәні бірден беріліп және өлшену мүмкін айнымалы
шамалар жатады: температура T, көлем V, қысым P.
Күй параметрлері
Экстенсивтік
Интенсивтік
Олар жүйедегі
заттардың мөлшеріне
пропорционал болады
(көлем, масса, энтальпия)
Жүйедегі заттардың
мөлшеріне тәуелді емес
(температура, қысым,
тұтқырлық)
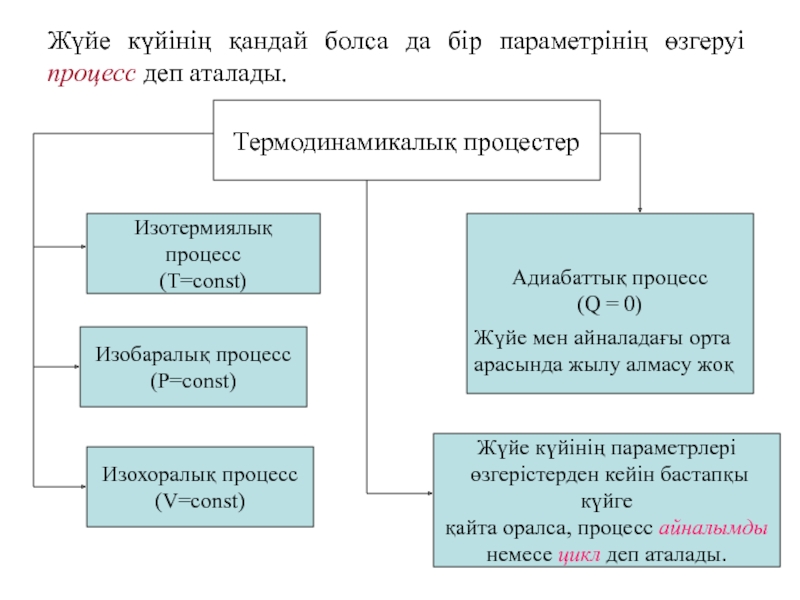
Слайд 27Жүйе күйінің қандай болса да бір параметрінің өзгеруі процесс деп
аталады.
Термодинамикалық процестер
Изотермиялық процесс
(T=const)
Изобаралық процесс
(Р=const)
Изохоралық процесс
(V=const)
Адиабаттық процесс
(Q = 0)
Жүйе
мен айналадағы орта
арасында жылу алмасу жоқ
Жүйе күйінің параметрлері
өзгерістерден кейін бастапқы күйге
қайта оралса, процесс айналымды
немесе цикл деп аталады.
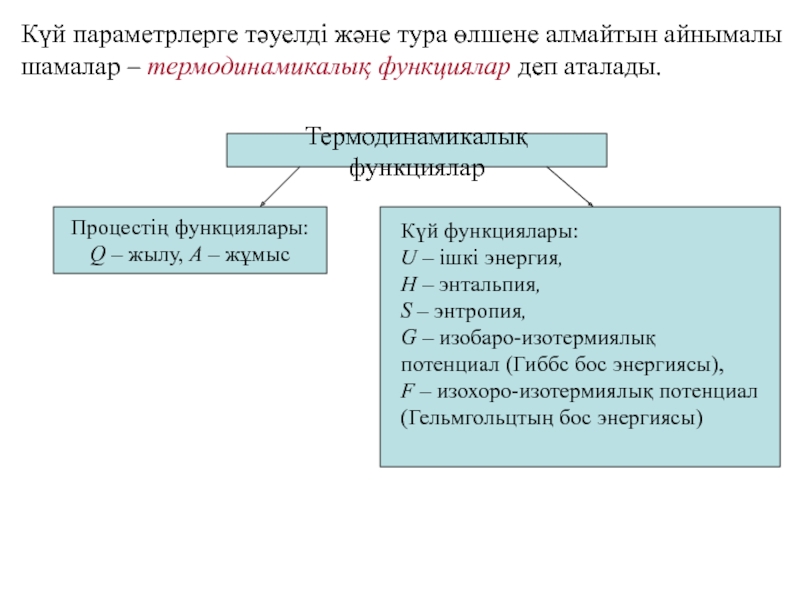
Слайд 28Күй параметрлерге тәуелді және тура өлшене алмайтын айнымалы шамалар –
термодинамикалық функциялар деп аталады.
Термодинамикалық функциялар
Процестің функциялары:
Q – жылу,
A – жұмыс
Күй функциялары:
U – ішкі энергия,
H – энтальпия,
S – энтропия,
G – изобаро-изотермиялық потенциал (Гиббс бос энергиясы),
F – изохоро-изотермиялық потенциал (Гельмгольцтың бос энергиясы)
Слайд 29Термодинамиканың I – заңы
Термодинамиканың бірініші заңы – бұл оқшауланған жүйенің
энергиясын сақтайтын заң: энергияның әр түрлі формалары бір-біріне тек эквивалентті
мөлшерде ауысады.
Жүйеге берілген жылу сол жүйенің ішкі энергиясын ұлғайтуға және сыртқы күштерге әсер ету үшін жұмысқа жұмсалады:
Ішкі энергияға жүйені құрайтын бөлшектердің (атом, электрон, ядро, молекулалар) қозғалысы мен өзара әрекеттесу энергияларының барлық түрі енеді де, жүйенің кинетикалық энергиясы мен сыртқы күштердің потенциалдық энергиясы кірмейді. Ішкі энергияның абсолюттік мәні анықталынбайды, бірақ оның өзерісін табуға болады:
Слайд 30Үдерістің жұмысы – бұл өзара әрекеттесу нәтижесінде бір денеден екінші
денеге берілетін энергия. Химиялық термодинамикада газдың ұлғаю жұмысы қарастырылады:
=>
Изохоралық
процестер үшін : V=const,
сонда
Изотермиялық процестер үшін : Т=const және U=const, dU=0 сонда:
Адиабаттық (сыртқы ортамен жылу арқылы алмасуы жоқ) процестер үшін : Q=0 сонда:
Изобаралық процестер үшін : р=const, dp=0 H – энтальпия деп аталатын күй функциясы қолданылады, ол: H=U+A=U+pV
Слайд 31Тұрақты қысым жағдайында химиялық реакцияның жылу эффектісі жүйенің энтальпия өзгерісіне
кері таңбамен тең болады:
Термохимияның екінші заңы – Гесс заңы (1840ж)
бойынша: реакцияның жылу
эффектісі (энтальпиясы) – реакцияның қандай жолмен жүруіне байланысты
емес, тек реакцияға қатысатын бастапқы заттардың және реакция
нәтижесінде түзілетін заттардың түріне және күйіне ғана байланысты, яғни:
Мұндағы
– сол заттың стандарттық түзілу жылуы, яғни 298К темпера-
турада, 1 атм қысымда түзілген қосылыстың 1 моліне жұмсалған жылудың мөлшері.
Сонымен, стандартты жағдайда (298К) келесі реакция үшін:
Слайд 32Химиялық реакциялардың жылу эффектісін зерттейтін химияның саласы – термохимия.
Жылу
бөлінетін реакциялар – экзотермиялық,
жылу сіңірілетін реакциялар – эндотермиялық
Слайд 33Термохимиялық теңдеулердің мысалдары:
2Н2 + О2 = 2Н2О + Q Н
= -571 кДж
(экзотермиялық реакция)
N2 + O2
= 2NO – Q Н = + 180,5 кДж
(эндотермиялық реакция)
Слайд 34Заттардың түзілу жылуы - жәй заттардан қосылыстың 1 молі түзілгенде
бөлінетін немесе сіңірілетін жылу мөлшері.
Қалыпты жағдайдағы жай заттардың түзілу жылуы
нольге тең.
Н0298(Н2) = 0 кДж/моль
Заттардың жану жылуы – заттың 1 молі жанғанда бөлінетін жылу мөлшері.
Слайд 35ТЕРМОХИЯНЫҢ НЕГІЗГІ ЗАҢЫ:
Гесс заңы: реакцияның жылу эффектісі (энтальпиясы) – реакцияның
жүру жолына байланысты емес, тек реакцияға қатысатын бастапқы заттардың және
реакция нәтижесінде түзілетін заттардың түріне және күйіне ғана байланысты.
Слайд 36Гесс заңының салдары
1) Реакцияның жылу эффектісі оның нәтижесінде түзілген өнімдердің
түзілу жылуларының қосындысынан реакцияға қатысатын заттардың түзілу жылуларының қосындысын алып
тастағанға тең:
Слайд 372) Тура реакцияның жылу эффектісі теріс таңбамен алынған кері
реакцияның жылу эффектісіне тең.
2SO2 + O2 = 2SO3 Н =
-188,6 кДж
2SO3 = 2SO2 + O2 Н = +188,6 кДж
Слайд 38Термодинамиканың 2 заңы:
жылу өздігінен салқын денеден жылы денеге
ауыспайды
Слайд 39Жүйедегі ретсіздіктің қаншалықты өзгергенін көрсететін ретсіздік дәрежесі энтропия S деп
аталады:
S=k∙lnW
S – энтропия, Дж/моль∙К,
k – Больцман тұрақтысы, 1,38*10-23 Дж/К,
W –
жүйе күйінің ықтималдығы
Слайд 40 1) Энтропия зат қатты күйден сұйық, газ күйіне ауысқанда
артады.
Н2О (к)→ Н2О (г)
S 0
2) Реакцияда молекулалар саны көбейген сайын энтропия да артады.
2H2O = 2H2 + O2 S 0
3H2 + N2 = 2NH3 S 0
Слайд 41Реакцияның жүруіне екі фактор әсер етеді:
1) Н – энтальпиялық фактор,
2)
ТS – энтропиялық фактор.
Тұрақты қысым мен температурада изобара-изотермалық реакциялардың өздігінен
жүруіне энтальпиялық және энтропиялық факторлардың әсерін изобара-изотермалық потенциалдың өзгеруі анықтайды.
Слайд 42298К (250С) стандартты температурада реакцияның өздігінен жүру мүмкіндігі анықталады:
G0х.р. =
G0өнім - G0 баст.з.
G0 – изобара-изотермалық потенциал, Гиббс энергиясы, кДж
Белгілі температура (Т, К) жағдайында реакцияның өздігінен жүру мүмкіндігі анықталады:
GТ = H - TS
Сонда, егер:
G 0 реакция өздігінен жүрмейді
G 0 реакция өздігінен жүреді
G = 0 жүйеде тепе-теңдік орнайды
Слайд 43G = H - TS
Процестің өздігінен жүру мүкіндігі:
ӨЗДІГІНЕН ЖҮРЕТІН ПРОЦЕСТЕРДІ
РЕТТЕЙТІН ФАКТОРЛАР