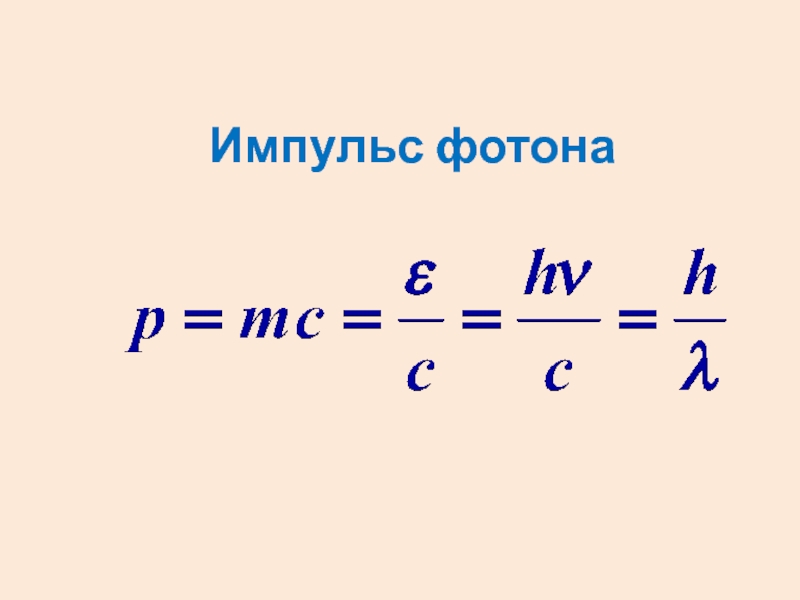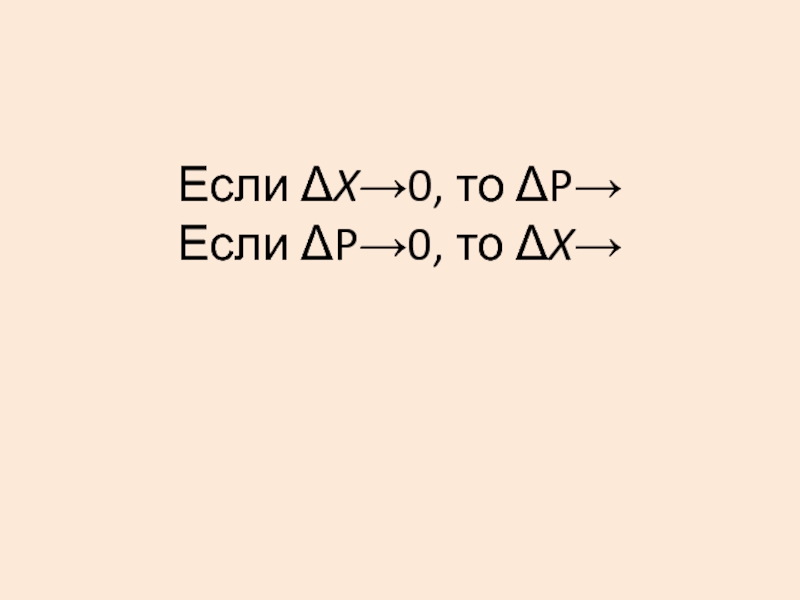Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фотоны
Содержание
- 1. Фотоны
- 2. Масса фотонаМасса покоя фотона равна нулю.Массу движущегося фотона найдем из закона взаимосвязи массы и энергии:
- 3. Импульс фотона
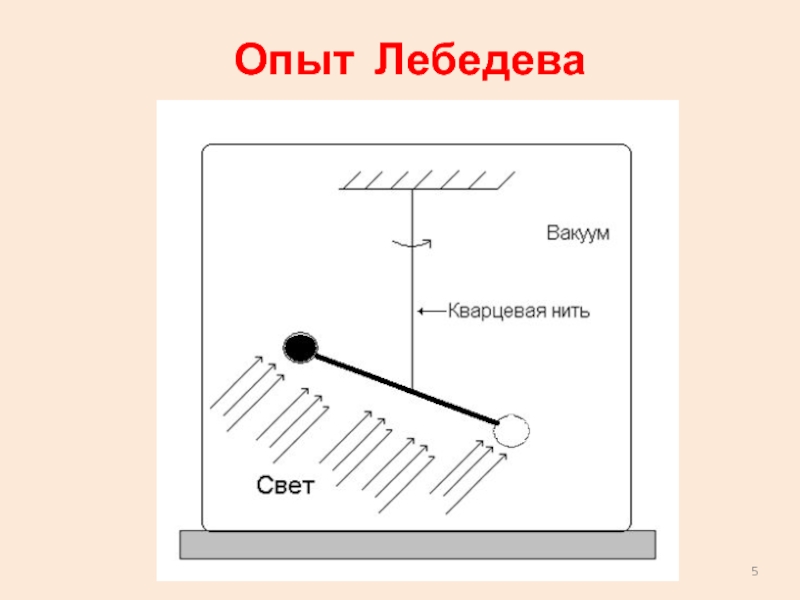
- 4. Давление светаПетр Николаевич ЛЕБЕДЕВ (1866—1912)Основатель выдающейся школы
- 5. Опыт Лебедева
- 6. Если в единицу времени на единицу площади
- 7. Е - энергия N фотонов, падающих на 1 м2 в 1 с.Давление света
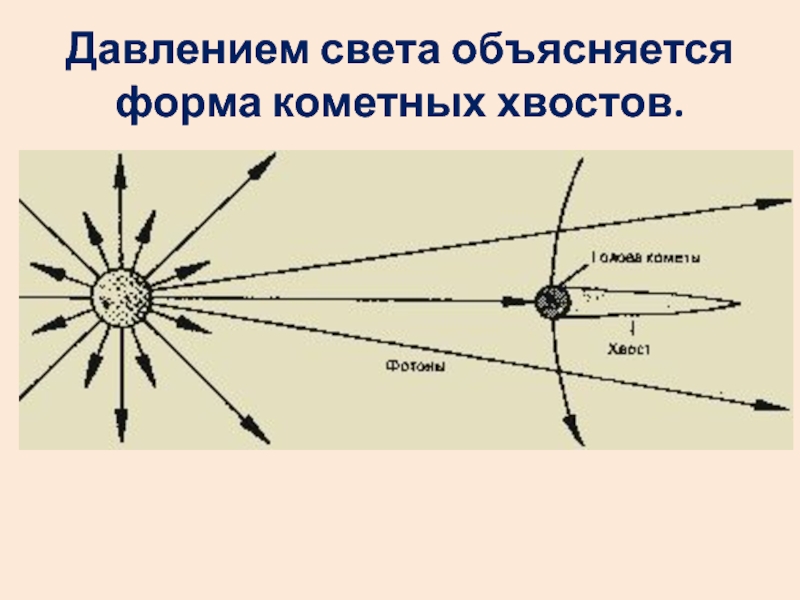
- 8. Давлением света объясняется форма кометных хвостов.
- 9. Солнечный парус
- 10. Гипотеза де БройляВ 1924 г. Луи де
- 11. Связь величин, описывающих корпускулярные и волновые свойства частиц та же, что и для фотонов:
- 12. Длина волны де Бройля тем меньше, чем
- 13. Для электрона с энергиями от 10 эВ до
- 14. Первое экспериментальное подтверждение гипотезы де Бройля было
- 15. Опыт В.А. Фабриканта (1949 г.)
- 16. Дифракция электронов при прохождении через очень тонкий слой серебра
- 17. Дифракция нейтронов
- 18. Соотношение неопределенностей Гейзенберга
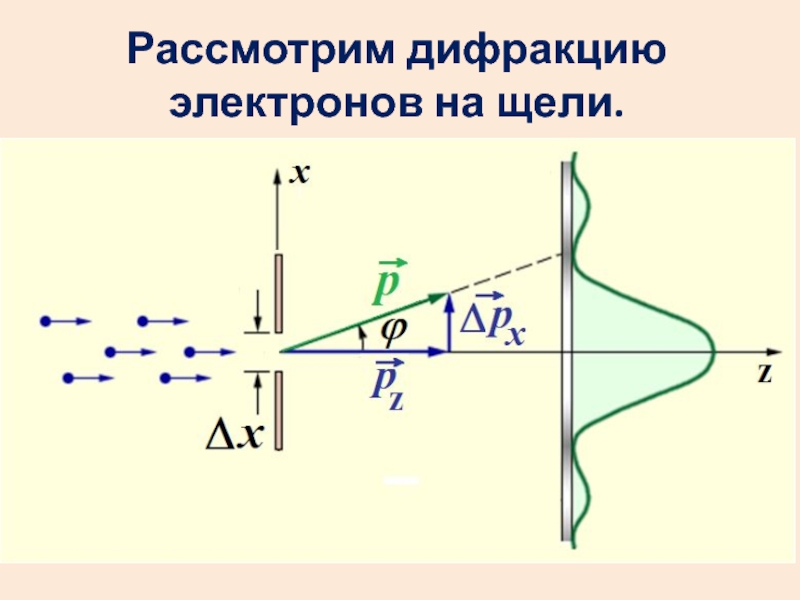
- 19. Рассмотрим дифракцию электронов на щели.
- 20. Пусть условно все электроны летят в центральный
- 21. Запишем условие первого минимума:
- 22. Получим:С учетом других максимумов произведение будет больше.
- 23. Соотношения неопределенностей Гейзенберга:
- 24. Для квантовой частицы неправомерно говорить об одновременных
- 25. Если ΔX→0, то ΔP→ Если ΔP→0, то ΔX→
- 26. Для энергии частицы W и времени:Если Δt→0, то ΔW→
- 27. ВОДОРОДОПОДОБНЫЕ АТОМЫ
- 28. Гипотеза о том, что вещества состоят из
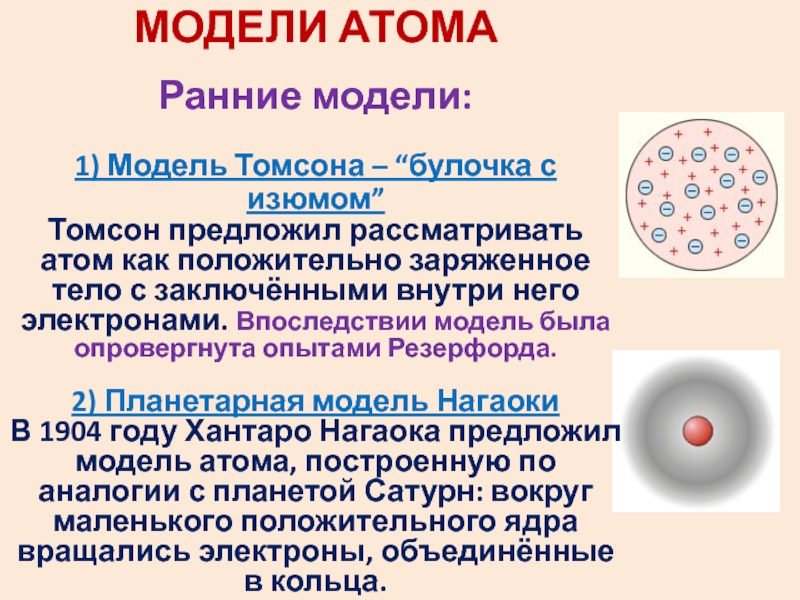
- 29. МОДЕЛИ АТОМАРанние модели:1) Модель Томсона – “булочка
- 30. Опыт Резерфорда по рассеянию α-частицЭрнст Резерфорд
- 31. Альфа-частица образована 2-мя протонами и 2-мя нейтронами, заряжена положительно. Идентична ядру атома гелия (4He2+).
- 32. Резерфорд направил поток α-частиц на золотую фольгу
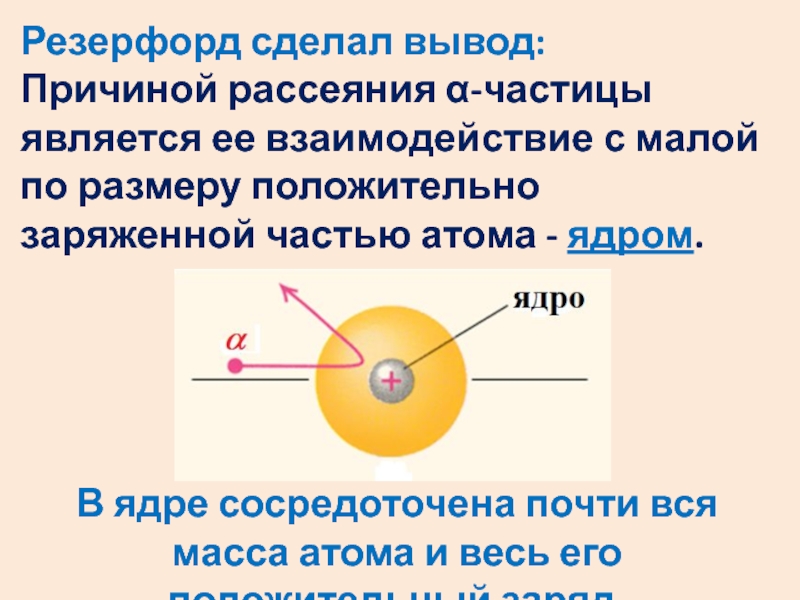
- 33. Резерфорд сделал вывод: Причиной рассеяния α-частицы является
- 34. Планетарная модель атома РезерфордаАтом представляет собой подобие
- 35. Неустойчивость атома РезерфордаСогласно классической электродинамике электрон при
- 36. Для объяснения стабильности атомов Нильсу Бору пришлось ввести особые предположения – постулаты.
- 37. Теория водородоподобного атома по БоруПри построении теории
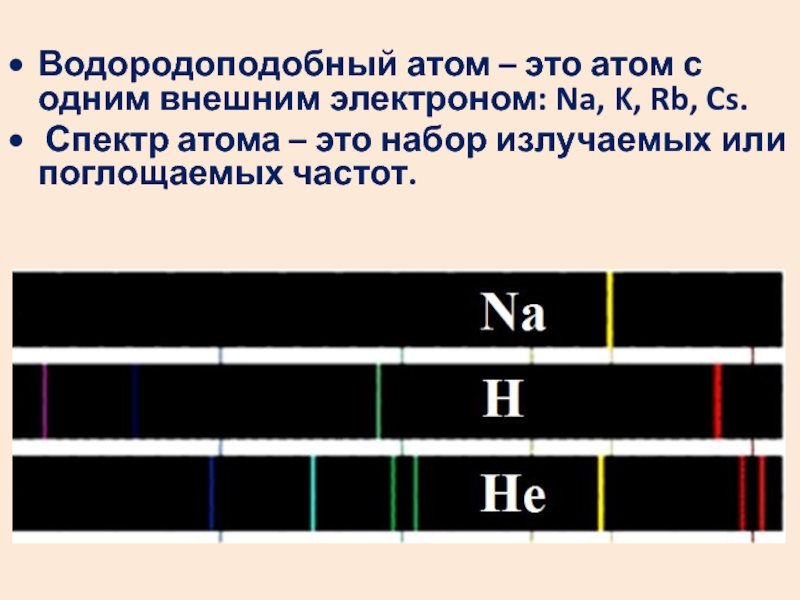
- 38. Водородоподобный атом – это атом с одним
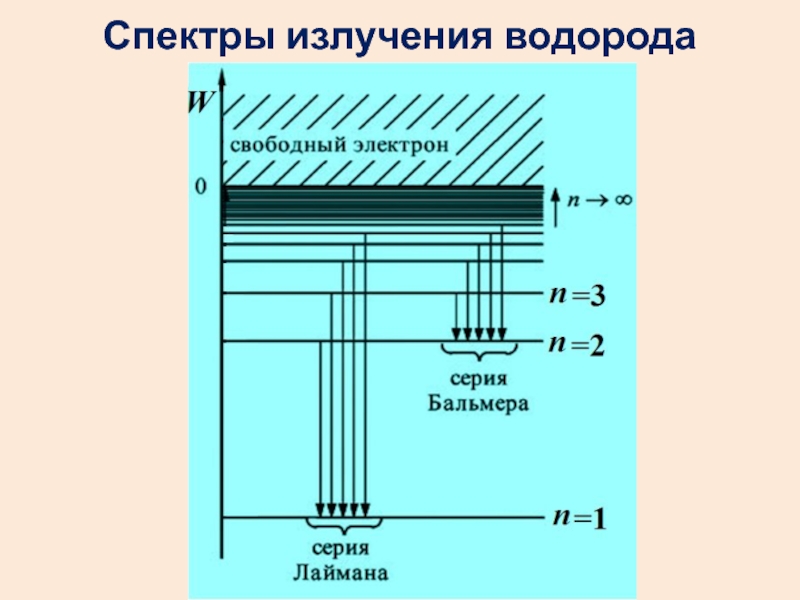
- 39. Спектр атома водорода образован сериями линий. Линии
- 40. Бальмер подобрал формулу для частот спектральных линий:
- 41. Постулаты БораАтом может находится только в особых
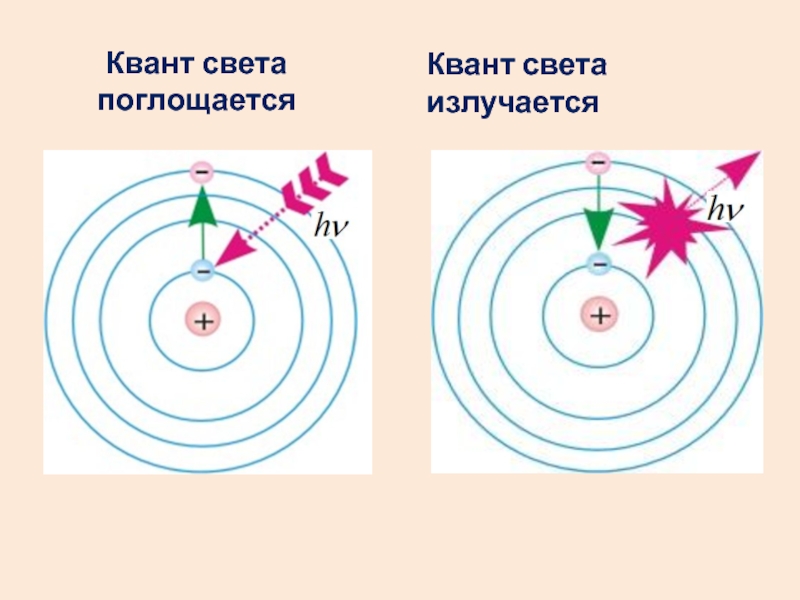
- 42. Второй постулат Бора (правило частот)При переходе атома
- 43. Квант света поглощаетсяКвант света излучается
- 44. Третий постулат (квантование орбит)Момент импульса электрона в
- 45. Бор вычислил радиусы орбит:
- 46. Радиус ближайшей к ядру орбиты называют первым боровским радиусом.заряд ядра,
- 47. Полная энергия электрона в атоме:Энергия электрона на первой боровской орбите в атоме водорода:
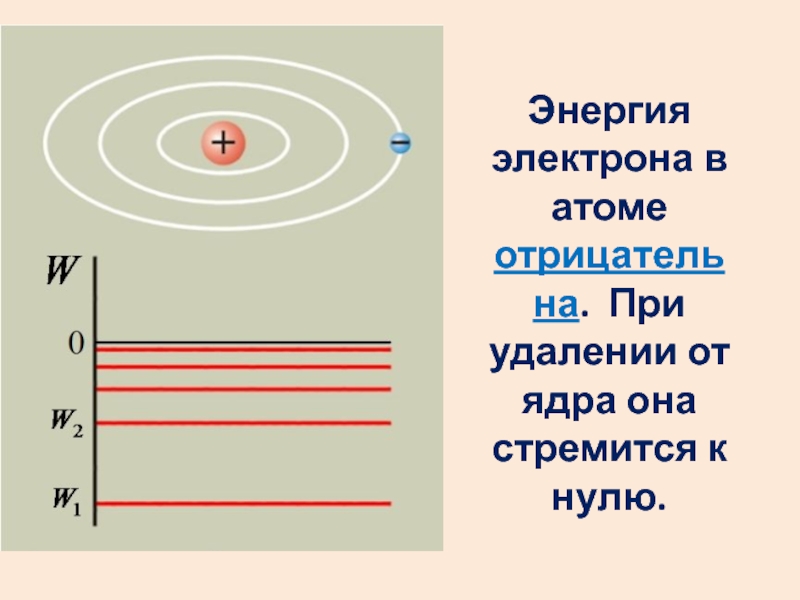
- 48. Энергия электрона в атоме отрицательна. При удалении от ядра она стремится к нулю.
- 49. Частота излучения при переходе с n-го на
- 50. Спектры излучения водорода
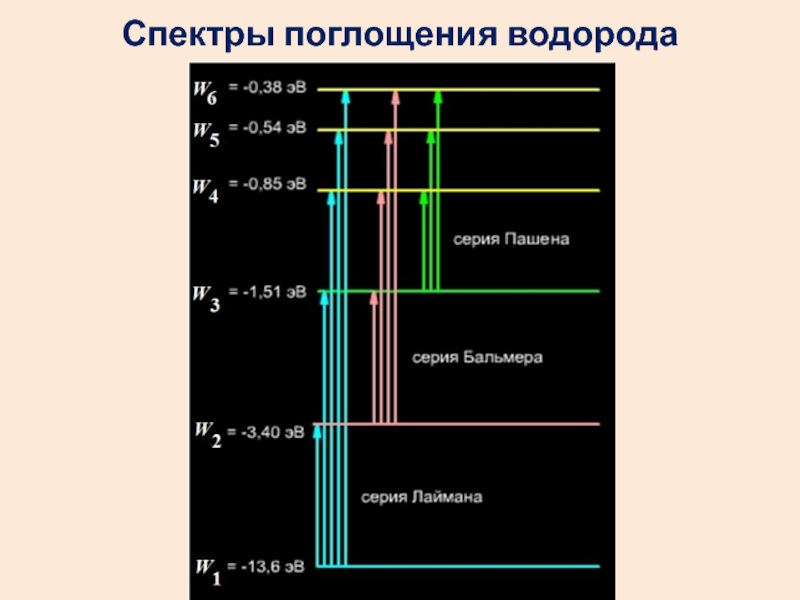
- 51. Спектры поглощения водорода
- 52. Для серииЛаймана m=1, n=2, 3, 4,….Бальмера m=2, n=3, 4, 5….Пашена m=3, n=4, 5, 6,….
- 53. Скачать презентанцию
Масса фотонаМасса покоя фотона равна нулю.Массу движущегося фотона найдем из закона взаимосвязи массы и энергии:
Слайды и текст этой презентации
Слайд 2Масса фотона
Масса покоя фотона равна нулю.
Массу движущегося фотона найдем из
закона взаимосвязи массы и энергии:
Слайд 4Давление света
Петр Николаевич ЛЕБЕДЕВ
(1866—1912)
Основатель выдающейся школы физиков Московского университета. Блестящий
экспериментатор. Первым измерил давление света на твердые тела, экспериментально доказав
наличие импульса у электромагнитного излучения.«Я всю жизнь воевал с Максвеллом, не признавая его светового давления, и вот … Лебедев заставил меня сдаться перед его опытами» (У. Томсон).
Слайд 6Если в единицу времени на единицу площади поверхности с коэффициентом
отражения падает N фотонов, то
N фотонов отразится,
а
(1- N) фотонов поглотится.Слайд 10Гипотеза де Бройля
В 1924 г. Луи де Бройль выдвинул гипотезу
об универсальности корпускулярно-волнового дуализма: не только фотоны, но и любые
частицы материи наряду с корпускулярными обладают также и волновыми свойствами.Слайд 11Связь величин, описывающих корпускулярные и волновые свойства частиц та же,
что и для фотонов:
Слайд 12Длина волны де Бройля тем меньше, чем больше масса частицы
и ее скорость.
Пусть m = 1 г, v = 1 м/с,
тогдаВолновые свойства никак не проявляются в механике макроскопических тел.
Слайд 13Для электрона с энергиями от 10 эВ до 104 эВ длины волн
де Бройля лежат в интервале
как для рентгеновского излучения. Для
таких электронов должна наблюдаться дифракция на кристаллах.Слайд 14Первое экспериментальное подтверждение гипотезы де Бройля было получено в 1927
году в опытах
К. Дэвиссона и Л. Джермера.
Было установлено,
что электроны дифрагируют на кристалле никеля, причем именно так, как должно быть для волн, длина которых определяется соотношением де Бройля.Слайд 20Пусть условно все электроны летят в центральный максимум.
Координата х каждого
электрона точно не известна. Неопределенность координаты равна ширине щели х.
Компонента
импульса по х также неизвестна. Запишем ее как рх.Слайд 24Для квантовой частицы неправомерно говорить об одновременных значениях ее координаты
и импульса. Чем точнее определена какая-либо из координат, тем больше
неопределенность в определении импульса (или скорости) в том же направлении, и наоборот. Понятие траектории для квантовой частицы теряет смысл.Слайд 28Гипотеза о том, что вещества состоят из атомов, впервые была
высказана Левкиппом и Демокритом примерно в IV веке до н.
э.Слайд 29МОДЕЛИ АТОМА
Ранние модели:
1) Модель Томсона – “булочка с изюмом”
Томсон
предложил рассматривать атом как положительно заряженное тело с заключёнными внутри
него электронами. Впоследствии модель была опровергнута опытами Резерфорда.2) Планетарная модель Нагаоки
В 1904 году Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн: вокруг маленького положительного ядра вращались электроны, объединённые в кольца.
Модель оказалось ошибочной, но послужила основой модели атома Резерфорда.
Слайд 31Альфа-частица образована 2-мя протонами и 2-мя нейтронами, заряжена положительно. Идентична
ядру атома гелия (4He2+).
Слайд 32Резерфорд направил поток α-частиц на золотую фольгу толщиной около 0,1
мкм. Большинство частиц пролетели сквозь фольгу, но некоторые отклонились на
очень большие углы вплоть до 180 град.Слайд 33Резерфорд сделал вывод: Причиной рассеяния α-частицы является ее взаимодействие с малой
по размеру положительно заряженной частью атома - ядром.
В ядре
сосредоточена почти вся масса атома и весь его положительный заряд.Слайд 34Планетарная модель атома Резерфорда
Атом представляет собой подобие планетной системы, в
которой электроны движутся по орбитам вокруг тяжёлого положительно заряженного ядра..
Слайд 35Неустойчивость атома Резерфорда
Согласно классической электродинамике электрон при движении с центростремительным
ускорением должен излучать электромагнитные волны и терять энергию.
В итоге
он упадёт на ядро. Слайд 36Для объяснения стабильности атомов Нильсу Бору пришлось ввести особые предположения
– постулаты.
Слайд 37Теория водородоподобного атома по Бору
При построении теории Бор опирался на
опыт Резерфорда и данные по спектрам атомарных газов. Согласно опыту
эти спектры линейчатые.Слайд 38
Водородоподобный атом – это атом с одним внешним электроном: Na,
K, Rb, Cs.
Спектр атома – это набор излучаемых или
поглощаемых частот.Слайд 39Спектр атома водорода образован сериями линий. Линии сгущаются к высокочастотной
границе серии.
В видимой области наблюдается
серия Бальмера.
Еще одна
серия есть в УФ области. А в ИК диапазоне – много серий.ИК
УФ
видимый свет
Серии: … Брэкета Пашена Бальмера Лаймана
Слайд 40Бальмер подобрал формулу для частот спектральных линий:
Для серии Бальмера
m = 2, n = 3, 4, 5, ... .
Для серии Лаймана m = 1, n = 2, 3, 4, ... .
R -
постоянная Ридберга R = 3,3·1015 Гц.
Слайд 41Постулаты Бора
Атом может находится только в особых стационарных или квантовых
состояниях, каждому из которых соответствует определенная энергия Wn.
В стационарных
состояниях атомне излучает.
Первый постулат Бора (постулат стационарных состояний)
Слайд 42Второй постулат Бора (правило частот)
При переходе атома из одного стационарного
состояния с энергией Wn в другое с энергией Wm излучается
или поглощается квант, энергия которого равна разности энергий этих состояний.Слайд 44Третий постулат (квантование орбит)
Момент импульса электрона в атоме принимает только
дискретные значения, кратные постоянной Планка:
m – масса электрона,
vn – его скорость на орбите радиуса rn , n = 1, 2, 3 … Слайд 47Полная энергия электрона в атоме:
Энергия электрона на первой боровской орбите
в атоме водорода:
Слайд 49Частота излучения при переходе с n-го
на m-й уровень энергии:
R=3,3∙1015
Гц - частотная константа Ридберга, ее значение совпало с угаданным
БальмеромДлина волны :
R’=1,1∙107 м-1 - волновая константа Ридберга