Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Генетический контроль метаболизма азота, фосфора и ретроградная регуляция
Содержание
- 1. Генетический контроль метаболизма азота, фосфора и ретроградная регуляция
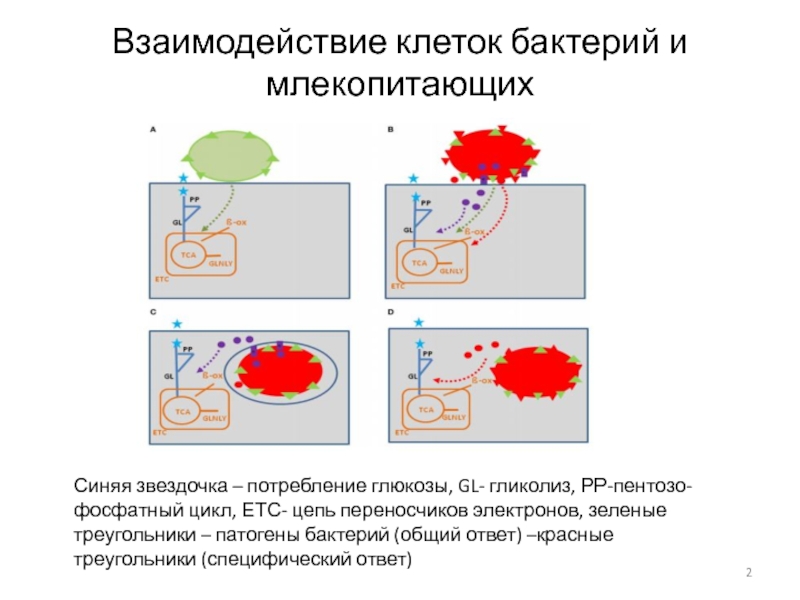
- 2. Взаимодействие клеток бактерий и млекопитающих Синяя звездочка
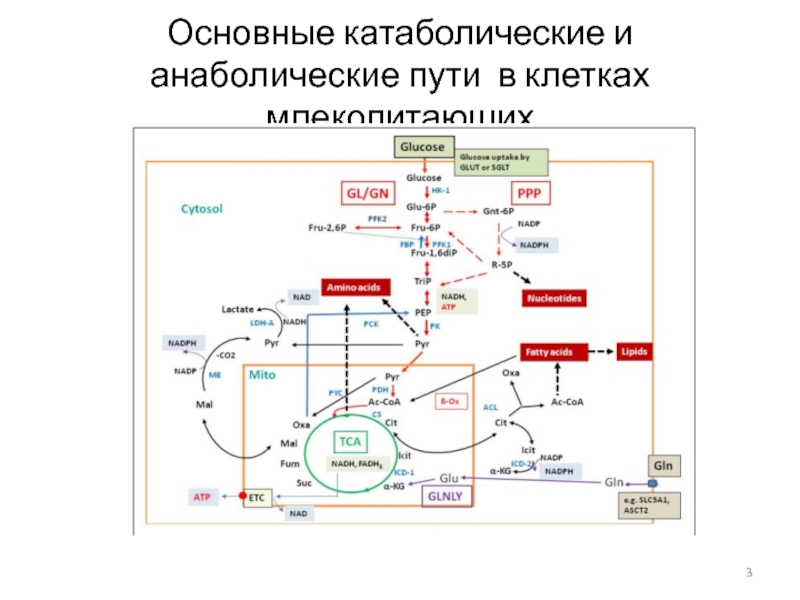
- 3. Основные катаболические и анаболические пути в клетках млекопитающих
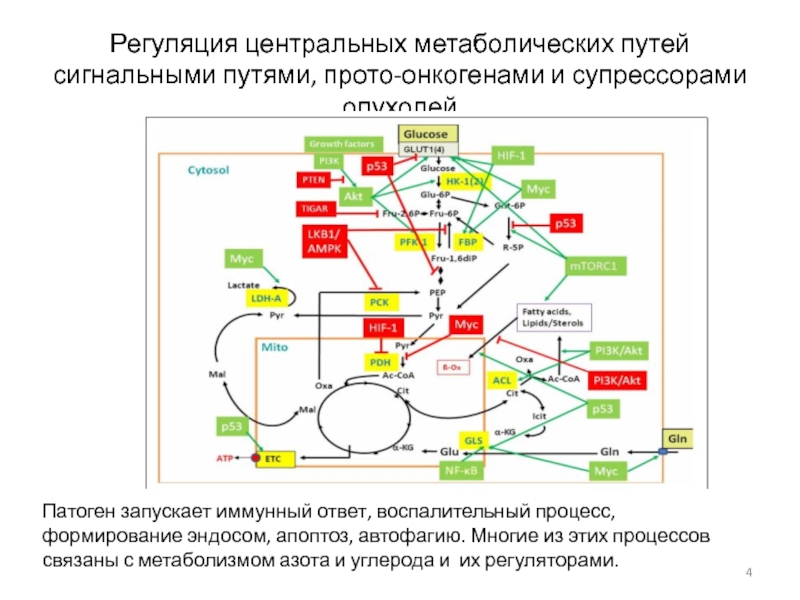
- 4. Регуляция центральных метаболических путей сигнальными путями, прото-онкогенами
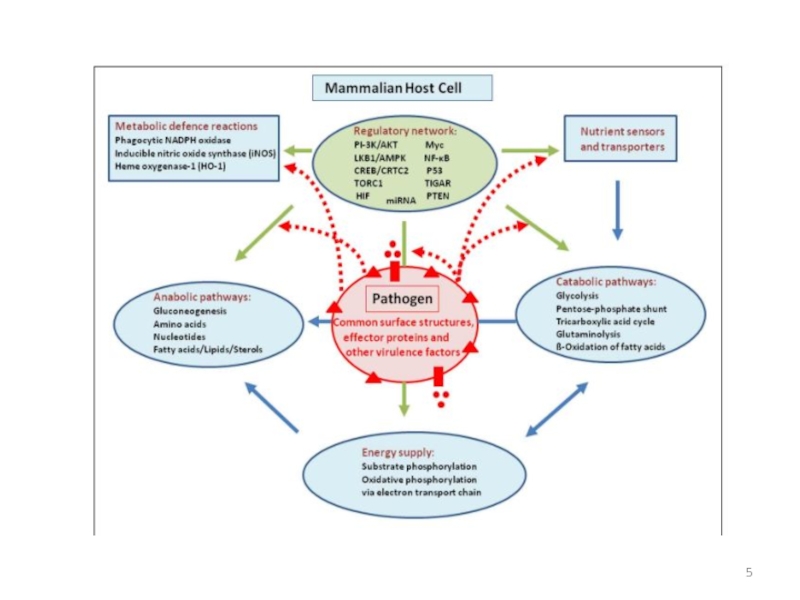
- 5. Слайд 5
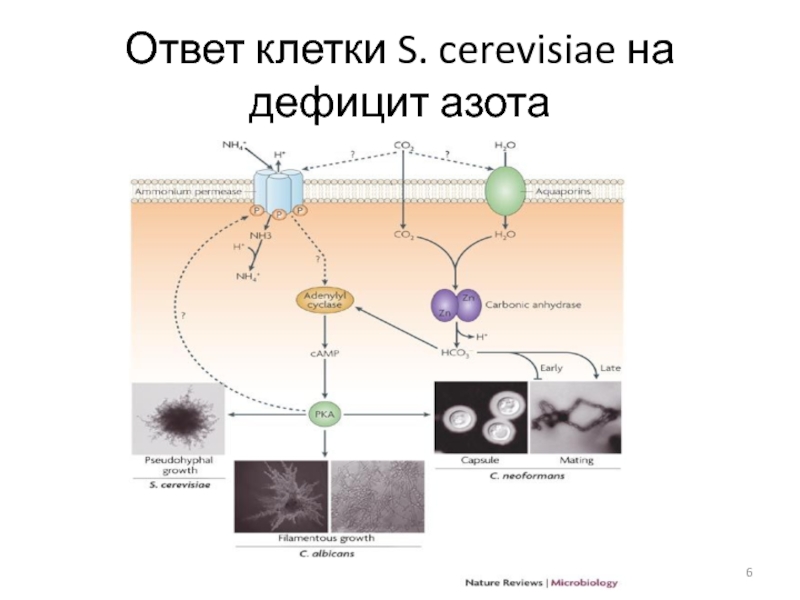
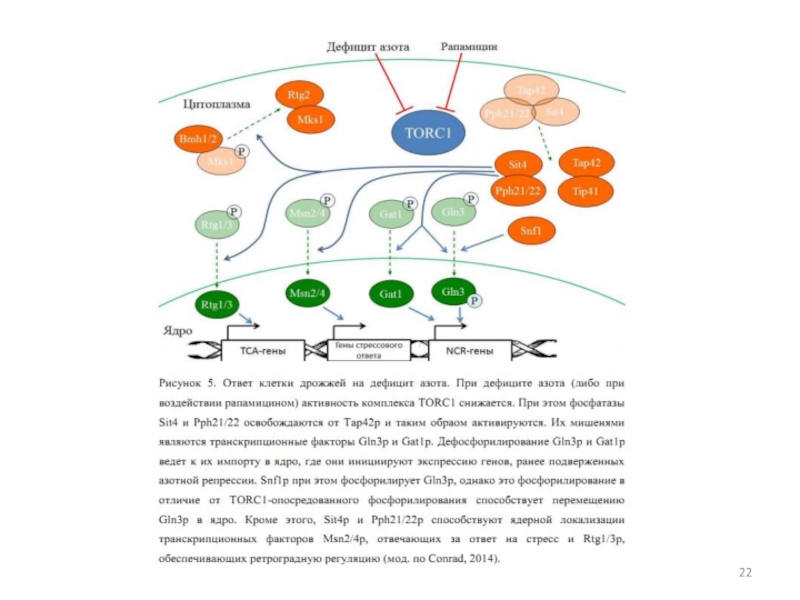
- 6. Ответ клетки S. cerevisiae на дефицит азота
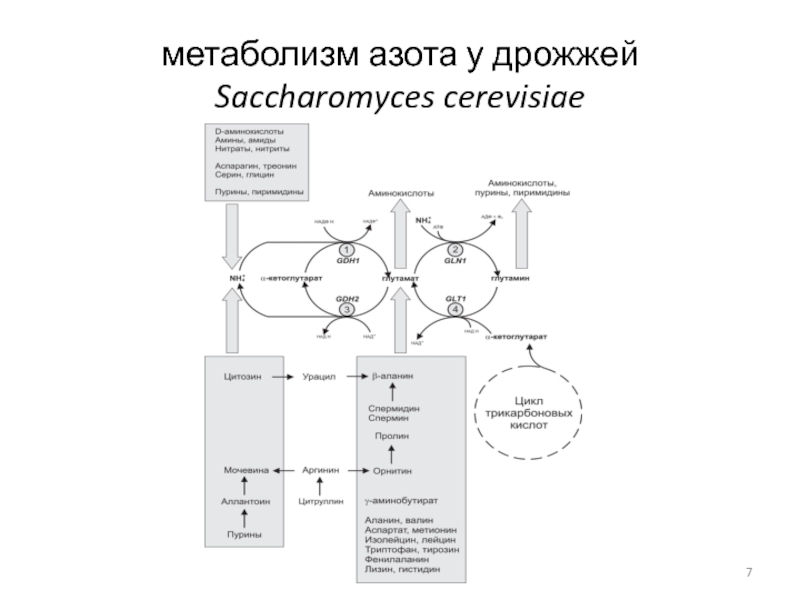
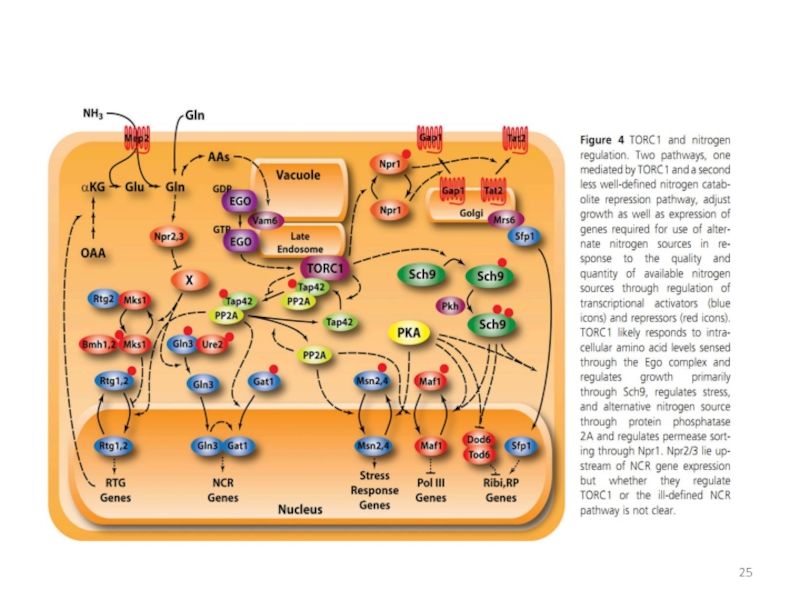
- 7. метаболизм азота у дрожжей Saccharomyces cerevisiae
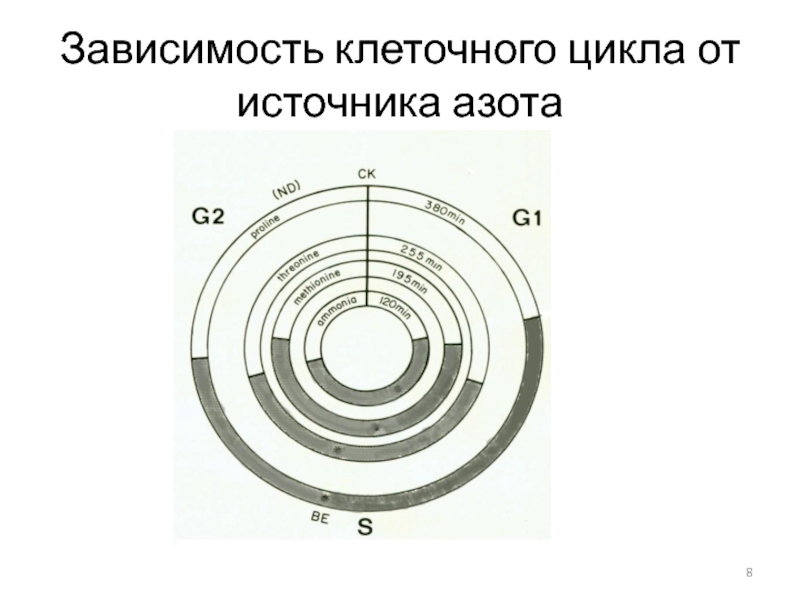
- 8. Зависимость клеточного цикла от источника азота
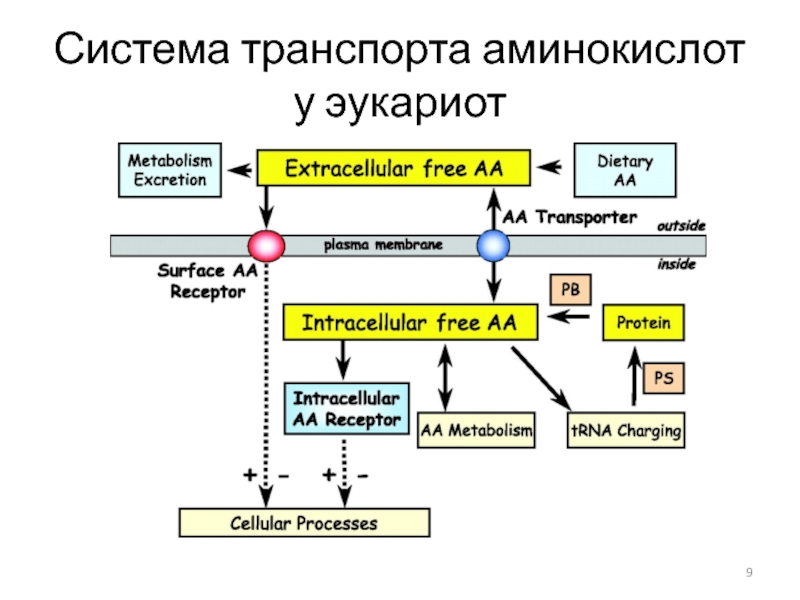
- 9. Система транспорта аминокислот у эукариот
- 10. Пермеазы соединений азотаGAP1 – ген кодирует основную
- 11. Механизмы азотной катаболитной репрессииКачество и количество источника
- 12. Слайд 12
- 13. Слайд 13
- 14. Схема взаимной регуляции GATA-факторов: активаторов Gln3p и
- 15. Слайд 15
- 16. Структура GATA-фактора Gln3p и регуляция его внутриклеточной
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
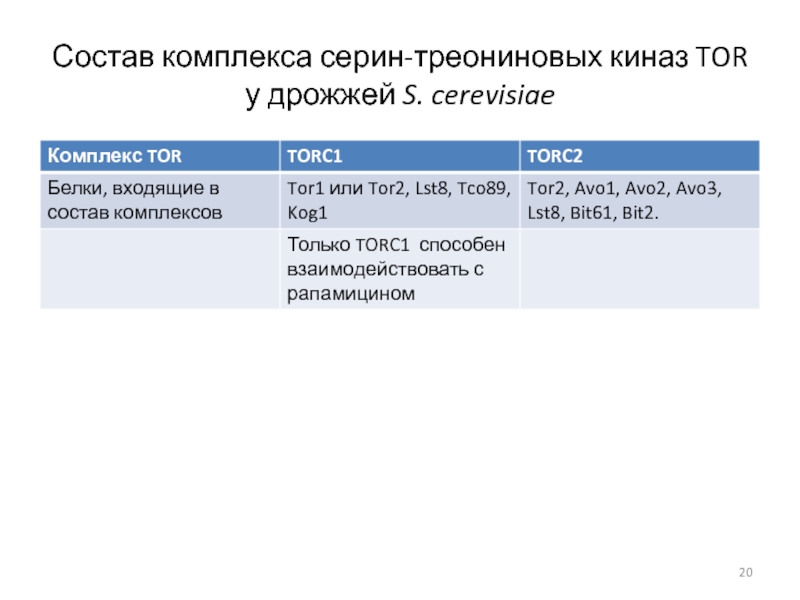
- 20. Состав комплекса серин-треониновых киназ TOR у дрожжей S. cerevisiae
- 21. Слайд 21
- 22. Слайд 22
- 23. Ретроградная регуляция Внутриклеточная коммуникация между митохондриями и
- 24. RTG позитивно регулируется белками Rtg1, Rtg2, Rtg3
- 25. Слайд 25
- 26. Генетический контроль регуляции кислой фосфатазы у дрожжей-сахаромицетовЛекция 3
- 27. Фосфор -один из основных биогенных элементов клеткиВ
- 28. Внутренние резервы ФнПри снижении концентрации Фн в
- 29. Ферменты метаболизма Фнизозимы кислой фосфатазы (КФ)транспортные белки
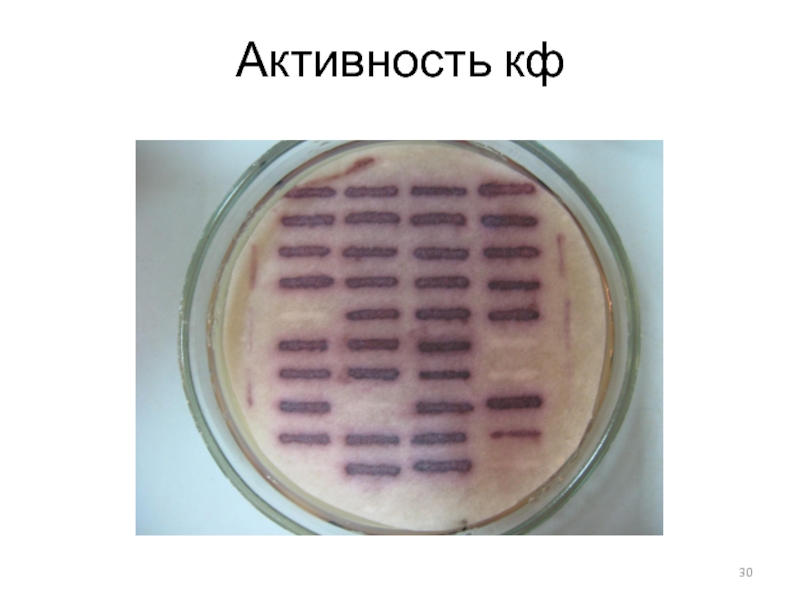
- 30. Активность кф
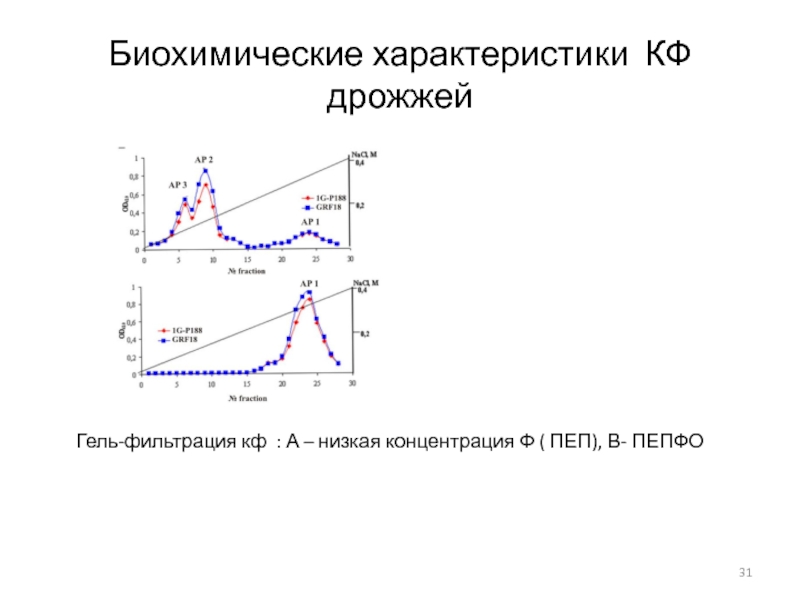
- 31. Биохимические характеристики КФ дрожжейГель-фильтрация кф : А – низкая концентрация Ф ( ПЕП), В- ПЕПФО
- 32. Генетический контроль синтеза кф1 (Pho3p)КФ1 – структурный
- 33. Pho5pРепрессия фосфатомСтруктурный ген РНО5Промотор используется в биотехнологииСтруктурная часть гена используется в качестве репортерного гена
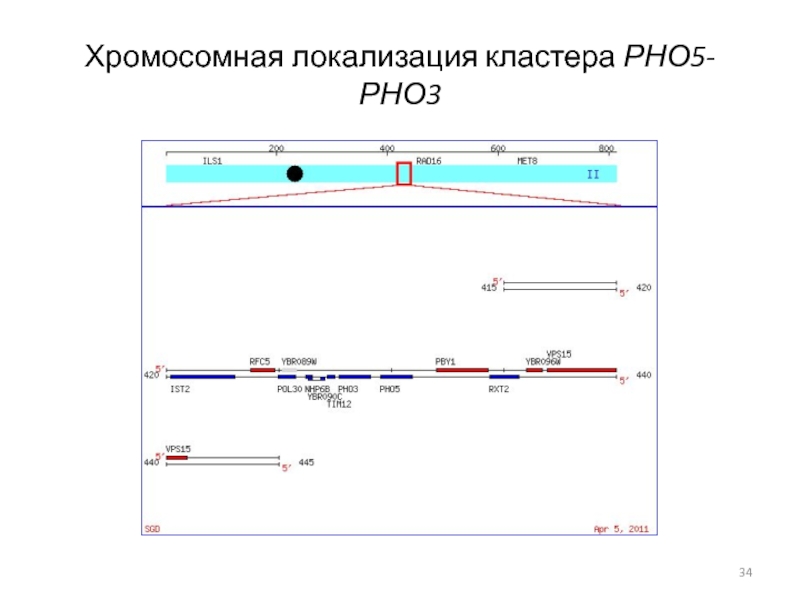
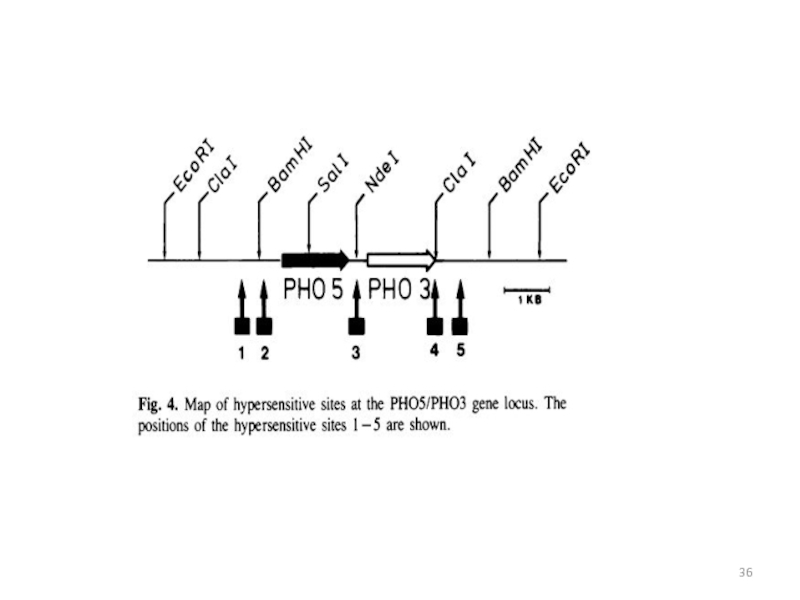
- 34. Хромосомная локализация кластера РНО5-РНО3
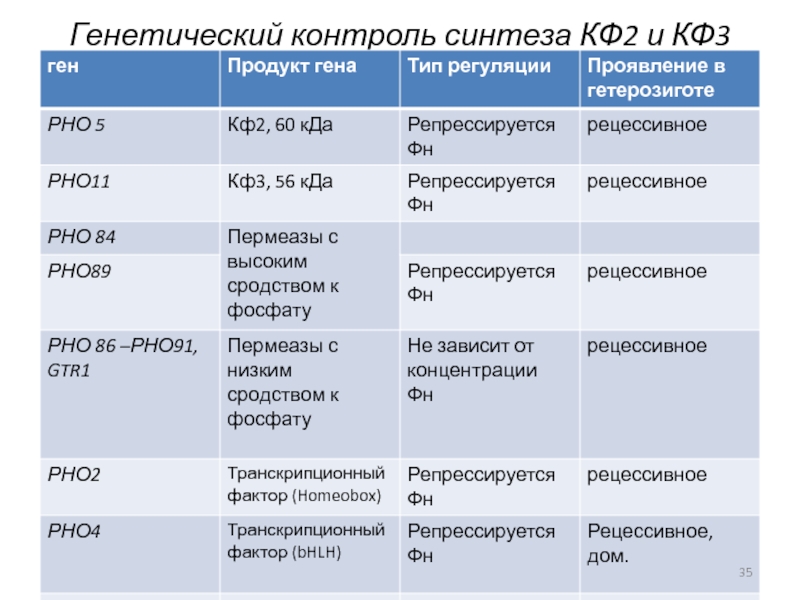
- 35. Генетический контроль синтеза КФ2 и КФ3
- 36. Слайд 36
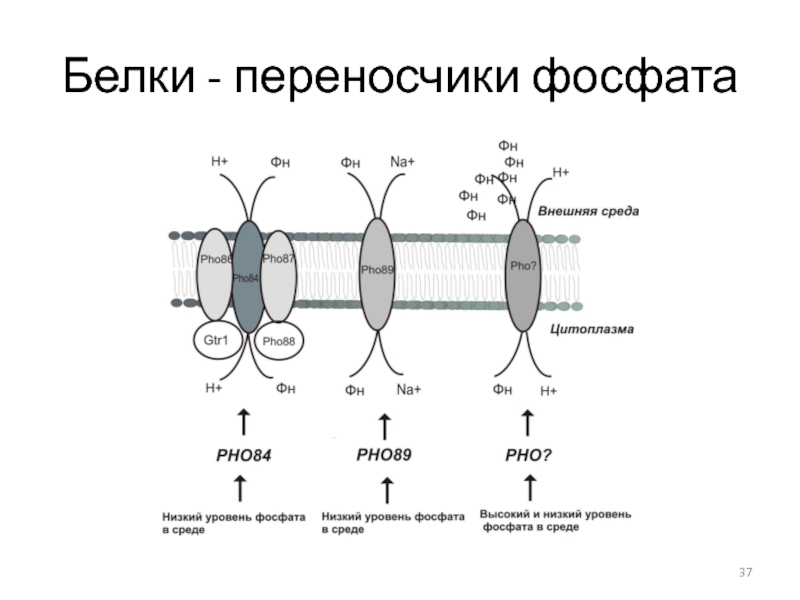
- 37. Белки - переносчики фосфата
- 38. Позитивные регуляторы РНО5РНО4 Мутации рецессивные, снижающие активность
- 39. 1 Superclass: Basic Domains 1.2 Class:
- 40. Активность Pho4p регулируется на нескольких уровнях: На
- 41. Pho2pPho2p - (Bas2, Grf10) транскрипционный активатор генов
- 42. PHO81В гене РНО81 возникают мутации двух типов
- 43. Негативные регуляторы синтеза КФPho85 – циклин-зависимая киназа.
- 44. Слайд 44
- 45. Плейотропные эффекты Pho85Штаммы с мутациями pho85, как
- 46. Циклины CDK Pho85
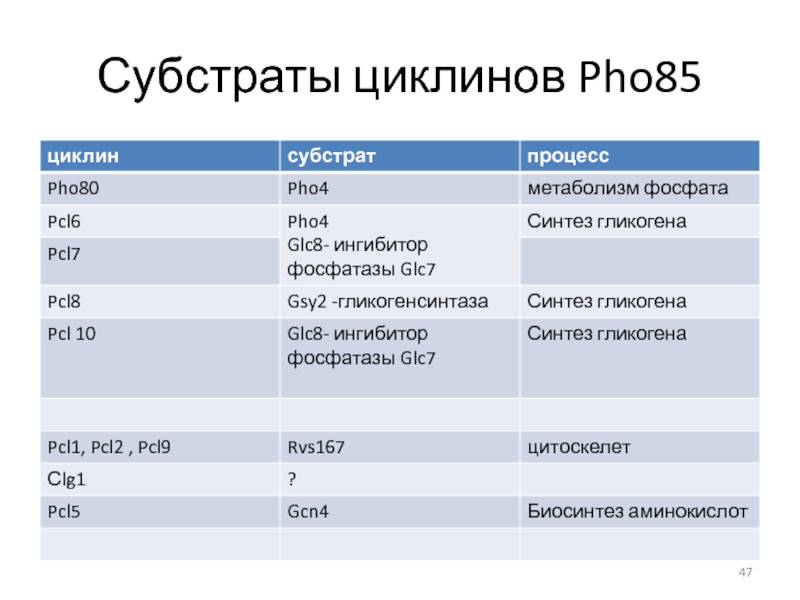
- 47. Субстраты циклинов Pho85
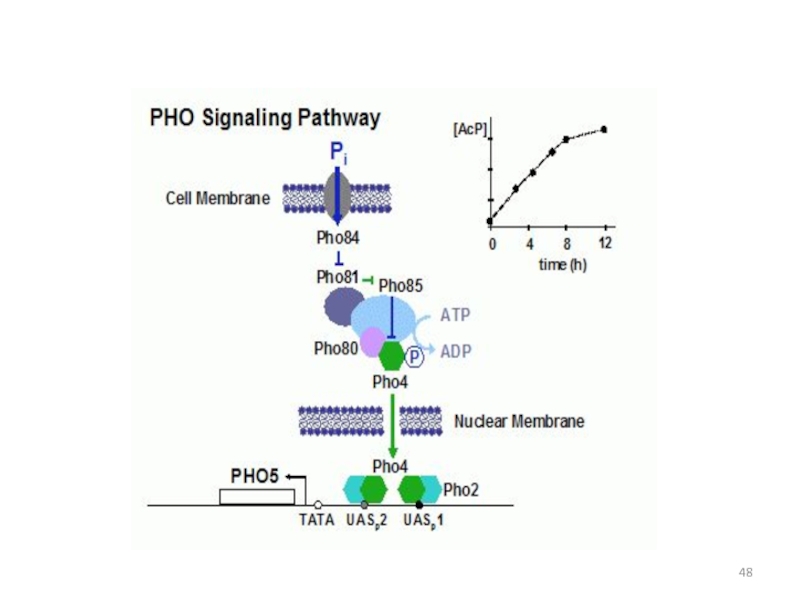
- 48. Слайд 48
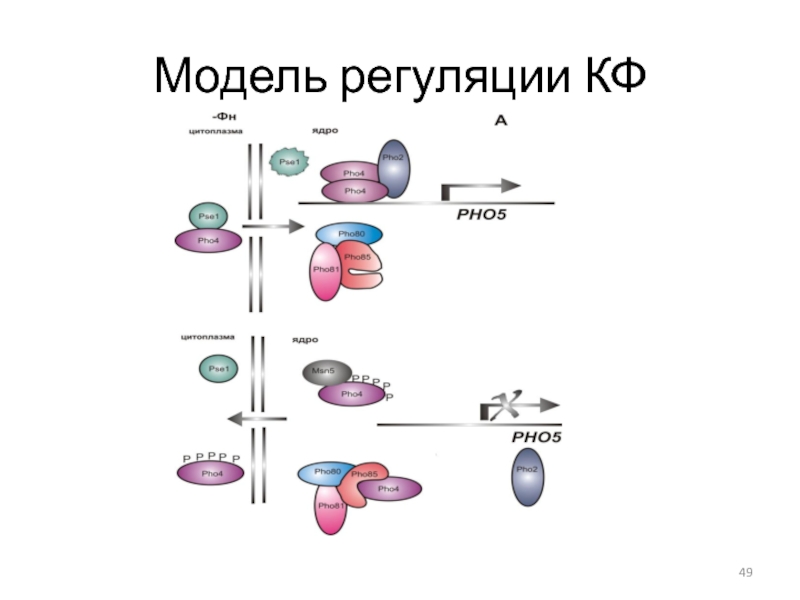
- 49. Модель регуляции КФ
- 50. Расположение нуклеосом в промоторе РНО5На экспрессию PHO5
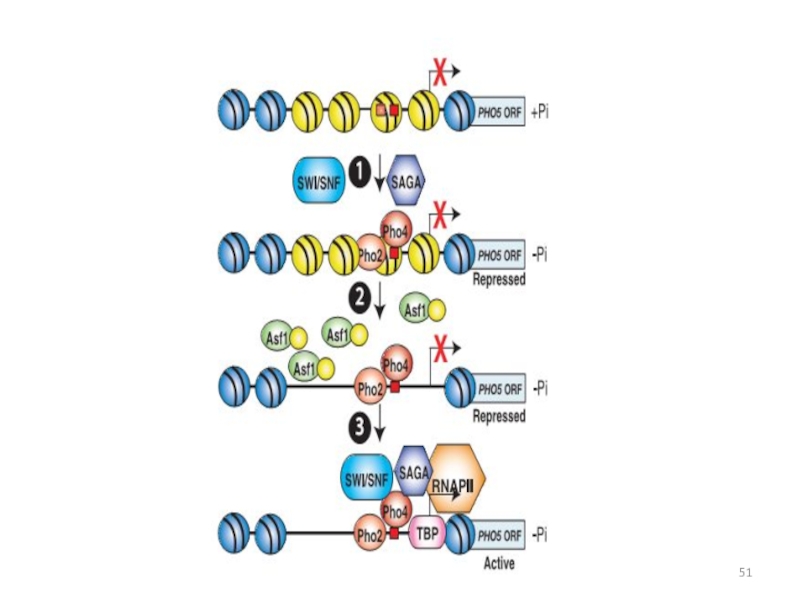
- 51. Слайд 51
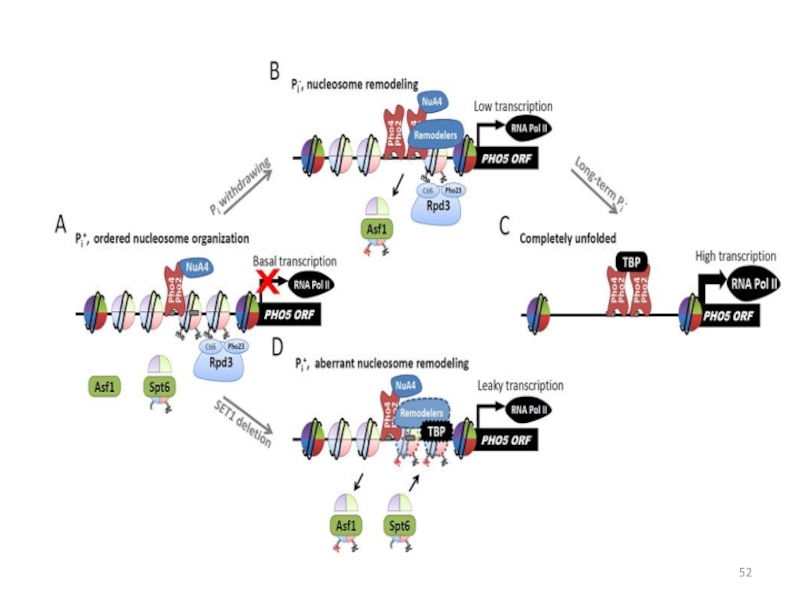
- 52. Слайд 52
- 53. Регуляторные некодирующие РНК дрожжей30 марта 2011 г.Савинов В.А.
- 54. Этапы изучения РНК-сайленсинга «ко-супрессия» у растений (1990
- 55. Слайд 55
- 56. Биогенез миРНК
- 57. TGS у S. pombeОбласти формирования гетерохроматина: перицентромерные участки ДНК; локус типа спаривания.
- 58. В 2008 году у дрожжей S. pombe
- 59. Регуляторные некодирующие РНК дрожжей S. cerevisiaeУ дрожжей
- 60. Источники нкРНК у дрожжей: Двунаправленная транскрипция –
- 61. (Martens et al., 2004, 2005)нкРНК SRG1 (SER3
- 62. (Hongay et al., 2006)асРНК в локусе IME4
- 63. (David et al., 2006)Идентифицированы асРНК для 1555
- 64. (Camblong et al., 2007)асРНК в локусе PHO84,
- 65. асРНК в локусе PHO84, кодирующем пермеазу с
- 66. Слайд 66
- 67. (Houseley et al., 2008)асРНК внутри гена GAL10,
- 68. (2008 г.)Авторегуляция транскрипции генов биосинтеза гуанидина IMD2
- 69. (Bird et al., 2006)нкРНК ZRR1 против гена
- 70. (Uhler et al., 2007)асРНК в локусе PHO5,
- 71. Укороченная РНК и асРНК в локусе KCS1,
- 72. Укороченная РНК и асРНК в локусе KCS1,
- 73. Слайд 73
- 74. асРНК, транскрибируемая с мобильного элемента Ty1(Berretta et
- 75. Слайд 75
- 76. Слайд 76
- 77. Слайд 77
- 78. Слайд 78
- 79. Слайд 79
- 80. Слайд 80
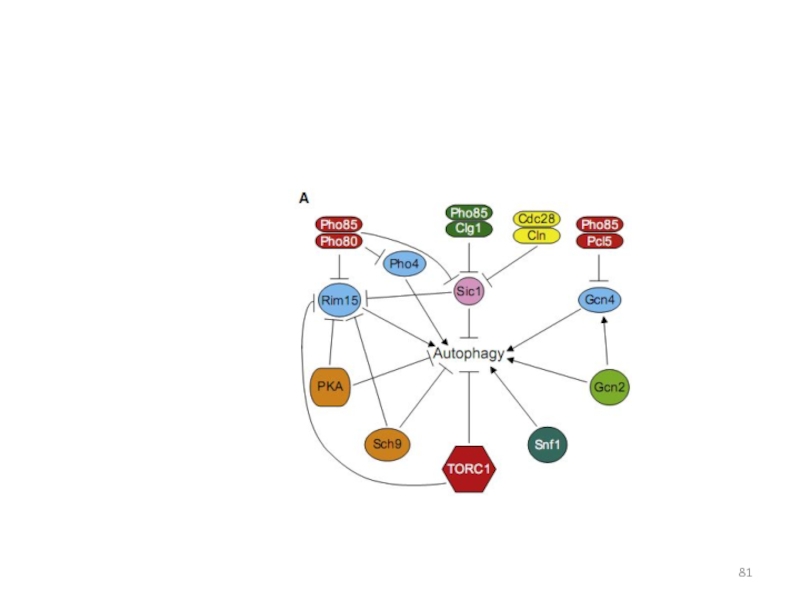
- 81. Слайд 81
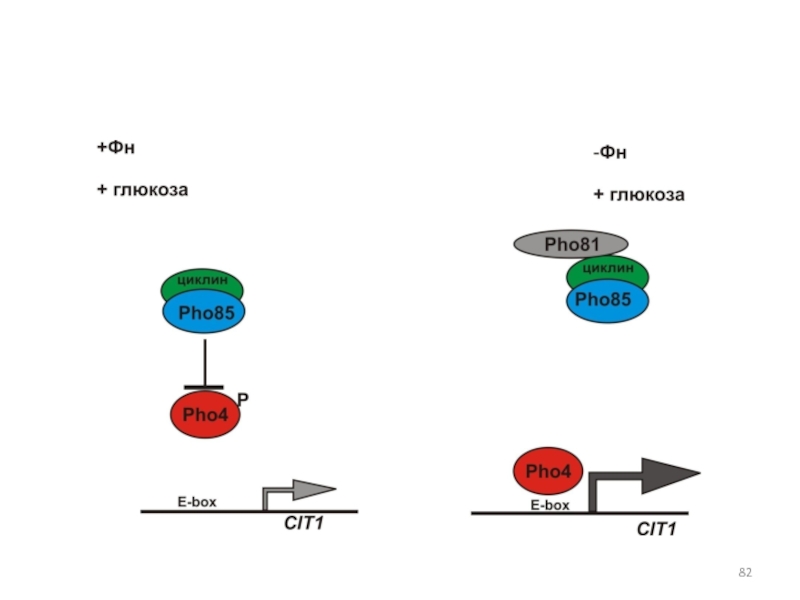
- 82. Слайд 82
- 83. Все три статьи на флэшке в папке activator(3)
- 84. Слайд 84
- 85. Слайд 85
- 86. Слайд 86
- 87. Слайд 87
- 88. Слайд 88
- 89. Слайд 89
- 90. Слайд 90
- 91. Слайд 91
- 92. Слайд 92
- 93. Слайд 93
- 94. Слайд 94
- 95. Слайд 95
- 96. Скачать презентанцию
Слайды и текст этой презентации
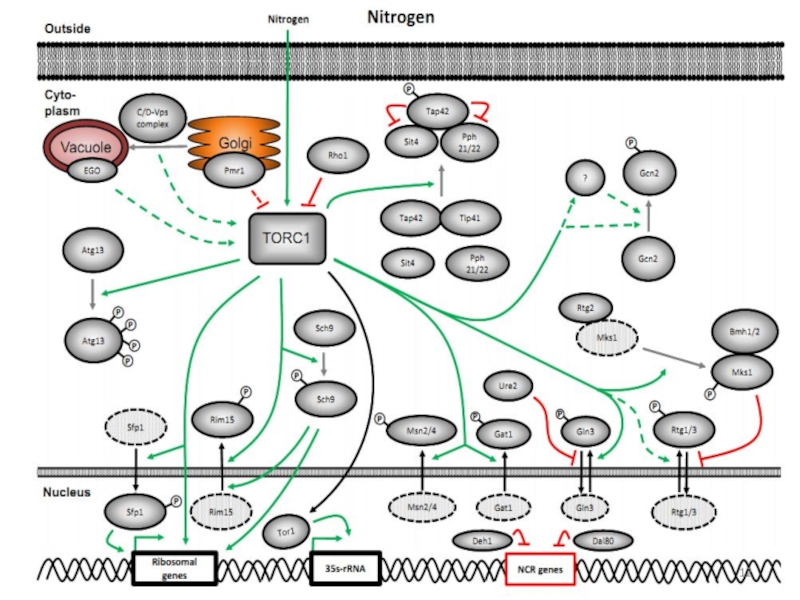
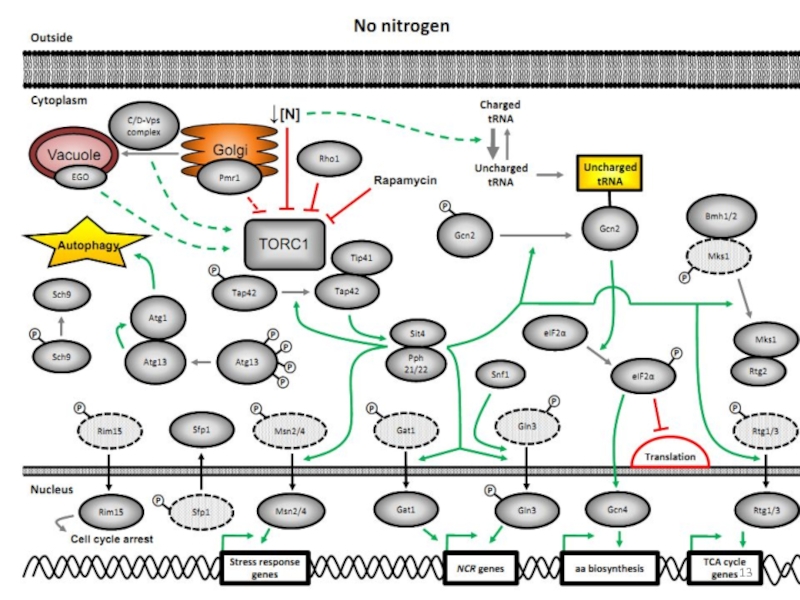
Слайд 4Регуляция центральных метаболических путей сигнальными путями, прото-онкогенами и супрессорами опухолей
Патоген запускает иммунный ответ, воспалительный процесс, формирование эндосом, апоптоз, автофагию.
Многие из этих процессов связаны с метаболизмом азота и углерода и их регуляторами.Слайд 10Пермеазы соединений азота
GAP1 – ген кодирует основную пермеазу аминокислот (трансцептор),
способную транспортировать внутрь клетки большинство разновидностей аминокислот, даже не входящих
в состав белков.Специфические переносчики аминокислот и пептидов (гены AGP1, BAP2, BAP3, DIP5, GNP1, TAT1, TAT2, PTR2, MUP1)
Bap2p, Bap3p и Tat1p – переносят лейцин, цистеин, аланин и фенилаланин
Tat2 -тирозин и триптофан .
Gnp1p - глутамин, аспарагин .
Dip5p – глутамат и аспартат.
Mup1p - метионин .
Agp1 – пермеаза аминокислот с широкой специфичностью , но с меньшей, чем у Gap1p, аффинностью.
Ptr2p отвечает за транспорт ди- и трипептидов
Слайд 11Механизмы азотной катаболитной репрессии
Качество и количество источника азота контролируют транскрипционную
активность генов азотного метаболизма (NCR-гены).
«Плохие источники» азота являются индукторами соответствующих
генов, например генов катаболизма пролина и аргинина . NCR - гены, как правило, регулируются системой общего контроля биосинтеза аминокислот ( активатор Gcn4p).
Регуляция транскрипции генов, кодирующих некоторые пермеазы аминокислот, осуществляется при помощи SSY1-пути, который позволяет клетке чувствовать аминокислотный состав среды.
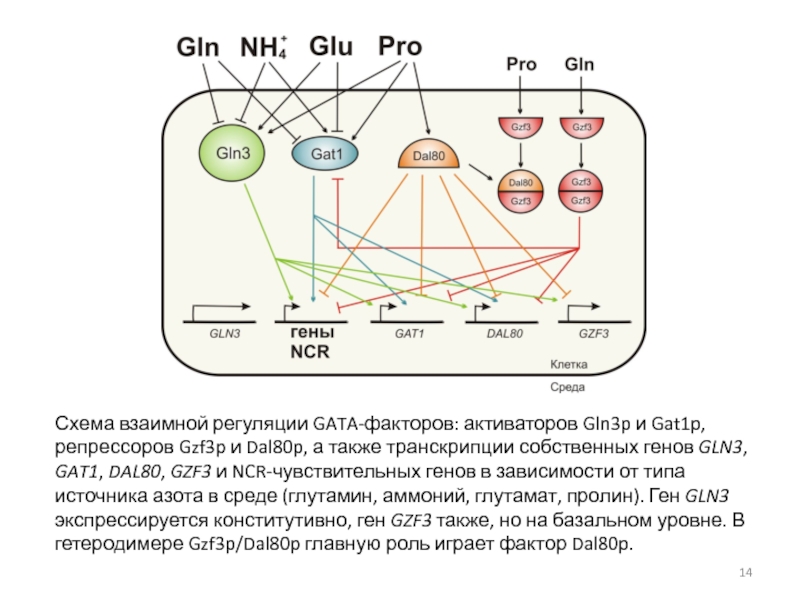
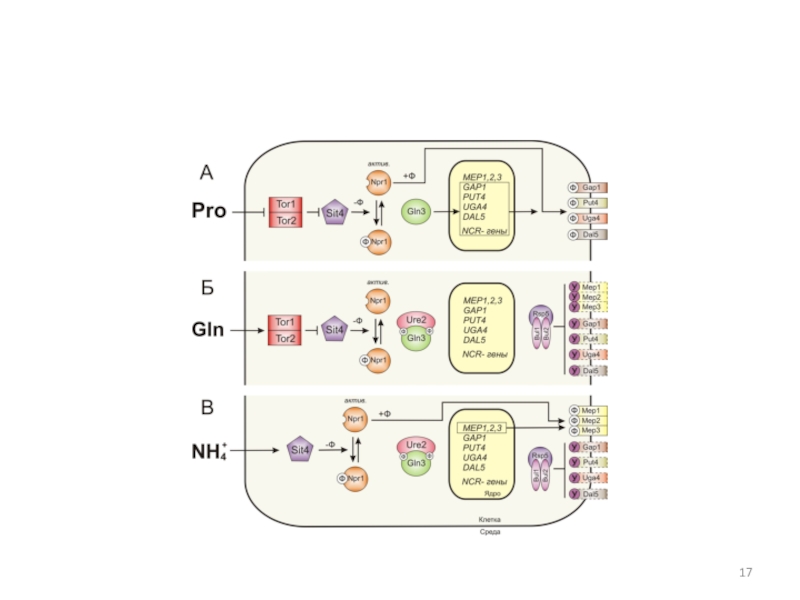
Слайд 14Схема взаимной регуляции GATA-факторов: активаторов Gln3p и Gat1p, репрессоров Gzf3p
и Dal80p, а также транскрипции собственных генов GLN3, GAT1, DAL80,
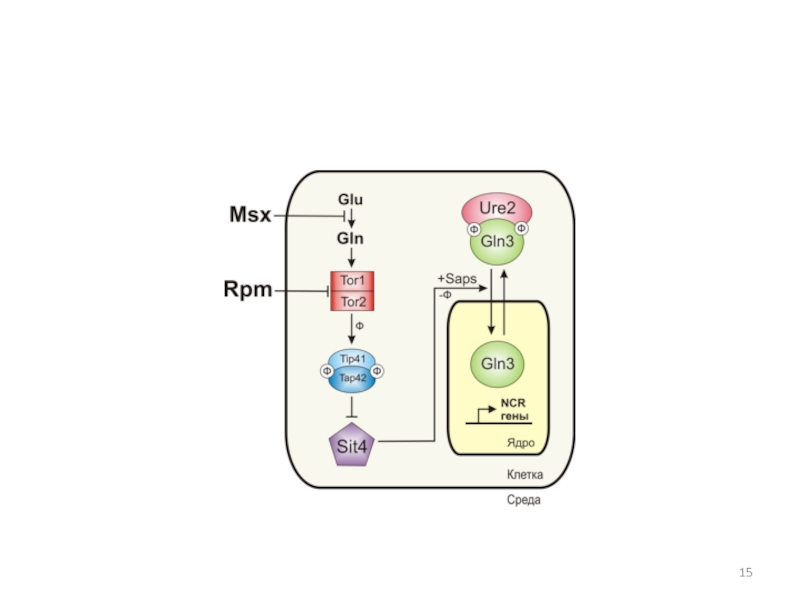
GZF3 и NCR-чувствительных генов в зависимости от типа источника азота в среде (глутамин, аммоний, глутамат, пролин). Ген GLN3 экспрессируется конститутивно, ген GZF3 также, но на базальном уровне. В гетеродимере Gzf3p/Dal80p главную роль играет фактор Dal80p.Слайд 16Структура GATA-фактора Gln3p и регуляция его внутриклеточной локализации
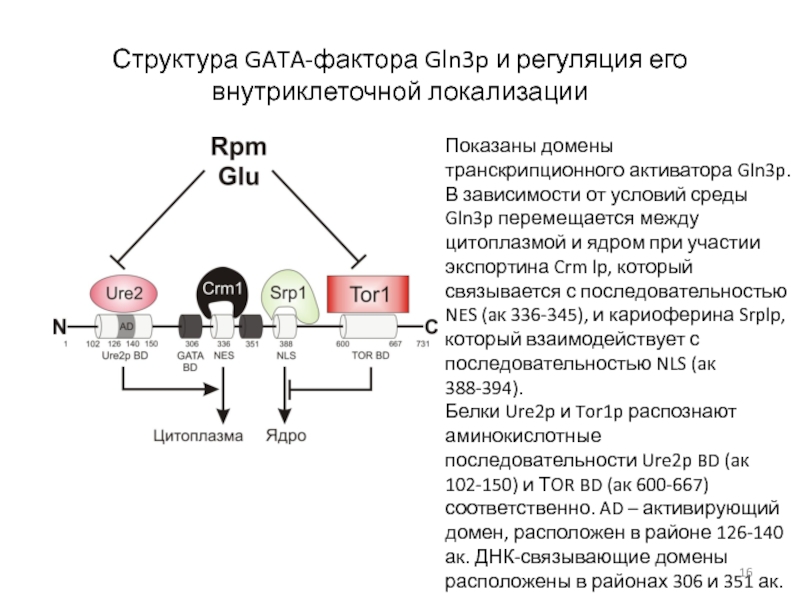
Показаны домены транскрипционного
активатора Gln3p.
В зависимости от условий среды Gln3p перемещается между
цитоплазмой и ядром при участии экспортина Crm lp, который связывается с последовательностью NES (aк 336-345), и кариоферина Srplp, который взаимодействует с последовательностью NLS (aк 388-394). Белки Ure2p и Tor1p распознают аминокислотные последовательности Ure2p BD (aк 102-150) и ТOR BD (aк 600-667) соответственно. AD – активирующий домен, расположен в районе 126-140 ак. ДНК-связывающие домены расположены в районах 306 и 351 ак.
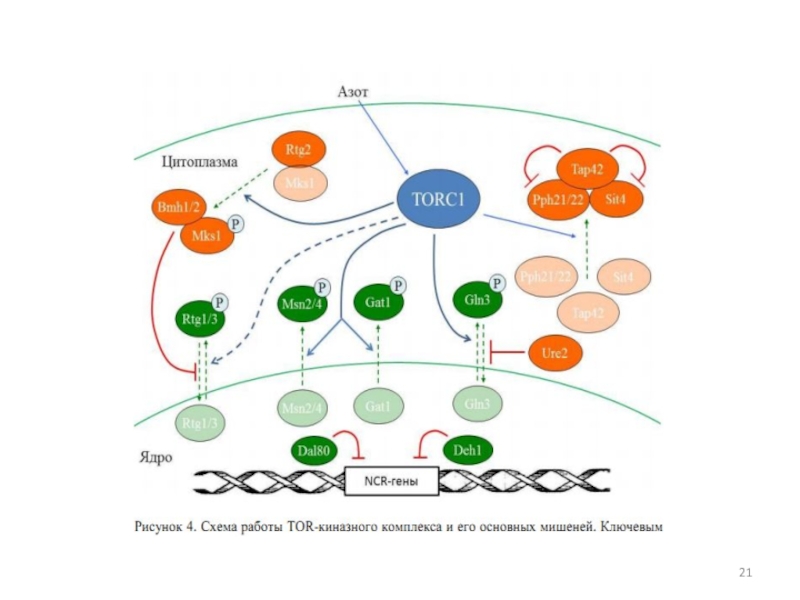
Слайд 23Ретроградная регуляция
Внутриклеточная коммуникация между митохондриями и ядром достигается с
помощью ретроградной регуляции.
У S. cerevisiae – это RTG путь.
Слайд 24RTG позитивно регулируется белками Rtg1, Rtg2, Rtg3 and Grr1 и
негативно белками Mks1, Lst8 и двумя белками 14-3-3, Bmh1/2.
Активация ретроградного
сигнала ведет к активации Rtg1/3, (два basic helix-loop-helix leucine zipper ТФ). Для активации этого комплекса требуется цитоплазматический белок Rtg2. Rtg2 принадлежит к семейству /Hsp70/sugar kinase superfamily. Этот белок имеет АТФ-связывающий домен. Rtg2 связывает и инактивирует Mks1, поэтому активируется Rtg1/3 и RTG путь.
Когда путь неактивен, Mks1 диссоциирует от Rtg2 и связывается с Bmh1/2, что предотвращает активацию Rtg1/3. Предполагают, что диссоциация происходит в результате изменения концентрации АТФ.
Слайд 27Фосфор -один из основных биогенных элементов клетки
В живых организмах фосфор
представлен в основном в виде ортофосфата (HPO4 2-)
У дрожжей
Фн встречается как свободный ион, но большая часть Фн связана в виде фосфолипидов, нуклеотидов, фосфопротеидов и фосфорилированных углеводов.Избыток Фн накапливается в клетке в виде полифосфатов – линейных полимеров ортофосфорной кислоты. В полифосфатах атомы фосфора связаны ангидридными связями, в результате чего они способны к запасанию энергии и выделению большого ее количества при гидролизе этих связей (Кулаев, 1975).
Фн играет важную роль в поддержании внутриклеточного рН.
Фн действует как субстрат и эффектор многих энзимов
Слайд 28Внутренние резервы Фн
При снижении концентрации Фн в цитоплазме и в
среде уровень его может быть восстановлен за счет внутренних резервов
клетки.1. АТФ - образуется в результате синтеза аминокислот, нуклеотидов, жирных кислот, функционирования протонной помпы и анаплеротических реакций, таких как цикл Кребса;
2. Фосфоенолпируват, образующийся при синтезе ароматических аминокислот;
3. Сахарофосфаты – трегалоза и сахара, образующиеся в ходе глюконеогенеза;
4. Полифосфаты.
Слайд 29Ферменты метаболизма Фн
изозимы кислой фосфатазы (КФ)
транспортные белки – пермеазы с
разным сродством к Фн,
щелочные фосфатазы, полифосфатазы и полифосфаткиназы, обеспечивающие
расщепление резервных полифосфатовСлайд 31Биохимические характеристики КФ дрожжей
Гель-фильтрация кф : А – низкая концентрация
Ф ( ПЕП), В- ПЕПФО
Слайд 32Генетический контроль синтеза кф1 (Pho3p)
КФ1 – структурный ген РНО3
Не регулируется
фосфатом
мутации, снижающие активность КФ1, возникают как минимум еще в 6
генахдобавление тиаминпирофосфата – подавляет транскрипцию РНО3
Ген РНО3 клонирован и кодирует белок с молекулярным весом 57 кДа, на 87% идентичный Pho5p
Слайд 33Pho5p
Репрессия фосфатом
Структурный ген РНО5
Промотор используется в биотехнологии
Структурная часть гена используется
в качестве репортерного гена
Слайд 38Позитивные регуляторы РНО5
РНО4
Мутации рецессивные, снижающие активность репрессибельных КФ
на среде без фосфата.
Мутации pho4 эпистатируют все другие регуляторные
мутации pho, что позволило считать Pho4p позитивным активатором РНО5. Кроме того, в гене РНО4 возникают доминантные конститутивные мутации - РНО4С, которые затрагивают область взаимодействия белка Pho4p c Pho80p.
Ген РНО4 локализован в VI хромосоме и кодирует небольшой белок 34 кДа (309 а. к.), состоящий из N-терминального (1-109) кислого активирующего и С-терминального основного ДНК-связывающего доменов .
N – терминальная часть молекулы содержит последовательность (1-31), которая необходима для взаимодействия с циклином Pho80p, а также область (73-99), необходимую и достаточную для активации транскрипции.
Центральная часть молекулы содержит участки (154-200) и (200-218), взаимодействующие с Pho80p и Pho2p, соответственно.
С-терминальная часть молекулы Pho4p содержит bHLH (helix-loop-helix) – мотив, найденный и в других активаторах эукариот .
Слайд 391 Superclass: Basic Domains
1.2 Class: Helix-loop-helix factors (bHLH)
Связываются в виде гомо- или гетеродимеров с E-box CANNTG
Представители:
MioD, Pho4p и др.Слайд 40Активность Pho4p регулируется на нескольких уровнях:
На уровне локализации белка в
компартментах. В фосфорилированном состоянии Pho4p находится в цитоплазме, в нефосфорилированном
- в ядре2. На уровне фосфорилирования белковой молекулы. Pho80p - Pho85p фосфорилирует Pho4p по пяти Ser в положении 100, 114, 128, 152, 233.
Фосфорилирование Ser114 и Ser128 - экспорт Pho4p из ядра при помощи экспортного рецептора Msn5p ,
Фосфорилирование Ser152 ингибирует ядерный импорт Pho4p, предотвращая связывание с белком - импортером Pse1p
Фосфорилирование сайта Ser233 ингибирует связывание Pho4p с Pho2p.
На среде с высокой концентрацией Фн Pho4p фосфорилирован по сайтам Ser114, Ser128, Ser233,
на среде без фосфата Pho4p не фосфорилирован,
на промежуточной концентрации фосфата всегда фосфорилирован сайт Ser233, но не всегда Ser114, Ser128.
3. Регуляция Pho4 может осуществляться на уровне димеризации
4. На уровне стабильности мРНК PHO4
Слайд 41Pho2p
Pho2p - (Bas2, Grf10) транскрипционный активатор генов РНО-регулона, с молекулярной
массой 83 кДа.
Ген РНО2 локализован в хромосоме IV, мутации
pho2 приводят к отсутствию экспрессии генов РНО и нарушению споруляции.В N-терминальной области Pho2p расположен сигнал ядерной локализации
Белок содержит консервативную последовательность «homeobox», которая участвует в связывании с ДНК , а также кислую и богатую глутамином области, характерные для белков - активаторов транскрипции.
Для взаимодействия с Pho4p необходима С-терминальная область Pho2p
Pho4p инициирует освобождение промотора РНО5 от нуклеосом, а Pho2p либо дестабилизирует взаимодействие гистон - ДНК, либо обеспечивает их взаимодействие с Pho4p
Активность Pho2p также регулируется фосфорилированием, которое осуществляет циклин-зависимая фосфопротеинкиназа Cdc28р и только в фосфо-форме он может взаимодействовать с Pho4 и активировать РНО5
Слайд 42PHO81
В гене РНО81 возникают мутации двух типов – рецессивные, приводящие
к отсутствию дерепрессии гена РНО5, и доминантные мутации, приводящие к
конститутивной экспрессии гена РНО5.в промоторной области идентифицированы сайты связывания для Рho4p и Рho2p, а также негативная регуляторная последовательность (NRS). Делеция этой области в 4 раза повышает уровень экспрессии РНО81.
В регуляции транскрипции гена РHO81 участвуют основные регуляторные белки РHO-регулона.
Белок Pho81p (134кДа), в белке была идентифицирована область 80 аминокислот (645-724 а.к.), которая достаточна для связывания с циклин-киназным комплексом.
Белок Pho81 преимущественно локализован в ядре, но может находиться и в цитоплазме, и в эндоплазматических мембранах, транспорт этого белка в ядро осуществляется при помощи Pho80p .
Комплекс Pho81p-Pho80p-Pho85p существует всегда и на среде без фосфата, и на среде с фосфатом, но только на среде без фосфата Pho81p способен ингибировать киназу Pho85p.
Возможна протеолитическая деградация
Слайд 43Негативные регуляторы синтеза КФ
Pho85 – циклин-зависимая киназа. Ген РНО85 локализован
в XVI хромосоме, содержит интрон и кодирует белок c молекулярной
массой около 35 кДа.Семейство СDK : Cdc28p, Ssn3p, Kin28p , Pho85p, Cak1p
Pho80 - В отличие от истинных циклинов Pho80p можно отнести к циклинам лишь условно, так как экспрессия гена РНО80 не меняется в ходе клеточного цикла.
в гене РНО80 были идентифицированы мутации двух типов: рецессивные, приводящие к конститутивному синтезу КФ и полудоминантные мутации со сниженной активностью КФ на среде с фосфатом .
Ген РНО80 (1,8 т.п.о.) локализован в хромосоме XV и кодирует белок 293 а. к.
Слайд 45Плейотропные эффекты Pho85
Штаммы с мутациями pho85, как правило,
не растут
при 37С,
имеют нарушенную морфологию клеток,
не способны расти на
глицерине и спирте,накапливают гликоген ,
чувствительны к аминогликозидным антибиотикам
Диплоиды, гетерозиготные по мутации pho85, плохо спорулируют
дыхательно некомпетентны
Следует отметить, что мутации pho85 приводят к постоянной локализации Pho4p в ядре.
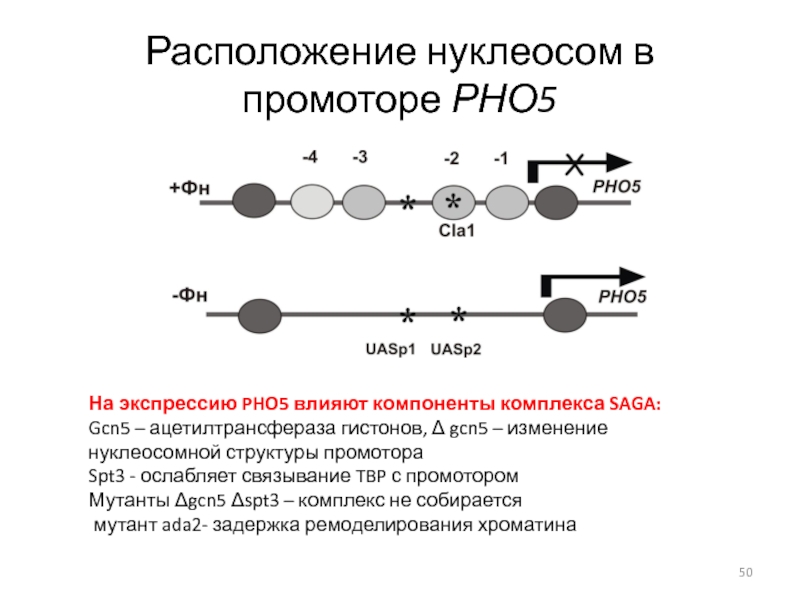
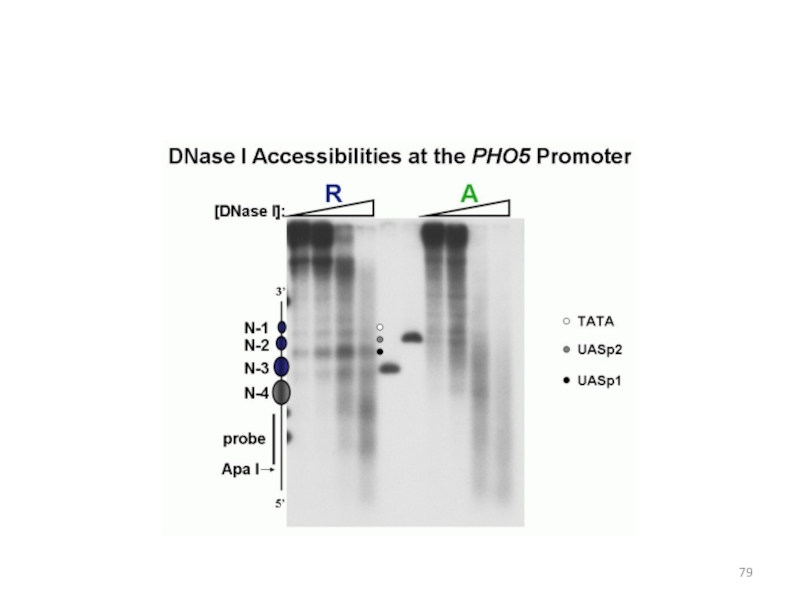
Слайд 50Расположение нуклеосом в промоторе РНО5
На экспрессию PHO5 влияют компоненты комплекса
SAGA:
Gcn5 – ацетилтрансфераза гистонов, gcn5 – изменение нуклеосомной структуры
промотораSpt3 - ослабляет связывание TBP с промотором
Мутанты gcn5 spt3 – комплекс не собирается
мутант ada2- задержка ремоделирования хроматина
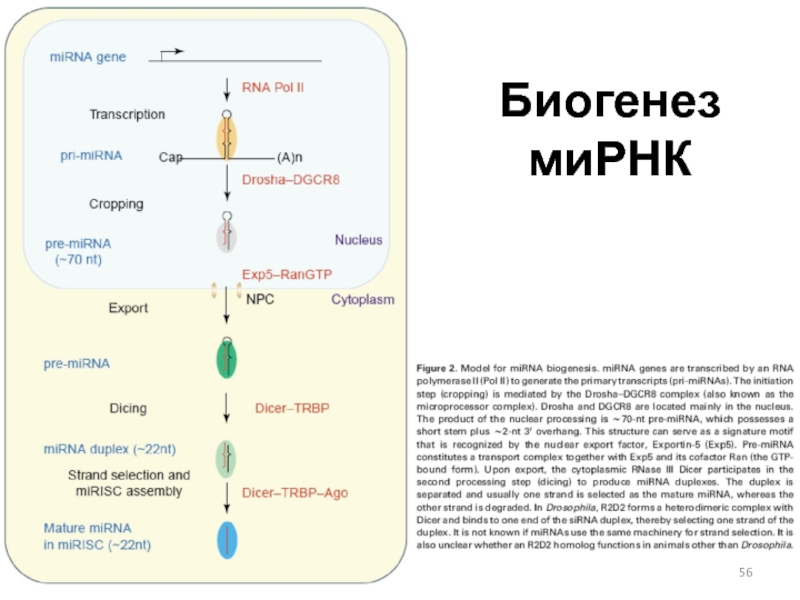
Слайд 54Этапы изучения РНК-сайленсинга
«ко-супрессия» у растений (1990 г.)
quelling («подавление»)
у Neurospora crassa (1996 г.)
«РНК-интерференция» (RNAi) у C. elegans
(1998 г., 2000 г.)регуляция с помощью миРНК у C. elegans (2000-2001 гг.)
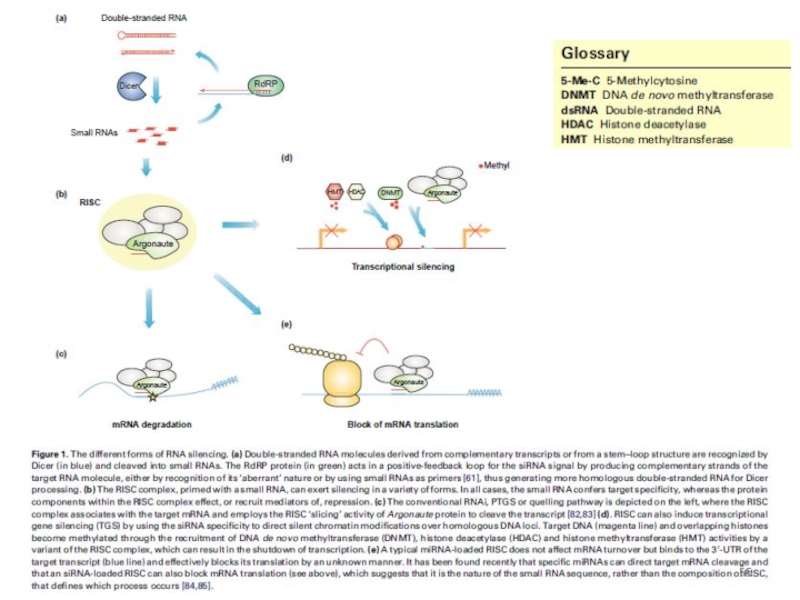
РНК-сайленсинг:
посттранскрипционный генный сайленсинг (PTGS) - с участием комплементарных (антисмысловых) молекул РНК, распознающих целевую РНК и образующих с ней дуплексы;
транскрипционный генный сайленсинг (TGS) – с формированием гетерохроматина. Показан для Schizosaccharomyces pombe (Almeida & Allshire, 2005).
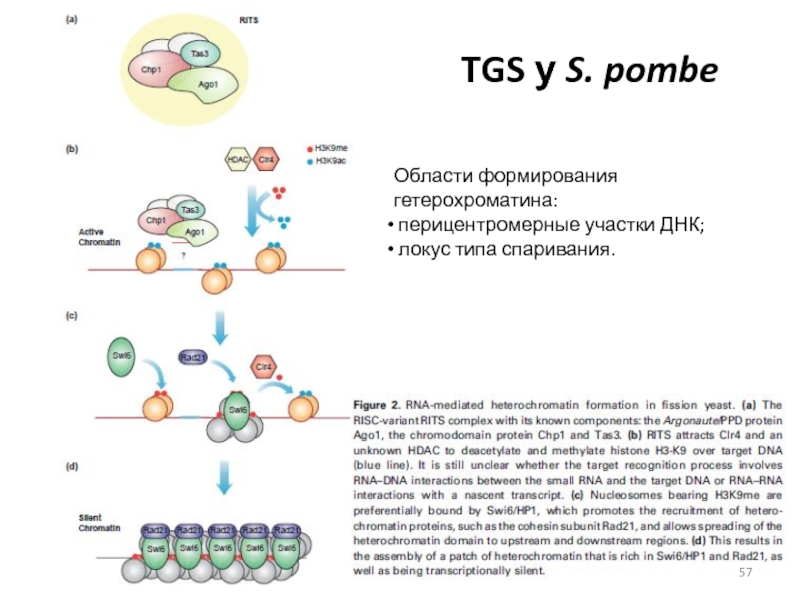
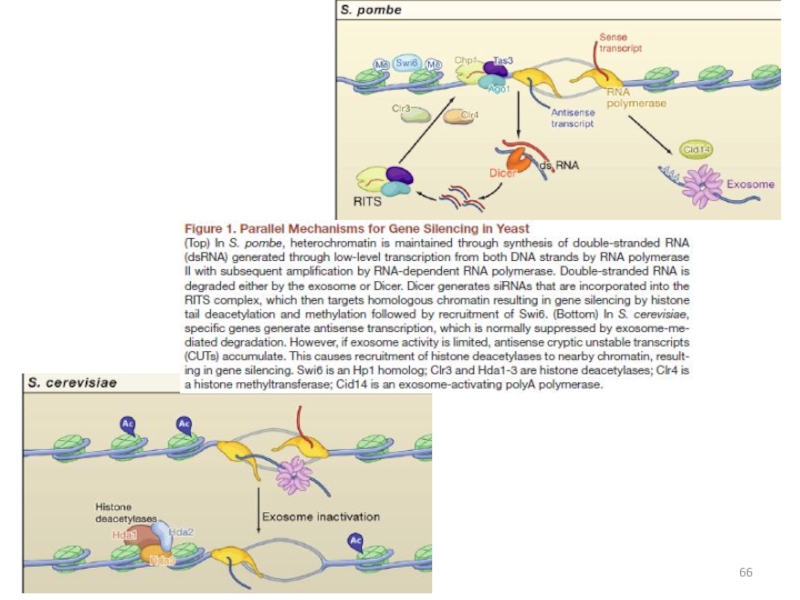
Слайд 57TGS у S. pombe
Области формирования гетерохроматина:
перицентромерные участки ДНК;
локус
типа спаривания.
Слайд 58 В 2008 году у дрожжей S. pombe выявлены короткие нкРНК,
синтезируемые в промоторе гена fbp1 при удалении глюкозы из среды
(Hirota et al., 2008).Эти нкРНК запускают перестройки хроматина в промоторе, необходимые для инициации транскрипции.
Показана позитивная регуляция экспрессии, в основе которой лежат процессы, противоположные TGS: РНК-полимераза II синтезирует «смысловую» нкРНК, которая вызывает раскрытие хроматина в области промотора и активацию транскрипции.
Слайд 59Регуляторные
некодирующие РНК
дрожжей S. cerevisiae
У дрожжей S. cerevisiae нет
РНК-интерференции!!!
… но есть нкРНК, в том числе асРНК.
Слайд 60Источники нкРНК у дрожжей:
Двунаправленная транскрипция – многие промоторы могут
запускать транскрипцию в обоих направлениях; выявлено большое количество кластеров нкРНК
(около 250 н.); большинство таких РНК считывается или начинает считываться в межгенной области между двумя близко расположенными генами; промотор второго гена работает в обоих направлениях; получается «сенс»-нкРНК для второго гена и «антисенс»-нкРНК для первого гена.Транскрипция коротких «сенс»-нкРНК с альтернативных точек инициации выше точки начала синтеза мРНК.
Транскрипция «сенс»- и «антисенс»-нкРНК с разных скрытых внутренних точек инициации – регуляция скрытой транскрипции, аналогично альтернативному сплайсингу, может быть механизмом синтеза альтернативных белковых продуктов.
Наиболее распространен у дрожжей первый способ синтеза нкРНК.
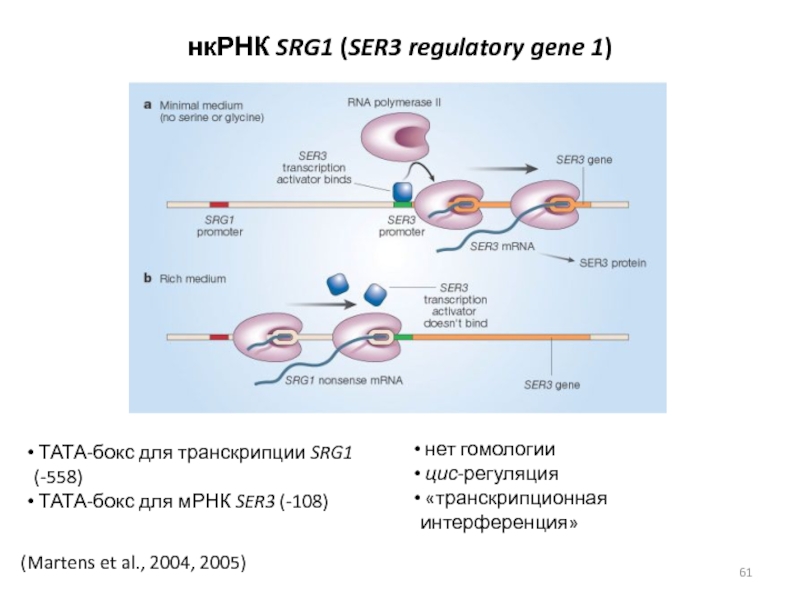
Слайд 61(Martens et al., 2004, 2005)
нкРНК SRG1 (SER3 regulatory gene 1)
ТАТА-бокс для транскрипции SRG1 (-558)
ТАТА-бокс для мРНК SER3 (-108)
нет гомологии
цис-регуляция
«транскрипционная интерференция»
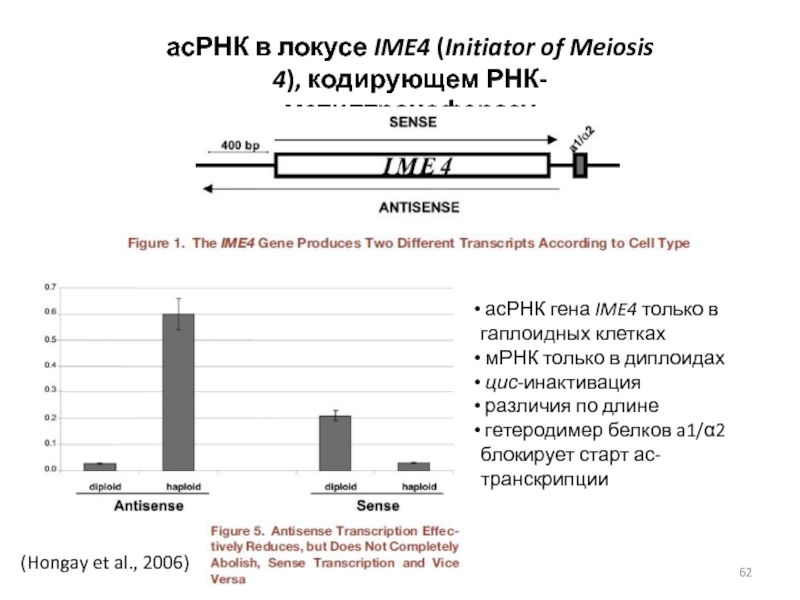
Слайд 62(Hongay et al., 2006)
асРНК в локусе IME4 (Initiator of Meiosis
4), кодирующем РНК-метилтрансферазу
асРНК гена IME4 только в гаплоидных клетках
мРНК только в диплоидахцис-инактивация
различия по длине
гетеродимер белков a1/α2 блокирует старт ас-транскрипции
Слайд 63(David et al., 2006)
Идентифицированы асРНК для 1555 генов дрожжей
Например, обнаружена
асРНК для гена SPO22, экспрессия которого специфична для мейоза на
ранних этапах.Перед точкой инициации ас-транскрипции в этом локусе расположен участок связывания для фактора Cbf1, который чувствителен к сигналам о составе среды и вовлечен в регуляцию репликации.
Предполагается, что ас-транскрипция запускается в условиях, неблагоприятных для мейоза, т.е. в богатой среде, в результате чего подавляется активность гена SPO22 и вход в мейоз.
Фактор Cbf1 активирует ас-транскрипцию и подавляет транскрипцию гена SPO22.
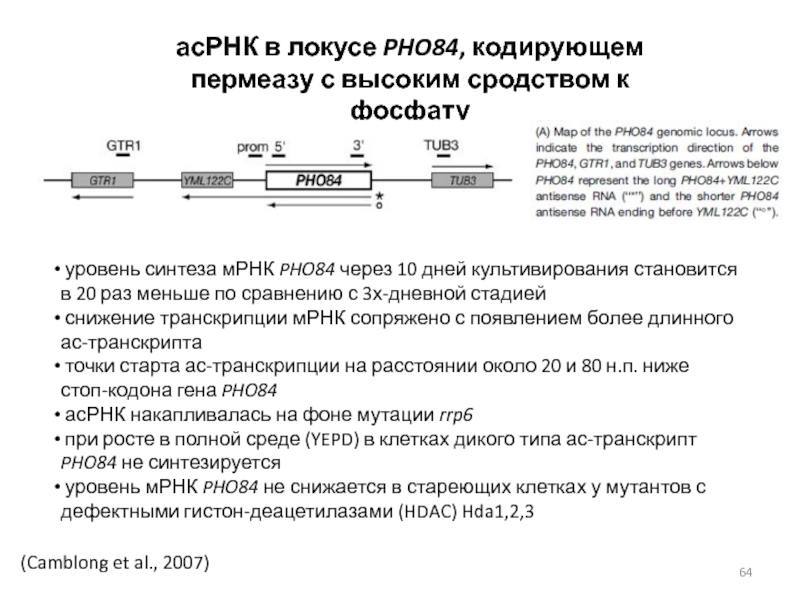
Слайд 64(Camblong et al., 2007)
асРНК в локусе PHO84, кодирующем пермеазу с
высоким сродством к фосфату
уровень синтеза мРНК PHO84 через 10
дней культивирования становится в 20 раз меньше по сравнению с 3х-дневной стадиейснижение транскрипции мРНК сопряжено с появлением более длинного ас-транскрипта
точки старта ас-транскрипции на расстоянии около 20 и 80 н.п. ниже стоп-кодона гена PHO84
асРНК накапливалась на фоне мутации rrp6
при росте в полной среде (YEPD) в клетках дикого типа ас-транскрипт PHO84 не синтезируется
уровень мРНК PHO84 не снижается в стареющих клетках у мутантов с дефектными гистон-деацетилазами (HDAC) Hda1,2,3
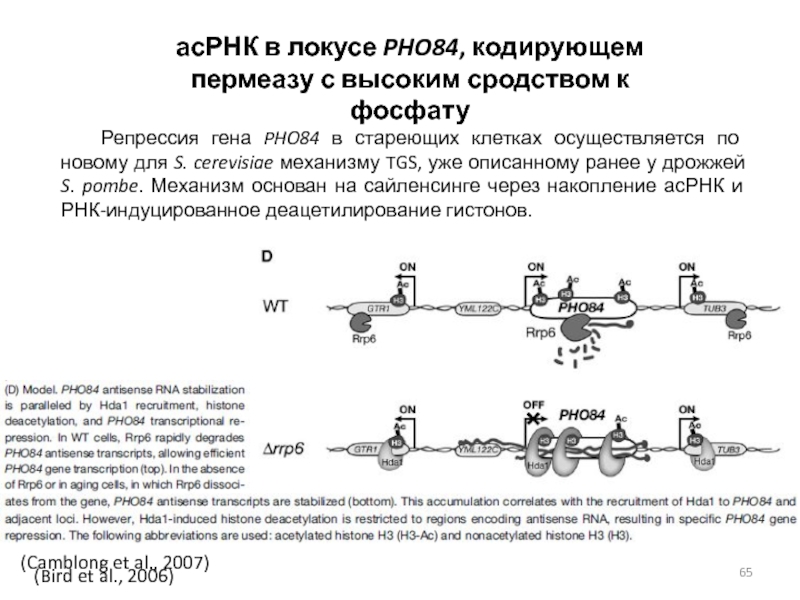
Слайд 65асРНК в локусе PHO84, кодирующем пермеазу с высоким сродством к
фосфату
Репрессия гена PHO84 в стареющих клетках осуществляется по новому для
S. cerevisiae механизму TGS, уже описанному ранее у дрожжей S. pombe. Механизм основан на сайленсинге через накопление асРНК и РНК-индуцированное деацетилирование гистонов.(Camblong et al., 2007)
(Bird et al., 2006)
Слайд 67(Houseley et al., 2008)
асРНК внутри гена GAL10, кодирующего УДФ-глюкозо-4-эпимеразу
два
ас-транскрипта, 4000 и 2800 н.
ас-транскрипция запускается в отсутствие галактозы,
т.е. в репрессирующих условиях для гена GAL10гены GAL1 и GAL10 расположены рядом и разнонаправлены
асРНК начинается около 3'-конца GAL10, проходит через общий промотор GAL1-GAL10 и терминируется внутри гена GAL1
фактор Reb1 связывается с ДНК рядом с точкой инициации асРНК
в область кластера привлекается метилтрансфераз Set2, это приводит к ди- и триметилированию H3K4 в гене GAL10, триметилированию H3K36 и деацетилированию Н3 в нуклеосомах по всему локусу
репрессия генов кластера GAL за счет формирования гетерохроматина (TGS)
Выявлены 215 сайтов связывания Reb1 в кодирующих областях по всему геному дрожжей. Эти сайты были выявлены в повторяющихся генах рРНК и в теломерных областях. Сайт для Reb1 был обнаружен в 3'-области локуса PHO84 рядом с точкой инициации ас-транскрипции.
Слайд 68(2008 г.)
Авторегуляция транскрипции генов биосинтеза гуанидина IMD2 и урацила URA2
URA2:
при достаточном количестве нуклеотидов используется альтернативный ТАТА-сайт
этот
сайт расположен в промоторе немного выше ТАТА, с которого считывается мРНК в условиях истощения У-нуклеотидовсинтезируются короткие нестабильные нкРНК
ранний старт транскрипции приводит к синтезу цис-регуляторного элемента (R-бокса) в структуре нкРНК, который распознается специальными факторами
IMD2:
механизм аттенюации
2 ТАТА-сайта: ранний «G» и мРНК-овый «А», который занимается полимеразой при нехватке ГТФ
ГТФ-зависимая аттенюация открыта для гена PSA1. Тут регуляция позитивная: ТАТА-бокс «G» расположен ниже и служит для инициаиции мРНК.
Гены URA8, IMD3 ADE12 – другие авторегулируемые гены биосинтеза нуклеотидов, также связанные с короткими нестабильными нкРНК.
Слайд 69(Bird et al., 2006)
нкРНК ZRR1 против гена ADH1, кодирующего основную
цинк-зависимую алкоголь-дегидрогеназу
активатор Zap1 связывается с ДНК выше локуса ADH1
и запускает межгенный синтез нкРНК ZRR1 в прямой ориентациинкРНК транскрибируется через UAS активатора Rap1 в промоторе гена ADH1, тем самым закрывая этот сайт от связывания и выключая ген
Такой же механизм регуляции был показан для локуса ADH3, нкРНК называется ZRR2.
Слайд 70(Uhler et al., 2007)
асРНК в локусе PHO5, кодирующем репрессибельную кислую
фосфатазу
единственный известный пример позитивной регуляции с асРНК у S.
cerevisiaeдлина асРНК = 2400 н., превышает размер гена PHO5 (1400 н.п.)
асРНК синтезируется с 3'-конца гена до точки -950 в промоторе
в репрессирующих условиях, т.е. при высокой концентрации фосфата в среде
вызывает перестройки хроматина в области промотора
в результате перестроек разбираются четыре нуклеосомы, освобождается участок 600 н.п.
эти перестройки усиливают ответ клетки при снижении уровня фосфата в среде
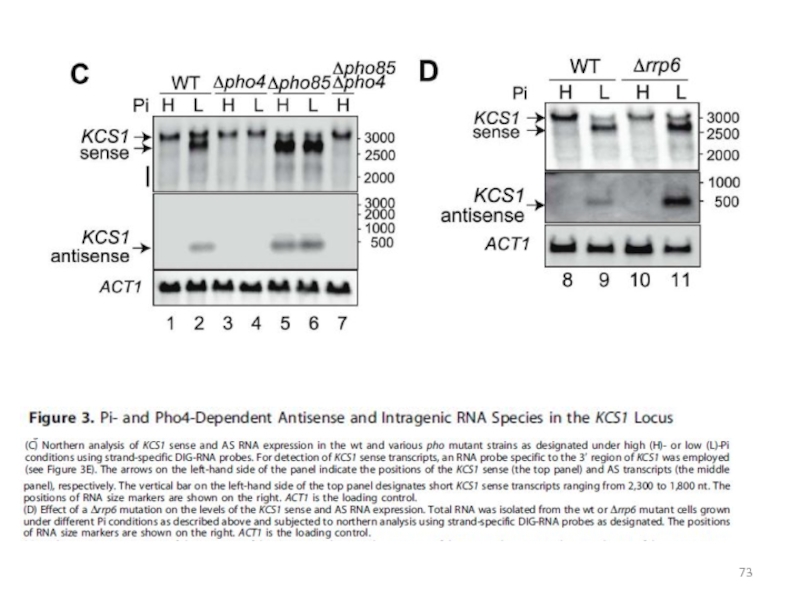
Слайд 71Укороченная РНК и асРНК в локусе KCS1, кодирующем IP6-протеинкиназу
(Nishizawa et
al., 2008)
сигнал о снижении концентрации фосфата принимает транскрипционный активатор
Pho4сигнал об истощении фосфатов передается разновидностью инозитол-полифосфатов, IP7
ген KCS1 кодирует киназу, синтезирующую 5-PP-IP5 (5-дифосфо-миоинозитол-пентафосфат)
киназа Vip1 синтезирует другие изомеры IP7: 4- или 6-PP-IP5
изомеры IP7, синтезированные с участием Vip1, запускают дерепрессию PHO-регулона
сверхпродукция киназы Kcs1 ослабляет дерепрессию гена PHO5
при снижении концентрации фосфата внутри гена KCS1 инициируются транскрипции двух видов молекул РНК: укороченной смысловой РНК и короткой нкРНК в обратной ориентации, в результате чего не происходит синтез полноразмерного белка Kcs1
Слайд 72Укороченная РНК и асРНК в локусе KCS1, кодирующем IP6-протеинкиназу
выявлены
три предполагаемых внутренних сайта связывания фактора Pho4 (+406, +1127, +1393),
которые распознаются активатором только при снижении фосфатоводин внутренний ATG (+676)
три точки старта транскрипции: -14 – начало полноразмерной мРНК, +537 - начало укороченного сенс-транскрипта, +237 – точка старта транскрипции асРНК в направлении промотора гена KCS1
Слайд 74асРНК, транскрибируемая с мобильного элемента Ty1
(Berretta et al., 2008)
транс-регуляция
эти асРНК подавляют транскрипцию мРНК репортерных генов и эндогенной мРНК
других элементов Ty1аналог РНК-интерференции