Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ГЕННАЯ ИНЖЕНЕРИЯ В БИОТЕХНОЛОГИИ
Содержание
- 1. ГЕННАЯ ИНЖЕНЕРИЯ В БИОТЕХНОЛОГИИ
- 2. Вопрос 1. История развития генной инженерииГенная инженерия
- 3. Этапы развития генной инженерии:Первый этап - работы
- 4. Методы генной инженерии и способы получения
- 5. 2. МЕТОД. Секвенирование ДНК - определение последователь-ности
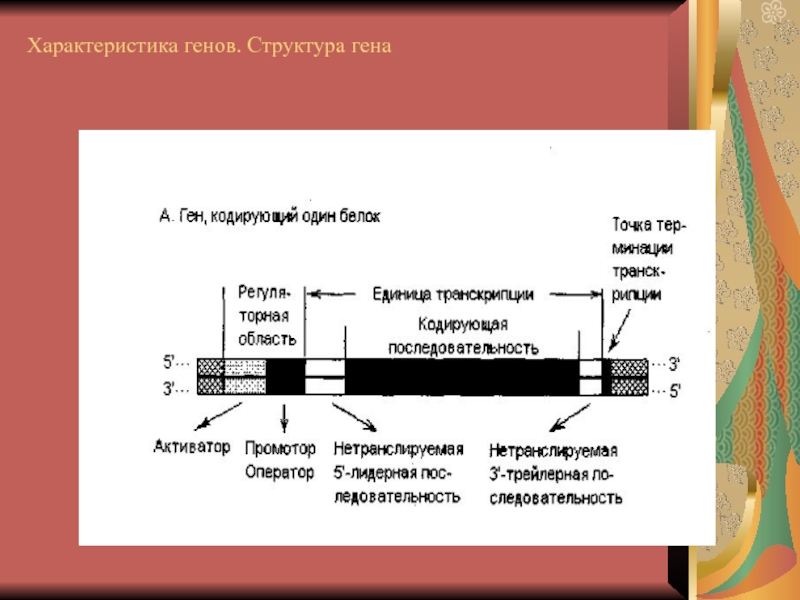
- 6. Характеристика генов. Структура гена
- 7. Слайд 7
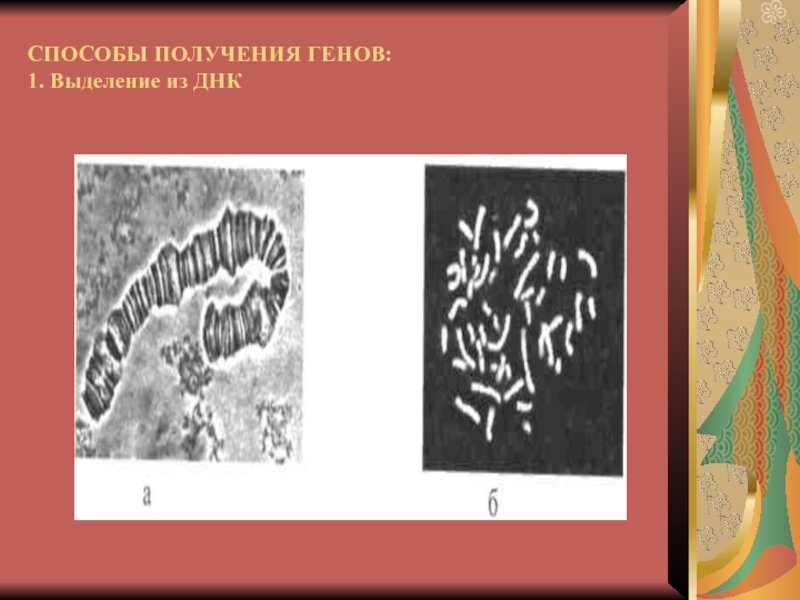
- 8. СПОСОБЫ ПОЛУЧЕНИЯ ГЕНОВ: 1. Выделение из ДНК
- 9. 2. Химико-ферментативный синтез генов а) матрица ДНК
- 10. Пути переноса генов:1. Получение фрагментов ДНК (генов).2.
- 11. 4. Идентификация и отбор клеток, несущих рекомбинантную
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
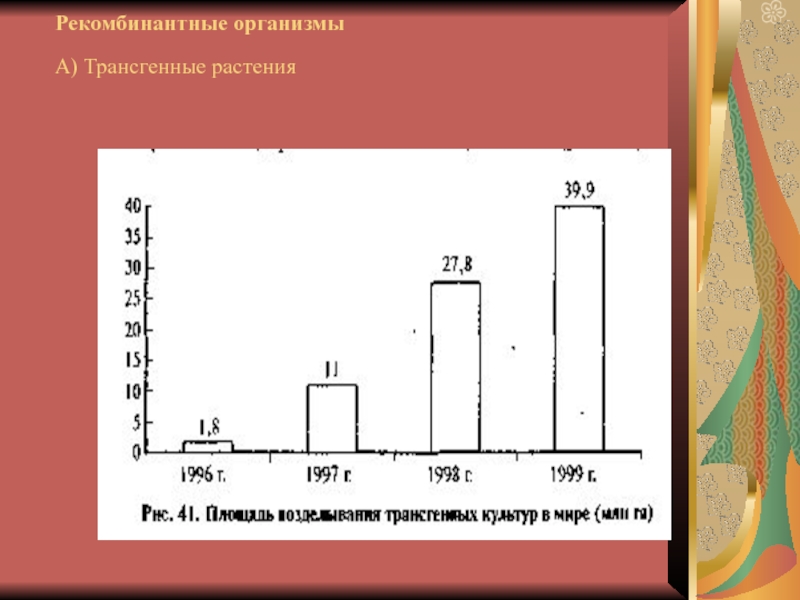
- 15. Рекомбинантные организмы А) Трансгенные растения
- 16. Слайд 16
- 17. Слайд 17
- 18. Признаки, контролиролируемые перенесенными генами в растенияУстойчивость к
- 19. Слайд 19
- 20. Слайд 20
- 21. Этапы переноса генов в клетки растений.
- 22. Слайд 22
- 23. Б) ТРАНСГЕННЫЕ ЖИВОТНЫЕМетоды введения чужеродной ДНК в
- 24. Рис. Микроинъекция ДНК в оплодотворенную яйцеклетку: а
- 25. 5. Степень безопасности трансгенных продуктовОценка генно-модифицированного организма
- 26. Слайд 26
- 27. 1. Биобезопасность генно-модифицированных продуктов – оценка потенциальной
- 28. Слайд 28
- 29. Этапы исследований на биобезопасность трансгенных микроорганизмов:1. Лабораторные
- 30. 2.Пищевая токсиколого-гигиеническая оценка трансгенных культурОценка пищевых свойств
- 31. Токсикологическая характеристика предусматривает определение следующих показателей:токсикокинетика,генотоксичность,потенциальная аллергенность,потенциальная
- 32. Медико-генетическая оценка – включает экспертизу структуры рекомбинантной
- 33. Скачать презентанцию
Вопрос 1. История развития генной инженерииГенная инженерия (технология рекомбинантных ДНК, молекулярное клонирование) - это совокупность экспериментальных процедур, позволяющих осуществлять перенос генетического материала из одного организма в другой. Генная инженерия - конструирование
Слайды и текст этой презентации
Слайд 1 ГЕННАЯ ИНЖЕНЕРИЯ В БИОТЕХНОЛОГИИ
1. История развития генной инженерии. Методы
генной инженерии и способы получения генов 2. Степень безопасности трансгенных продуктов.
аспекты генной инженерииСлайд 2Вопрос 1. История развития генной инженерии
Генная инженерия (технология рекомбинантных ДНК,
молекулярное клонирование) - это совокупность экспериментальных процедур, позволяющих осуществлять перенос
генетического материала из одного организма в другой.Генная инженерия - конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК), или как создание искусственных генетических программ.
Генная инженерия – управление генетической основой организмов посредством внедрения или удаления специфических генов, с использованием техники современной молекулярной биологии.
Задача конструировать рекомбинантные ДНК, которые могли бы придать клеткам-реципиентам полезные для человека свойства (синтезировать пищевой и кормовой белок).
Слайд 3Этапы развития генной инженерии:
Первый этап - работы касаются получения гибридов
между различными плазмидами и фагами, иначе говоря, конструированием так называемых
векторных молекул.Плазмиды – автономно реплицирующиеся небольшие, чаще кольцевые молекулы ДНК, содержащие сразу несколько сайтов рестрикции для разных рестрикционных ферментов.
Фаг – вирусная ДНК, паразитирующая в клетках микроорганизмов.
2. Второй этап связан с началом работ по получению рекомбинатных молекул ДНК между хромосомными генами прокариот и различными плазмидами, доказательством их стабильности и жизнеспособности.
3. Третий этап связан с началом работ по включению в векторные молекулы ДНК генов эукариот, главным образом, растений и животных.
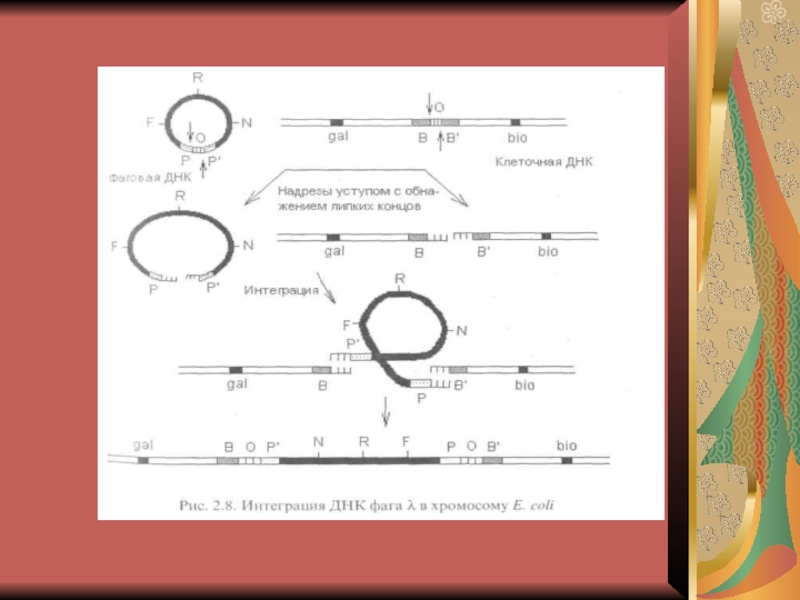
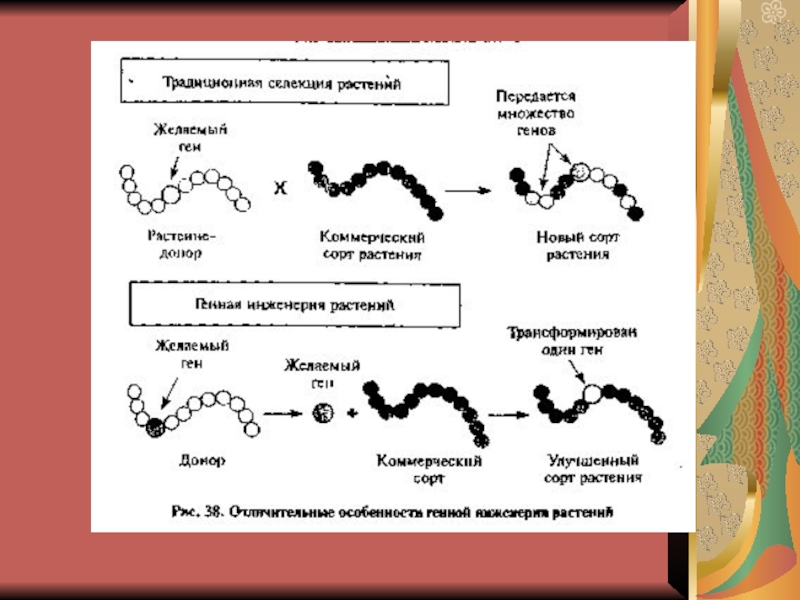
Слайд 4 Методы генной инженерии и способы получения генов.
1. Метод рекомбинантных
ДНК. Ферменты, которые в настоящее время применяются для конструирования рекомбинантных
ДНК, можно разделить на следующие группы:• Ферменты, осуществляющие фрагментацию ДНК (рестриктазы).
• Фермент, синтезирующий фрагменты ДНК на матрице РНК: РНК-зависимая ДНК-полимераза (обратная транскриптаза).
• Ферменты, сшивающие фрагменты ДНК: ДНК-лигаза (полинуклеотидлигаза).
• Ферменты, позволяющие осуществлять изменение структуры концов фрагментов ДНК: нуклеаза.
• Ферменты, применяемые для приготовления гибридизационных проб: ДНК-полимераза.
Слайд 52. МЕТОД. Секвенирование ДНК - определение последователь-
ности нуклеотидов в ее
молекулах.
2.1.Секвенирование обрыва цепи
2.2.Секвенирование химическим расщеплением
3. МЕТОД. химического
и химико-энзиматического синтеза дезоксиполинуклеотидов. Слайд 92. Химико-ферментативный синтез генов
а) матрица ДНК и с помощью
полинуклеотидфосфорилаз,
б) матрица мРНК с затравкой с 3' конца для
комплементарной цепи ДНК. 3. Ферментативный синтез
Слайд 10Пути переноса генов:
1. Получение фрагментов ДНК (генов).
2. Создание рекомбинантной генетической
конструкции. На этом этапе производится встраивание нужного фрагмента ДНК (вставки)
в другую молекулу ДНК (вектор). Для выделения, анализа и конструирования генов используют клетки прокариот.3. Введение ДНК в клетку-хозяина. Получившуюся молекулу рекомбинантной ДНК вводят в клетку-хозяина (реципиент), где она реплицируется (размножается) либо самостоятельно, либо интегрируется в хромосому и передается потомкам.
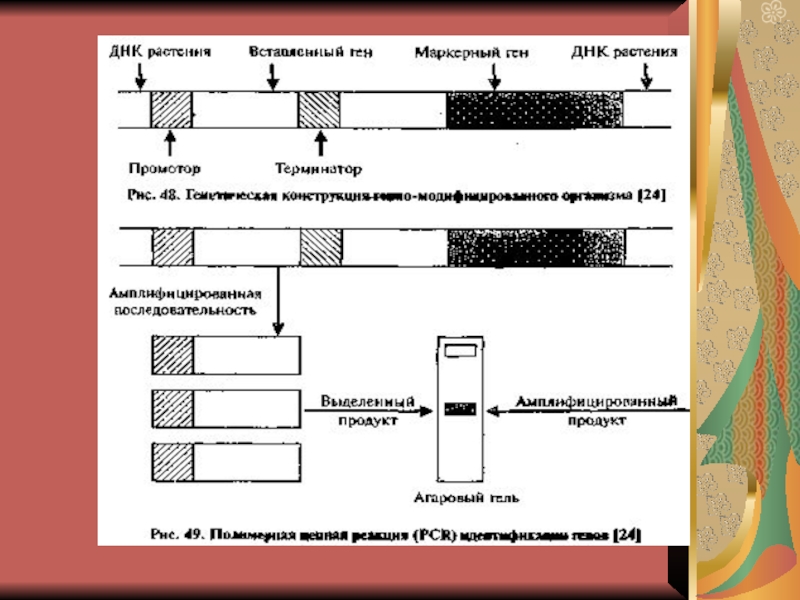
Слайд 114. Идентификация и отбор клеток, несущих рекомбинантную ДНК. Производится на
селективной среде, на которой могут вырасти только трансформированные клетки.
5.
Анализ экспрессии (встраивания)перенесенного гена в ДНК-клетку хозяина. Получение специфического белкового продукта, синтезирующегося клетками-хозяевами, служит подтверждением их трансгенной природы.С момента введения рекомбинантной ДНК в клетку начинается молекулярное клонирование, т.е. получение потомков созданной рекомбинантной ДНК.
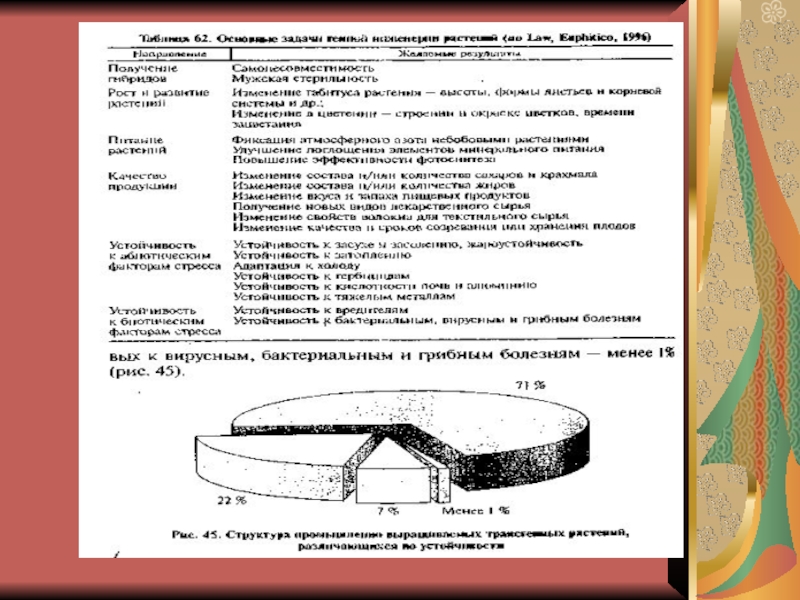
Слайд 18Признаки, контролиролируемые перенесенными генами в растения
Устойчивость к гербецидам.
Устойчивость к
насекомым вредителям.
Устойчивость к гербицидам и насекомым.
Устойчивость к вирусам.
Устойчивость к грибным болезням.
Устойчивость одновременно к бактериальной и грибной инфекции.
Устойчивость к абиотическим факторам.
Создание трансгенных растений для фармакологической промышленности.
Выращивание растений с определенным аминокислотным составом.
Создание трансгенных растений, несущих гены, кодирующие синтез вакцин, против многих болезней.
Применение трансгенных растений для фитомедиации – очистки почв, вод от чужеродных загрязнений.
Слайд 21
Этапы переноса генов в клетки растений.
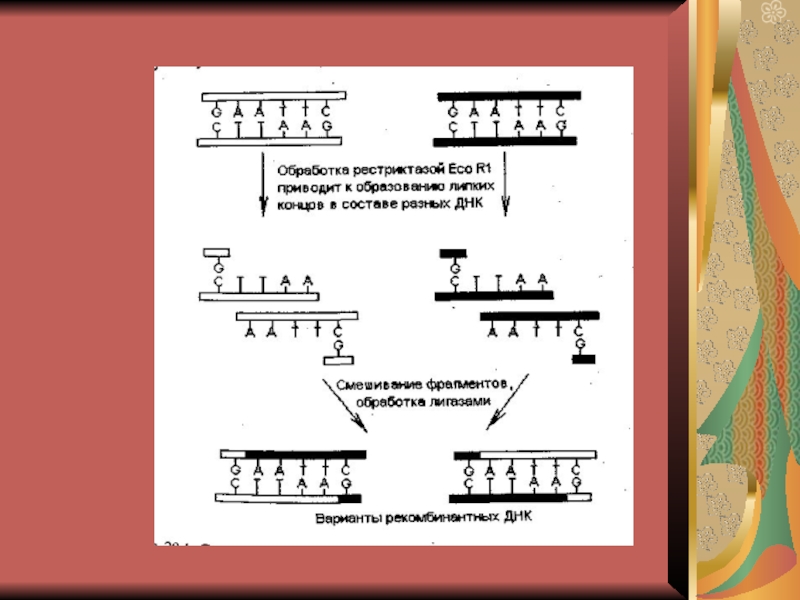
1. Рестриктазы (рестрикционными эндонуклеазами) узнают
определенную последовательность своей ДНК и расщепляют чужую на мелкие фрагменты.
2. Сшивка фрагментов идет тремя методами в зависимости от видов концов.
А) Сшивка по одноименным «липким» концам – любые два фрагмента могут слипаться за счет образования водородных связей между однонитевыми участками комплементарных нуклеотидов.
Б) Сшивка по «тупым» концам – реже используется.
В) Сшивка фрагментов с разноименными «липкими» концами проводят с использование «переходников» - линкеров.
Линкеры – химически синтезированные олигонуклеотиды, представляющие собой сайты рестрикции (места расщипления) или их комбинацию.
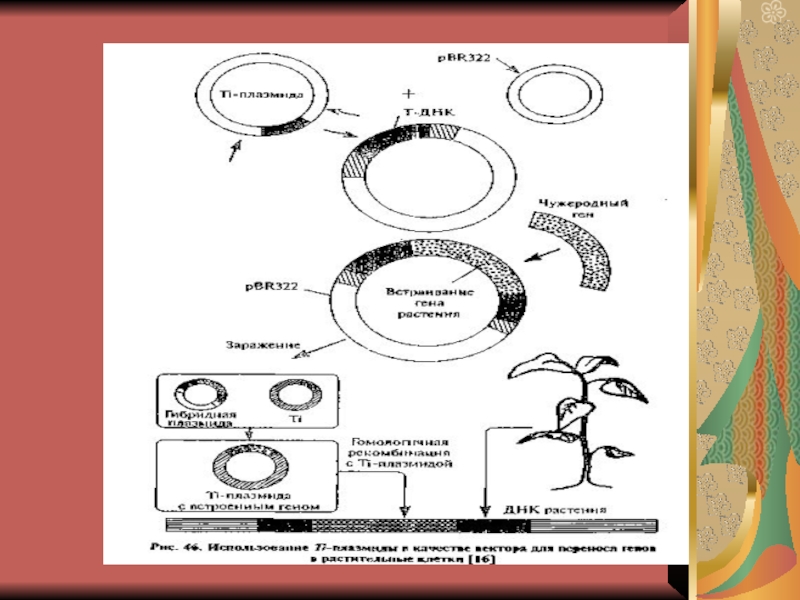
3. Сшитую ДНК в пробирке вносят в живую клетку при помощи векторов разными способами.
Векторы (векторные молекулы) – молекулы ДНК, способные акцептировать чужеродную ДНК и обеспечивающие ее репликацию и даже экспрессию.
Экспрессия гена – проявление генетической информации, записанной в гене, в форме РНК, белка и фенотипического признака.
В качестве векторов используют плазмиды (кольцевые внехромосомные ДНК, автономно реплицирующиеся) и бактериофаги – вирусы, инфицирующие бактерии.
3.1. Использование промежуточного вектора
3.2. Метод биологической баллистики для трансформации однодольных.
Слайд 23Б) ТРАНСГЕННЫЕ ЖИВОТНЫЕ
Методы введения чужеродной ДНК в животные клетки: физическими
методами (микроинъекция, электропорация, слияние липосом), либо при помощи вирусных векторов.
Стратегия
получения трансгенных животных состоит в следующем:1. Клонированный ген в составе вектора вводят в ядро оплодотворенной яйцеклетки.
2. Инокулированные оплодотворенные яйцеклетки имплантируют в реципиентную женскую особь.
3. Отбирают потомков, которые содержат клонированный ген во всех клетках.
4. Скрещивают животных, которые несут клонированный ген в клетках зародышевой линии, и получают новую генетическую линию.
Основные схемы получения трансгенных животных.
1. Вектором на основе ретровируса животных инфицируют восьмимиклеточный эмбрион, который потом имплантируется в самку. Этот способ трансформации считается наиболее эффективным.
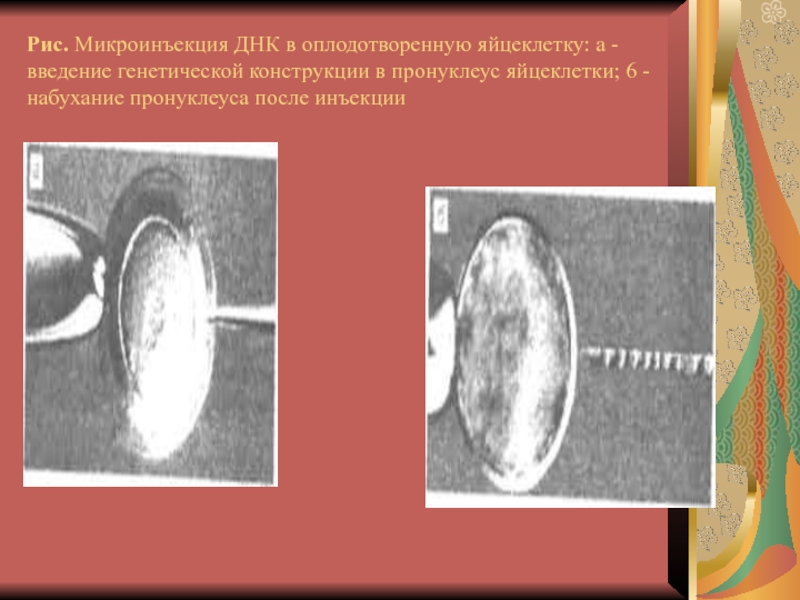
2. Трансгенную конструкцию вводят путем микроинъекции в мужской пронуклеус оплодотворенной яйцеклетки, которая затем переносится в «суррогатную мать».
3. Стволовые клетки модифицируются в культуре, после чего их вводят в эмбрион на стадии бластоцисты.
4. Перенос гена осуществляют при помощи дрожжевых хромосом (YAC), что позволяет переносить несколько генов вместе с их собственными регуляторными последовательностями.
Слайд 24Рис. Микроинъекция ДНК в оплодотворенную яйцеклетку: а - введение генетической
конструкции в пронуклеус яйцеклетки; 6 - набухание пронуклеуса после инъекции
Слайд 255. Степень безопасности трансгенных продуктов
Оценка генно-модифицированного организма по критериям безопасности
складывается из 2 направлений:
исследование биобезопасности организмов.
определение пищевой безопасности трансгенных организмов.
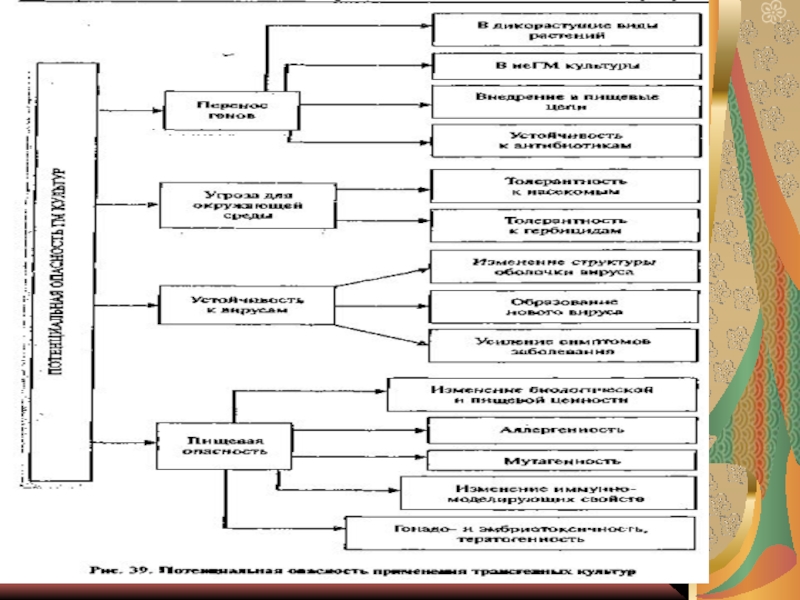
Слайд 271. Биобезопасность генно-модифицированных продуктов – оценка потенциальной опасности трансгенных организмов
для окружающей среды и для человека связана с возможными отрицательными
последствиями:вытеснением природных организмов из их экологических ниш с последующим нарушением экологического равновесия,
уменьшение биоразнообразия,
бесконтрольный перенос чужеродных генов из трансгенных организмов в природные, что может привести к активации ранее известных или образованию новых патогенов.
Слайд 29Этапы исследований на биобезопасность трансгенных микроорганизмов:
1. Лабораторные испытания, подтверждающие отсутствие
опасности штамма.
2. Исследование поведения микроорганизма в изолированной теплице или изолированном
водоеме.3. Проведение мелкоделяночных полевых испытаний.
Крупномасштабные полевые испытания.
Крупномасштабная интродукция трансгенного организма.
Слайд 302.Пищевая токсиколого-гигиеническая оценка трансгенных культур
Оценка пищевых свойств включает изучение:
пищевой ценности
продукта,
норм потребления,
способов использования в питании,
поступления отдельных нутриентов (если ожидаемое поступление
нутриента превышает 15% от его суточной потребности),влияние на микрофлору кишечника (если содержит живые организмы).
Слайд 31Токсикологическая характеристика предусматривает определение следующих показателей:
токсикокинетика,
генотоксичность,
потенциальная аллергенность,
потенциальная колонизация в желудочно-кишечном
тракте (в случае содержания живых организмов),
результаты субхронического (90 суток) токсикологического
эксперимента на лабораторных животных и исследований на добровольцах.Слайд 32Медико-генетическая оценка – включает экспертизу структуры рекомбинантной ДНК, внедренной в
растительный геном, в том числе маркерных генов, промоторов, оценку регуляторных
последовательностей, определение стабильности генетически модифицированных организмов на протяжении нескольких поколений с учетом уровня выраженности генов.Медико-биологическая оценка – определение санитарно-химических показателей качества и безопасности, проведения токсикологических исследований на лабораторных животных, оценки аллергенных свойств, возможных мутагенных и канцерогенных эффектов продукта, изучения влияния на функцию воспроизводства, наблюдений на добровольцах и эпидемиологических исследований.
Исследования технологических свойств – определение ее органолептических и физико-химических свойств, изучения сохранности и влияния генетической модификации на технологические параметры продукции.