Слайд 1Общая геохимия
Лекция 21
Геохимия гидросферы
Слайд 5Гидросферу как геосферу принято понимать в узком и широком смысле
слова.
Гидросфера (в узком смысле слова) – прерывистая оболочка, состоящая из
соленой (моря, океаны), пресной (реки, озера) и твердой (снежный покров, ледники) воды.
Гидросфера (в широком смысле слова) – непрерывная оболочка системы вода-пар, включающая упомянутую гидросферу, а также пронизанную водой или парами литосферу, биосферу и атмосферу.
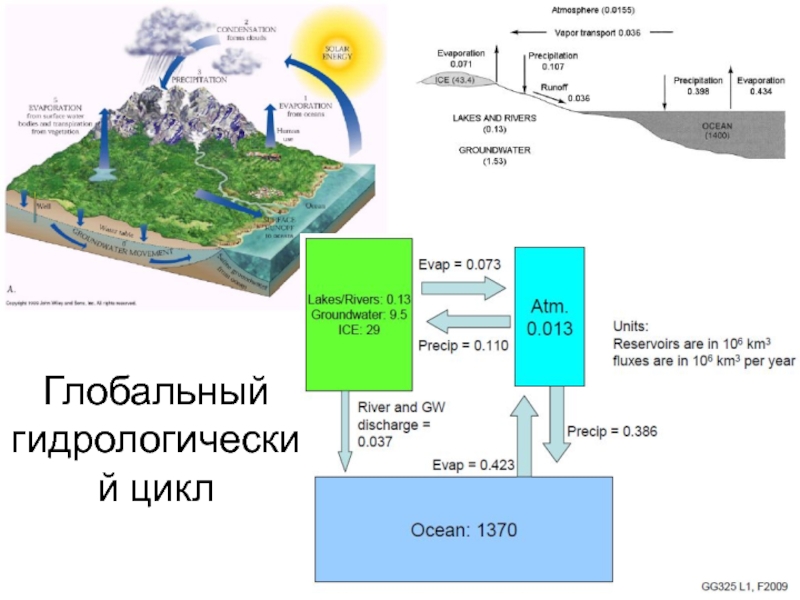
Слайд 7Глобальный гидрологический цикл
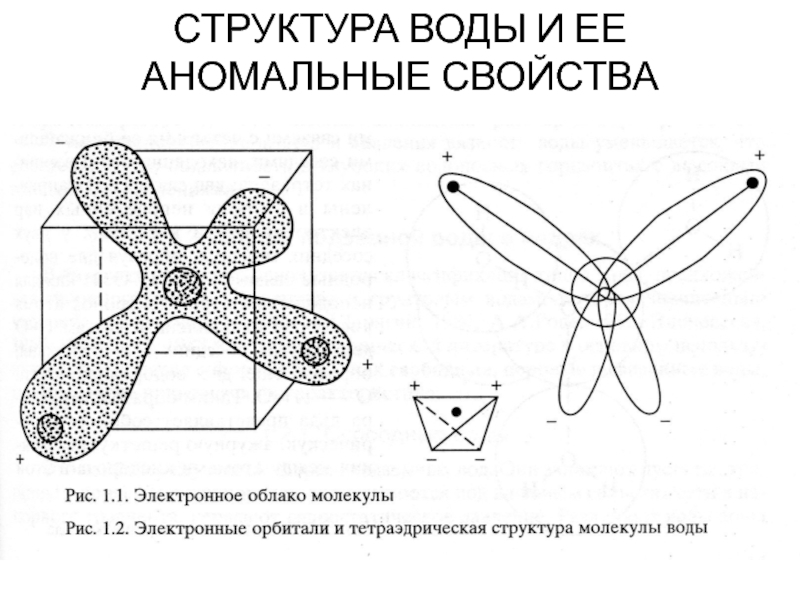
Слайд 8СТРУКТУРА ВОДЫ И ЕЕ
АНОМАЛЬНЫЕ СВОЙСТВА
Слайд 9С современных позиций форму молекулы воды H2O можно представить в
виде электронного облака: атом кислорода расположен в его центре, а
два атома водорода с положительными зарядами – в противоположных углах нижней грани условного куба.
Структуру молекулы воды можно представить в виде тетраэдра: в центре ядро атома О, на двух вершинах положительно заряженные атомы Н, на двух – по два неподеленных электрона.
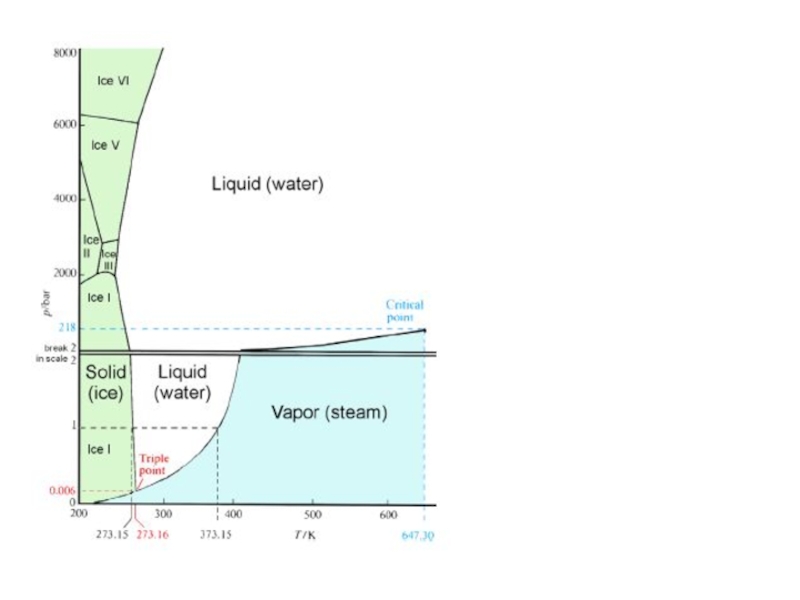
Слайд 10Молекула воды чрезвычайно устойчива, так как атомы кислорода и водорода
связаны между собой ковалентно (Н-О). Распределение + и – зарядов
в молекуле воды обуславливает большой дипольный момент молекулы воды.
Каждая молекула воды взаимодействует с четырьмя соседними молекулами.
Наиболее простой структурой обладает газообразная вода, состоящая из одиночных молекул. Сложной структурой – лед (тетраэдрическая «каркасная» решетка.
С увеличением Р и Т вязкость воды уменьшается, что обеспечивает подвижность воды в глубоких водоносных горизонтах.
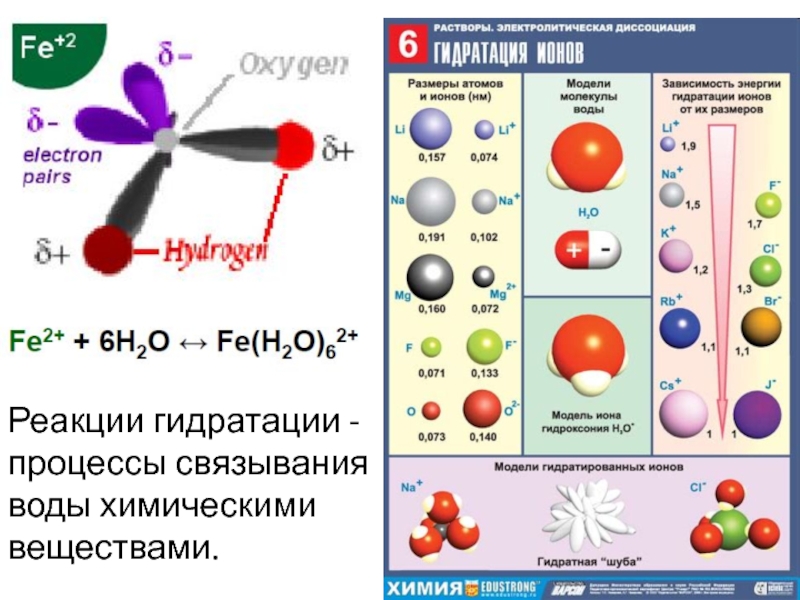
Слайд 12Реакции гидратации - процессы связывания воды химическими веществами.
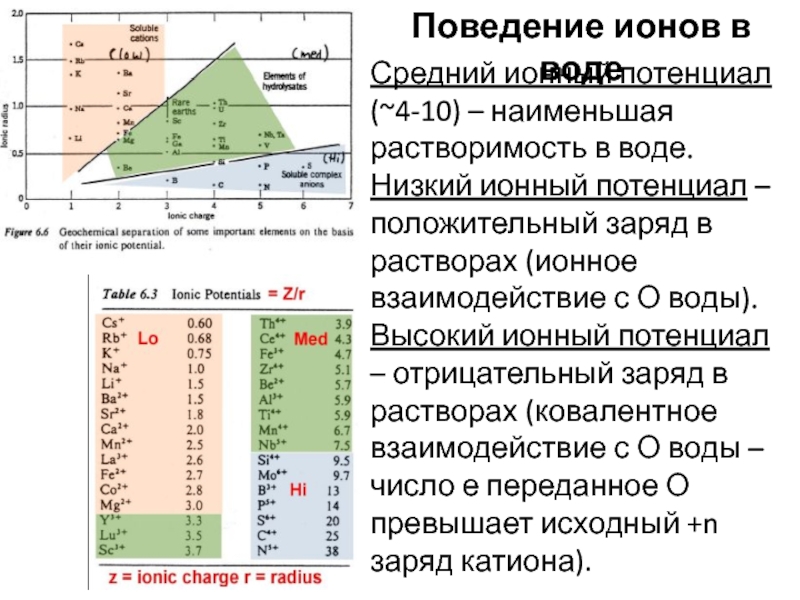
Слайд 13Поведение ионов в воде
Средний ионный потенциал (~4-10) – наименьшая растворимость
в воде.
Низкий ионный потенциал – положительный заряд в растворах (ионное
взаимодействие с О воды).
Высокий ионный потенциал – отрицательный заряд в растворах (ковалентное взаимодействие с О воды – число е переданное О превышает исходный +n заряд катиона).
Слайд 14Вода находится в постоянном движении: испарение с поверхности открытых бассейнов,
речной сток, конденсация, гидротермальная деятельность, участие в биологическом круговороте и
др.
Вместе с водой перемещается огромное количество солей, газов, минеральных и органических веществ, что сопровождается миграцией (концентрацией и рассеянием) химических элементов.
Слайд 15
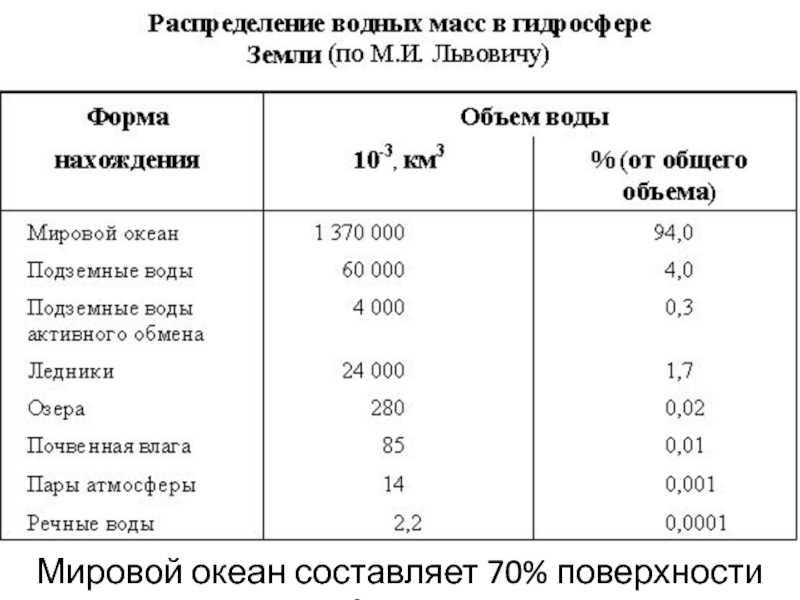
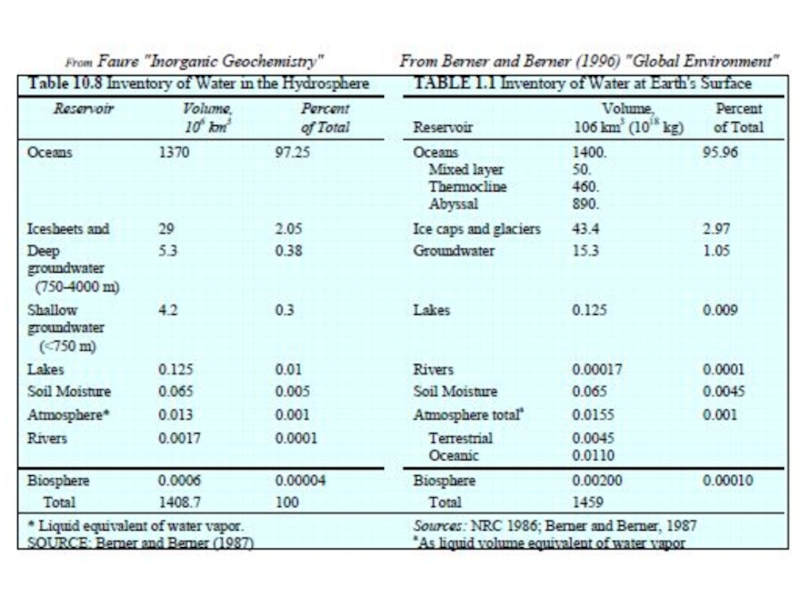
Мировой океан составляет 70% поверхности Земли
Слайд 17Средний состав гидросферы можно отождествить со средним составом океанической морской
воды, одним из самых важных свойств которой является соленость.
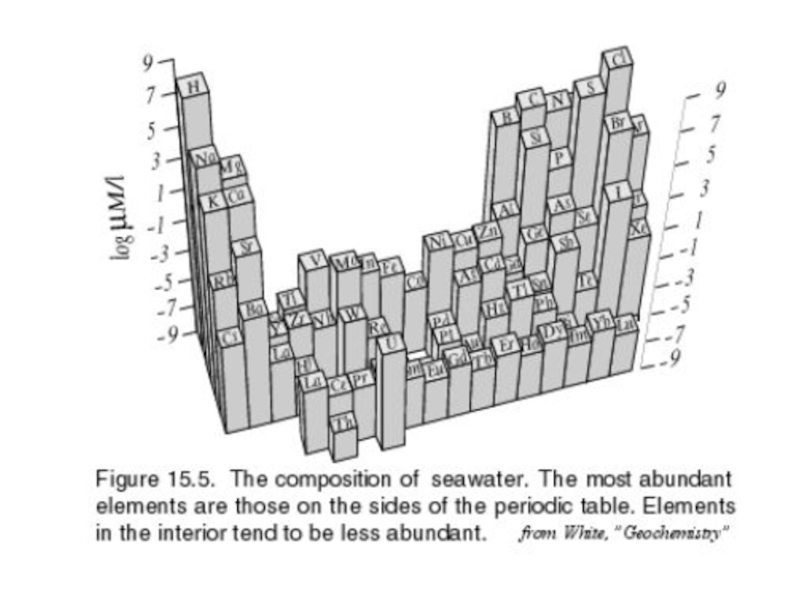
В воде
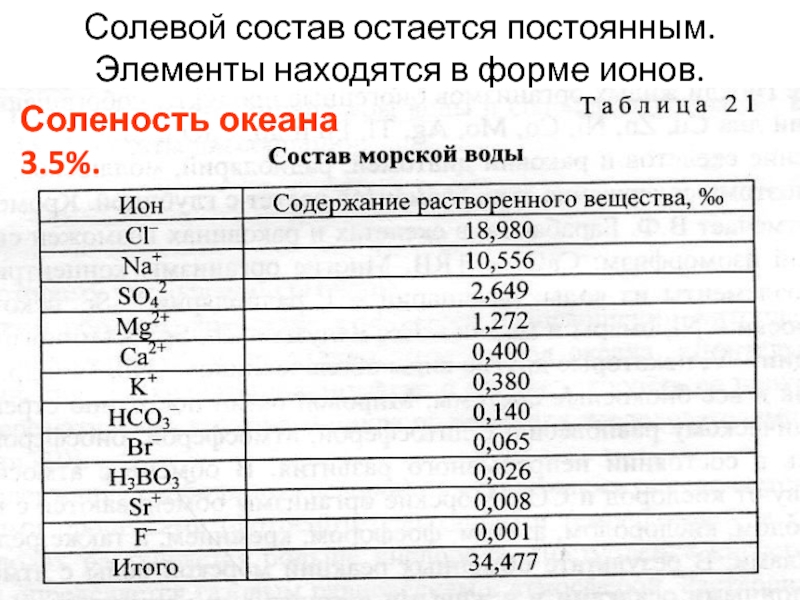
содержатся все элементы, однако основными являются O, H, Cl, Na – 99.5%.
К макроэлементам относят: Mg, Ca, S, C, K.
Количество растворенных солей и элементов определяет соленость, которую выражают в промилле (%0), процентах (%), миллиграмах на литр (мг/л) и т.п.
Слайд 18Пропорции основных компонентов в морской воде постоянны, поэтому соленость можно
определить по хлорности, средняя величина которой в морской воде 19%0.
Между
соленостью и хлорностью существует прямая зависимость:
S (соленость) = 0.03 + 1.8050 Cl (хлорность).
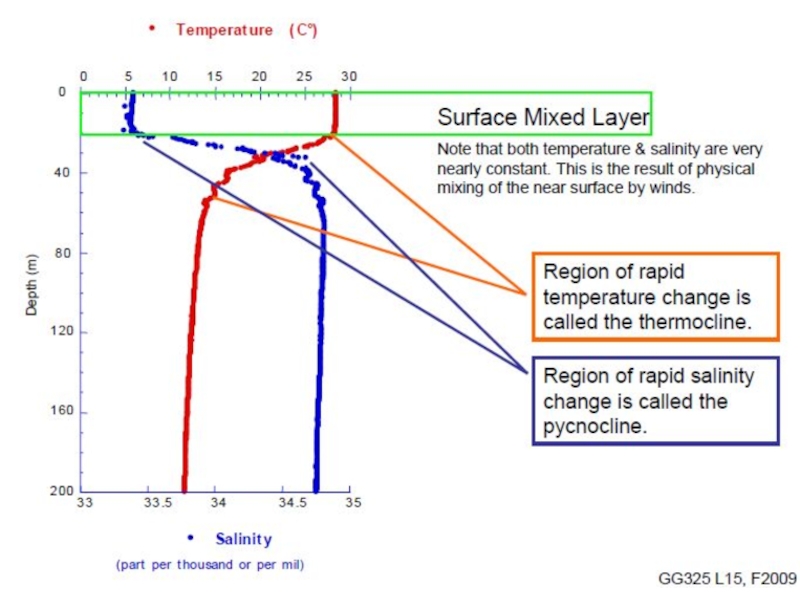
Возрастание солености приводит к увеличению плотности воды.
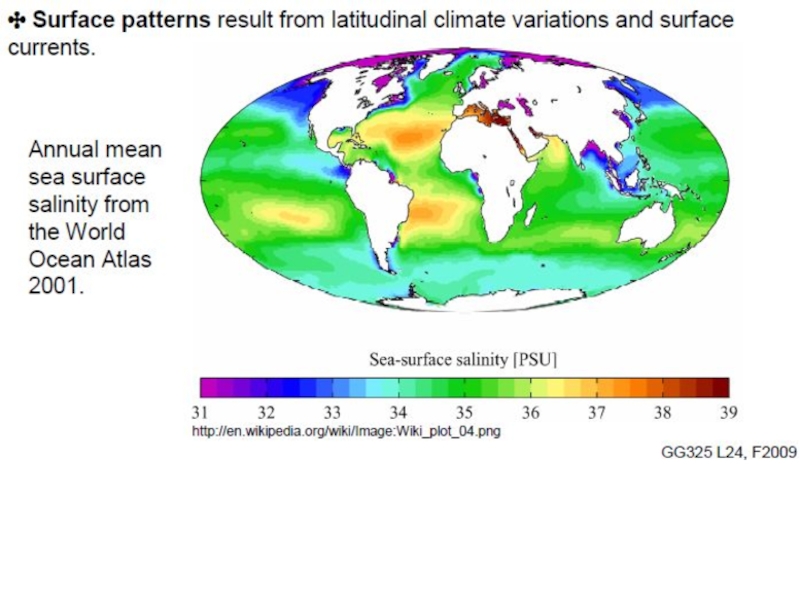
Абсолютная соленость морской воды (океана) высоко изменчива по широте, долготе, времени года. Колеблется содержание элементов и их изотопов.
Слайд 20Солевой состав остается постоянным.
Элементы находятся в форме ионов.
Соленость океана
3.5%.
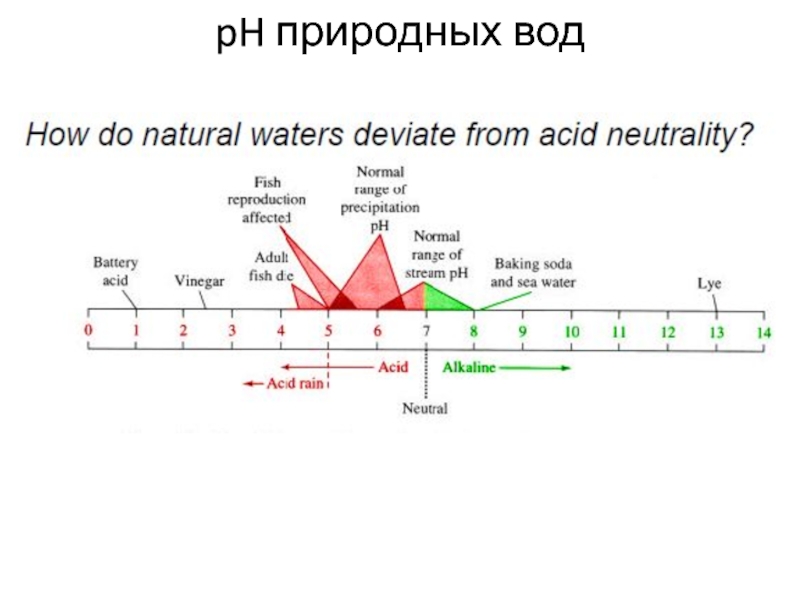
Слайд 23Океаническая вода (pH 8.2-8.5) имеет щелочной характер. Многие катионы быстро
гидролизуются и выпадают в осадок.
Многие элементы сорбируются минеральными взвесями.
Исключительно большое
влияние на формирование состава океана оказывают биогенные процессы.
Слайд 24В процессе фотосинтеза поверхностные слои воды обогащаются кислородом и обедняются
углекислотой, а живущие там организмы способны извлекать Si, Ca, Mg,
K, Br, J, P, N, V, Zn, Cu, Co, Ni.
После гибели живых организмов биогенные продукты обогащают конкреции дна Cu, Zn, Ni, Co, Mo, Ag, Tl, Pb и др.
CaO и SiO2 идут на построение скелетов и раковин моллюсков, рыб и др, поэтому их содержание растет с глубиной.
Слайд 25Многие организмы концентрируют микроэлементы из воды:
ламинарии – J
радиолярии – Sr
некоторые
моллюски – Ni
омары и мидии – Co
медузы – Zn, Sn
осьминоги
– Cu
асцидии – V
некоторые виды оболочечников – Nb, Ta.
Слайд 26В результате обменных реакций морской воды с атмосферой, донными осадками
и с живыми организмами устанавливается существующая стационарная система равновесия.
Источником CO2
в морской воде является атмосфера, однако в океане CO2 в 60 раз больше, чем в атмосфере. Океан регулирует содержание CO2 в атмосфере.
Слайд 27Содержание свободного кислорода в океане также определяется биогенными процессами (фотосинтез,
дыхание) и температурой: в холодных водах растворяется больше кислорода.
Растворимость кислорода,
как и углекислоты, также убывает к экватору и с глубиной.
Количество кислорода зависит от количества живых организмов, поглощающих растворенный кислород, и водорослей, его выделяющих.
Слайд 28Азот в океан поступает преимущественно из атмосферы в виде свободного
азота N2, а также NH3, NO2- (вредные примеси атмосферы). Часть
азота в виде соединений NaNO3 приносится реками.
Количество азота в океанической воде очень мало, что объясняется его плохой растворимостью. Значительная часть азота находится в различных биогенных соединениях (сине-зеленые водоросли, бактерии и др.).
Слайд 29Сероводород представлен малыми концентрациями в морях открытого типа, однако в
замкнутых водоемах и на больших глубинах он может играть значительную
роль. Присутствие сероводорода в придонных водах Черного моря вызывает образование в осадках сульфидов.
Инертные газы тоже присутствуют в морской воде. При прочих равных условиях, чем больше атомный вес газа, тем больше его растворимость.
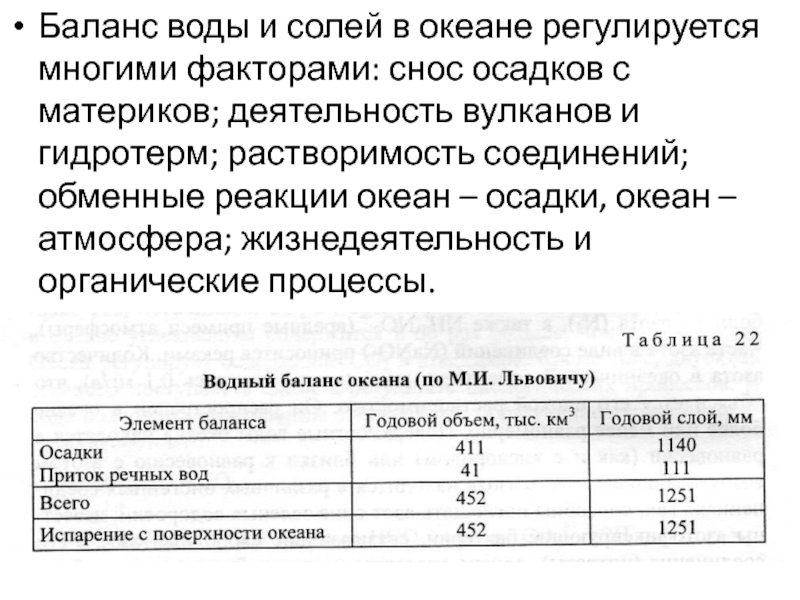
Слайд 30Баланс воды и солей в океане регулируется многими факторами: снос
осадков с материков; деятельность вулканов и гидротерм; растворимость соединений; обменные
реакции океан – осадки, океан – атмосфера; жизнедеятельность и органические процессы.
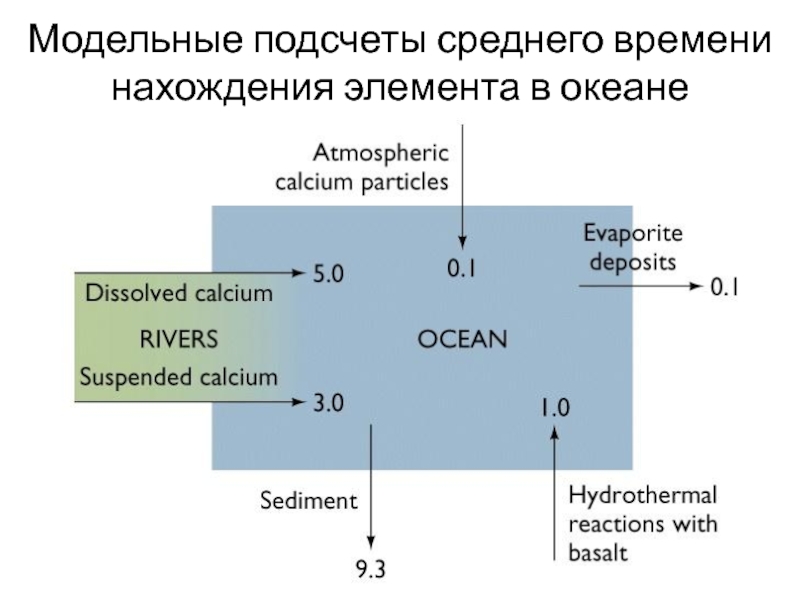
Слайд 31Модельные подсчеты среднего времени нахождения элемента в океане
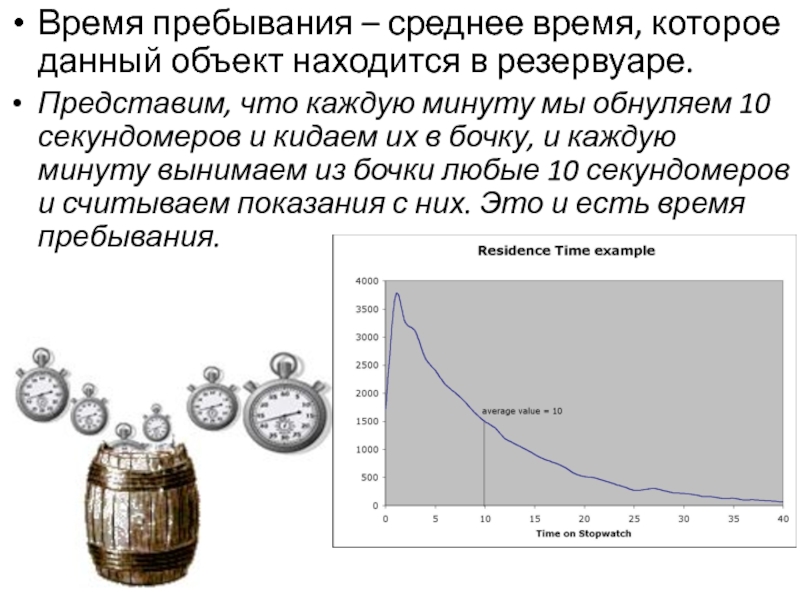
Слайд 32Время пребывания – среднее время, которое данный объект находится в
резервуаре.
Представим, что каждую минуту мы обнуляем 10 секундомеров и кидаем
их в бочку, и каждую минуту вынимаем из бочки любые 10 секундомеров и считываем показания с них. Это и есть время пребывания.
Слайд 33Если считать состав воды океана постоянным, то можно определить время
пребывания каждого элемента в океане условно как отношение: количество элемента
в воде/количество элемента, привнесенного реками в год.
Na – время близко к возрасту океана.
K, Ca, Mg – 10 000 000 лет.
Mn – короткое пребывание 1400 лет.
Pb – всего 80 лет.
Океан является саморегулирующейся системой, в которой большинство элементов достигло равновесной концентрации.
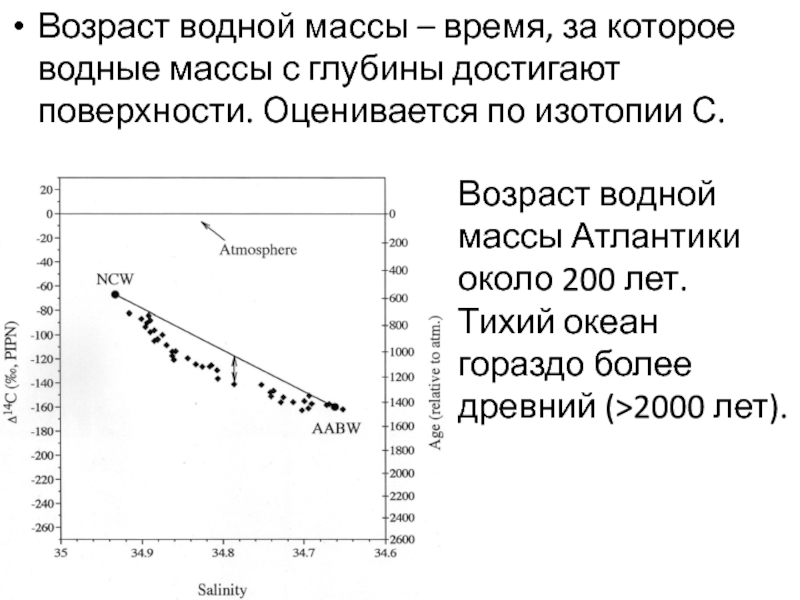
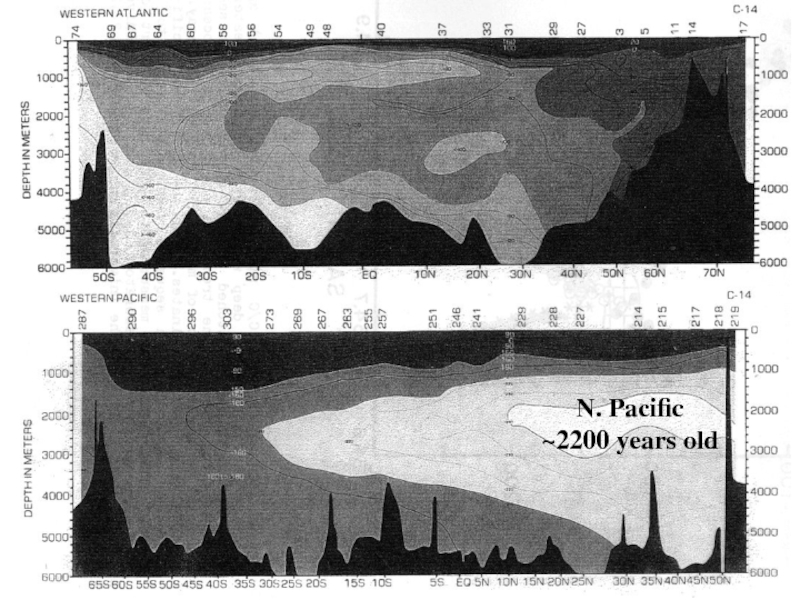
Слайд 34Возраст водной массы – время, за которое водные массы с
глубины достигают поверхности. Оценивается по изотопии С.
Возраст водной массы Атлантики
около 200 лет.
Тихий океан гораздо более древний (>2000 лет).
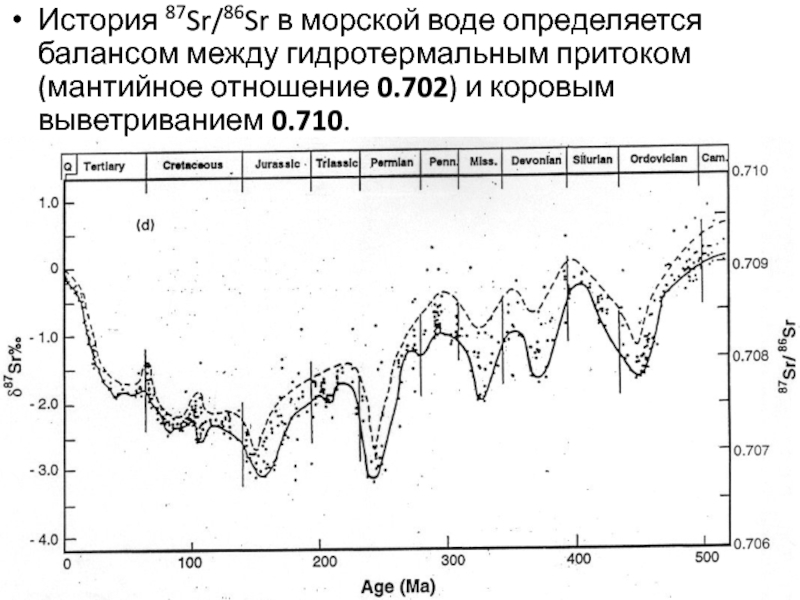
Слайд 36История 87Sr/86Sr в морской воде определяется балансом между гидротермальным притоком
(мантийное отношение 0.702) и коровым выветриванием 0.710.
Слайд 37Химия океана
Элементы могут быть разделены на три группы по их
поведению в океанической воде.
1. Консервативные элементы меняются также, как соленость
(растворяются и концентрируются). Время «жизни» до 107 лет.
2. Питающие элементы (C, N, P, Si, Fe) важны для жизни и коротко живущи на малых глубинах, где высока продуктивность. Они аккумулируются на больших глубинах, где происходит распад органического вещества.
Слайд 383. «Удаляемые» элементы (Mn, Pb и др.) – содержание больше
на поверхности. Удаляются из морской воды в результате осаждения малорастворимых
соединений, сорбции и жизнедеятельности организмов. Время пребывания в океане мало.
Слайд 40Происхождение гидросферы
Вероятно, гидросфера образовалась одновременно с литосферой и атмосферой в
результате остывания и дегазации вещества мантии. Химически связанная вода была
уже в веществе холодного газово-пылевого протопланетного облака. Под влиянием глубинного тепла Земли она выделялась и перемещалась к поверхности Земли. Первичный океан, возможно, покрывал почти всю Землю, но не был глубоким. Океаническая вода, вероятно, была теплой, высоко минерализованной. Океан углублялся, а площадь его сокращалась. С поверхности океана испарялась влага, выпадали обильные дожди.
Слайд 41Пресная вода на суше – результат прохождения океанской воды через
атмосферу. Выделение воды из магмы продолжается до настоящего времени. При
извержении вулканов выделяется в среднем за год 1.3х108т воды. Термальные источники и фумаролы выносят 108 т.
Если допустить, что поступление воды из мантии в литосферу и на ее поверхность было равномерным и составляло в год на 1 см2 поверхности планеты всего 0.00011г, то и этого достаточно, чтобы за время существования Земли образовалась гидросфера.
Предполагают также поступления воды из космоса в результате падения на Землю ледяных ядер комет, но ее количество в этом случае невелико.
Слайд 42Материковые (наземные) воды
Воды рек, озер, болот, ледниковые, подземные, а также
термальные воды вулканических областей.
С геохимических позиций (миграции химических элементов) материковые
воды можно разделить на водоносные горизонты (подземные) – область гидрогеохимии и гидрогеологии; и поверхностные воды (в т.ч. океаны) – область гидрохимии.
Почти все материковые воды – биокосные системы.
Слайд 43Три основные геохимические обстановки наземных вод: окислительная (кислородная), глеевая и
сероводородная.
На геохимических барьерах водоносных горизонтов могут формироваться месторождения полезных ископаемых:
медистые песчаники, ураноносные песчаники, серные руды и др.
Наземные воды участвуют в процессах выветривания, эрозии, т.е. влияют на изменения горных пород.
Слайд 44Основной источник вод суши – атмосферные осадки и седиментационные. Также
магматогенные и интрателлурические.
Слайд 45Химический состав материковых или подземных вод, в отличие от морской
воды, довольно разнообразен:
морская вода: Na>Mg>Ca; Cl>SO42->HCO3-
подземные воды: Ca>Na>Mg; HCO3->SO42->Cl.
Содержание в
воде O2, CO2, P и N регулируется организмами.
К главным катионам материковых вод можно отнести еще Fe, Al, K.
В реках могут накапливаться Be, Zr, Cr, Pb, Ti, Mn, Ni, Si, Co, Zn, Th, Cu и др.
Слайд 46Средняя соленость, степень минерализации (по содержанию ионов мг/л) речных вод
изменяется в пределах:
50-200 – малая минерализация;
200-500 – средняя минерализация;
>1000 –
высокая минерализация.
При дренировании преимущественно магматических и метаморфических пород соленость не превышает 50 мг/л.
При дренировании преимущественно осадочных пород соленость составляет 50-200 мг/л.
Слайд 47Соотношение
Eh и pH вод определяется степенью минерализации
Слайд 48Сильно кислые воды (pH
отработке сульфидных и некоторых угольных месторождений, а также в районах
современного вулканизма. Эти воды богаты металлами (Al, Fe3+).
Кислые воды (pH~3-6.5) – в гумидных зонах с равнинным рельефом и болотами. Содержат и сильный окислитель (свободный кислород) и сильный восстановитель (органические соединения). Такие биокосные системы устойчивы, стационарны.
Слайд 49Нейтральные, слабощелочные, пресные воды (маломинерализованные) распространены очень широко (pH~6.5-8.5). По
ионному составу это воды гидрокарбонатно-кальциевые (HCO3- - Ca2+). В таежных
и тундровых зонах Ca-воды богаты органикой и общая минерализация может достигать несколько сот мг/л. Воды бедные органикой широко распространены – пресные (≤100 мг/л), кальциевые, жесткие.
Сильнощелочные (содовые) воды (pH~>8.5) распространены в сухих степях и пустынях, главным образом в озерах.
Слайд 50В каждой биокосной системе наблюдается окислительно-восстановительная и кислотно-щелочная вертикальная гидрогеохимическая
зональность, где с глубиной окислительная зона сменяется восстановительной, а более
кислая (или менее щелочная) верхняя зона – щелочной в нижних горизонтах.
Вертикальная геохимическая зональность является планетарной закономерностью.
Степень минерализации (также pH и Eh) материковых вод резко неоднозначны и зависят от геологии, географии района и пр.