Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь
Содержание
- 1. Химическая связь
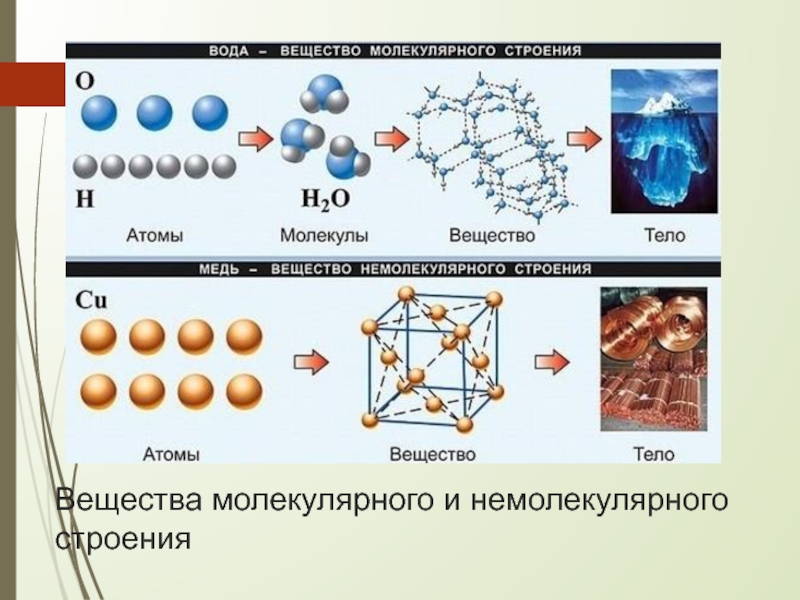
- 2. Вещества молекулярного и немолекулярного строения
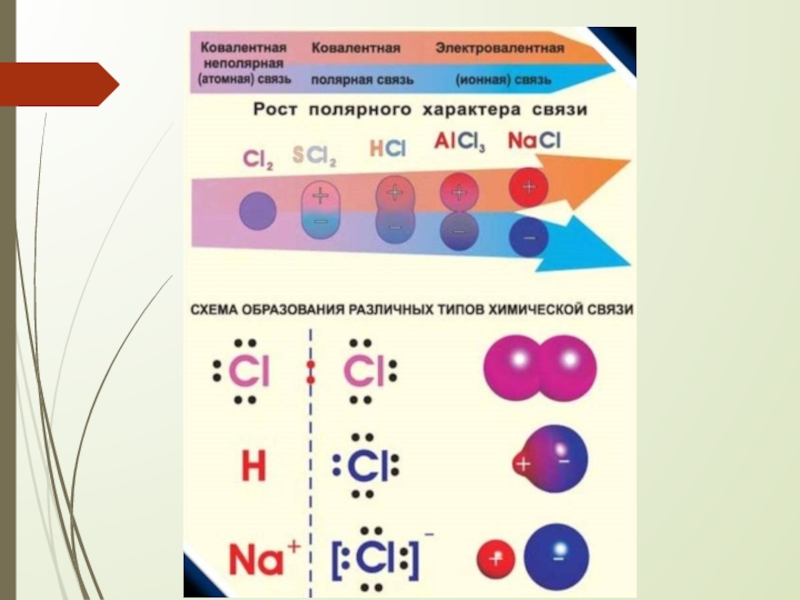
- 3. Типы химической связи
- 4. Химическая связь 1) имеет электромагнитную природу2) в результате образования связи происходит понижение энергии системы
- 5. 1. Ковалентная связьНаиболее прочный тип химической связиЕсв до 800 кДж/моль
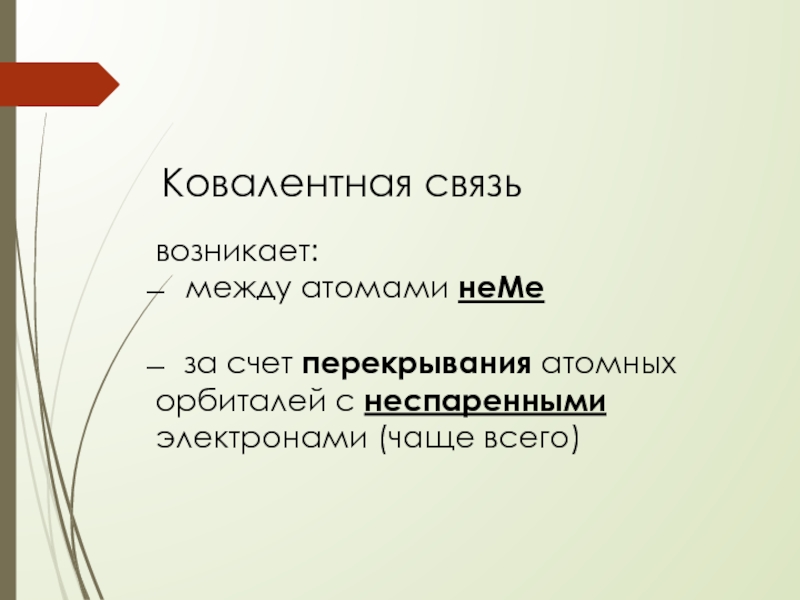
- 6. Ковалентная связь возникает: ̶
- 7. Ковалентная
- 8. Электроотрицательность (ЭО)количественно описывает неметаллические свойства атомаоценивает
- 9. Электроотрицательность (ЭО)это способность атомов, принимающих участие
- 10. 1а. Ковалентная неполярная связь
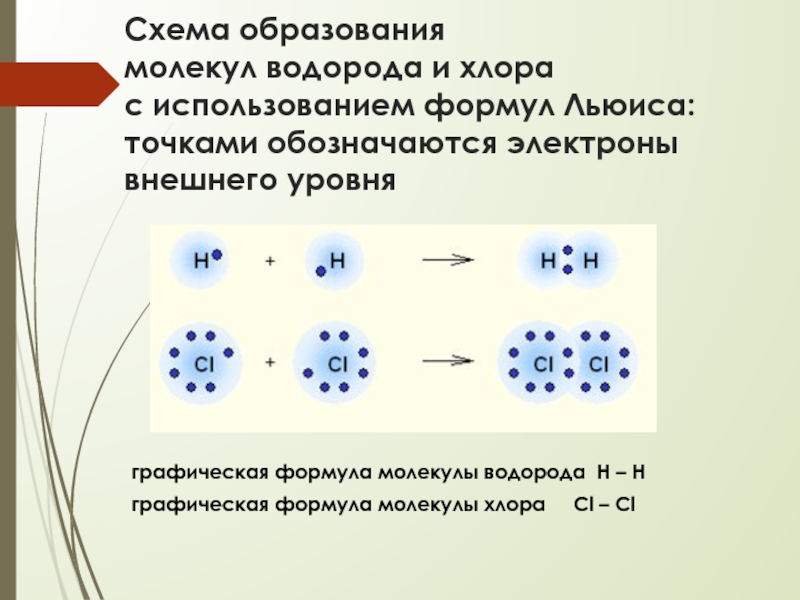
- 11. Схема образования молекул водорода и хлора
- 12. Ковалентная неполярная связьобразуется между одинаковыми атомами неМе
- 13. 1б. Ковалентная полярная связь
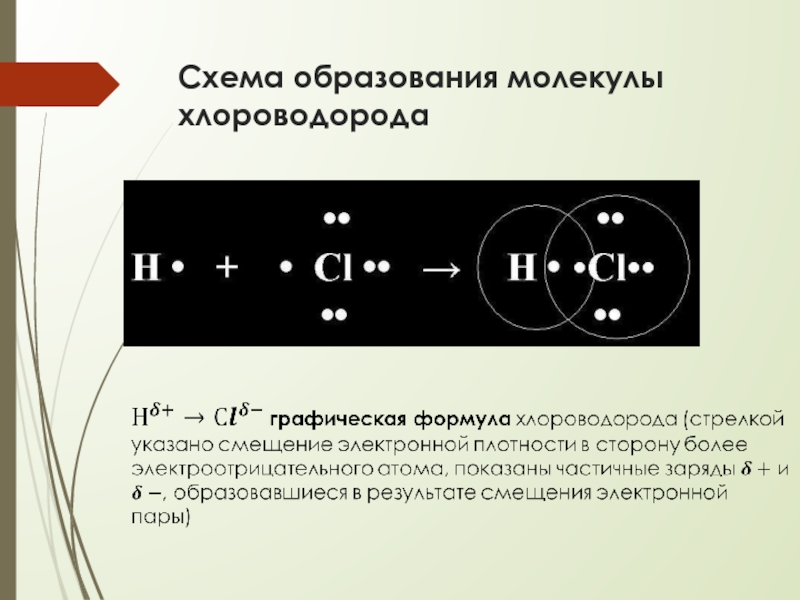
- 14. Схема образования молекулы хлороводорода
- 15. Ковалентная полярная связьобразуется между атомами неМе с
- 16. 2. Ионная связьЕсв около 600 кДж/моль
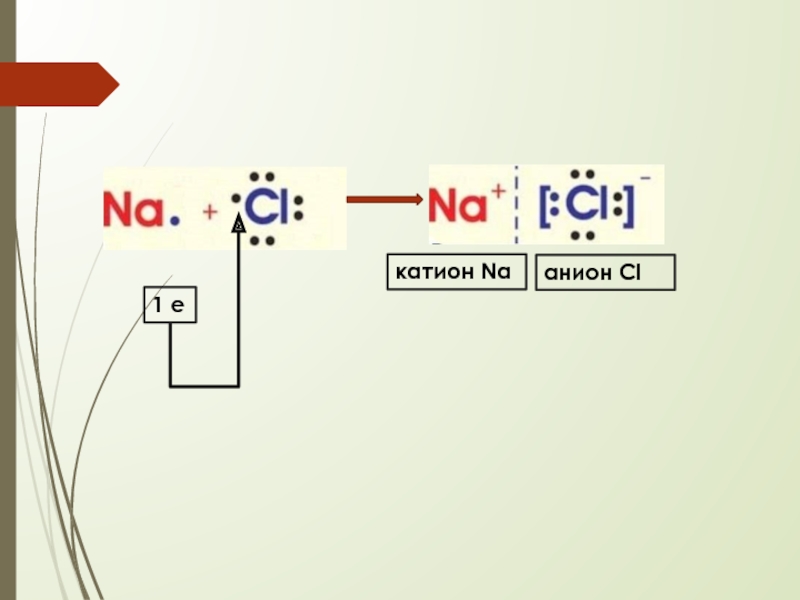
- 17. Ионная связьосуществляется за счет электростатического притяжения образовавшихся разноименных ионов (катионов и анионов)
- 18. Ионная связьпредельный случай ковалентной полярной связивозникает между
- 19. 1 екатион Naанион Cl
- 20. Слайд 20
- 21. Ответьте на вопросы:
- 22. Скачать презентанцию
Вещества молекулярного и немолекулярного строения
Слайды и текст этой презентации
Слайд 4Химическая связь
1) имеет электромагнитную природу
2) в результате образования связи
происходит понижение энергии системы
Слайд 6 Ковалентная связь
возникает:
̶ между атомами неМе
̶ за
счет перекрывания атомных орбиталей с неспаренными электронами (чаще всего)
Слайд 7 Ковалентная связь при этом образуются: ̶
общая для двух атомов электронная пара,
̶ молекулярная орбиталь.
Слайд 8Электроотрицательность
(ЭО)
количественно описывает неметаллические свойства атома
оценивает способность атома ХЭ притягивать
к себе общую электронную пару при образовании ковалентной связи
значение ЭО
можно рассчитатьСлайд 9Электроотрицательность
(ЭО)
это способность атомов, принимающих участие в образовании ковалентной связи,
притягивать к себе общую электронную пару
чем больше разница в значениях
ЭО связанных атомов, тем больше полярность ковалентной связиСлайд 11Схема образования молекул водорода и хлора с использованием формул Льюиса:
точками обозначаются электроны внешнего уровня
графическая формула молекулы водорода Н
– Нграфическая формула молекулы хлора Cl – Cl