Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Complex object? Complex subject? Coordination complexes Lyceum # 23 26 Feb
Содержание
- 1. Complex object? Complex subject? Coordination complexes Lyceum # 23 26 Feb
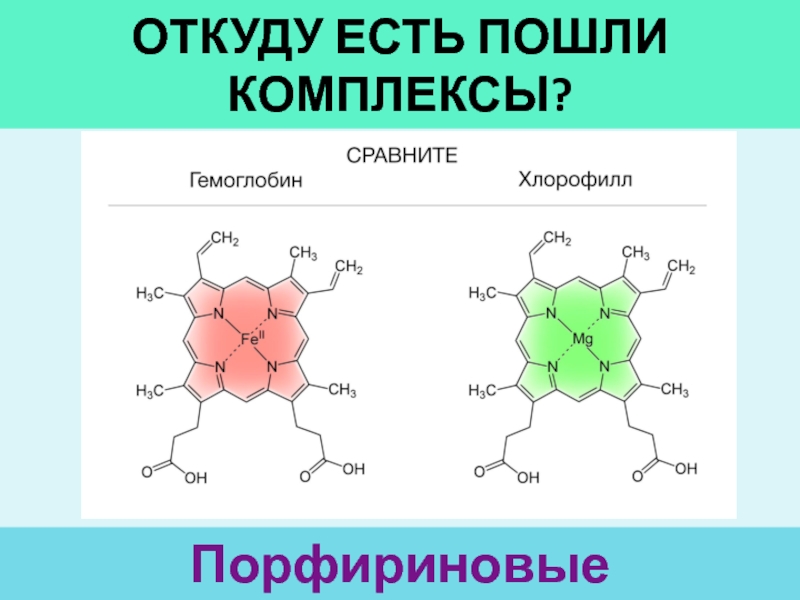
- 2. Откуду есть пошли комплексы?Порфириновые производные
- 3. Откуду есть пошли комплексы?Благородные металлы: Pt, Au, RuH[AuCl4] Na[Au(CN)2]
- 4. Строение, сферыNa2[Zn(OH)4]
- 5. Строение, сферыK4[Fe(CN)6][Ni(СО)4][Ag(NH3)2]OH центральный атом (ц.а.) лиганды КЧ внутренняя сфера = комплекс внешняя сфера
- 6. терминологияКомплексы – соединения, образованные в результате присоединенияк
- 7. терминологияЦ.а. – акцептор ē (свободные ē орбитали)Лиганды
- 8. номенклатура КСNaCl хлорид натрияNa3[Cr(OH)6]гексагидроксохромит/-ат натрия
- 9. номенклатура КСK4[Fe(CN)6] ЖКСгексацианоферрат(III) калия[Ag(NH3)2]OH р-в Толленсагидроксид диамминсеребра(I)Анион, катионКЧ, анионные
- 10. Изомерия в неорге? wtf[CrCl3(H2O)3]∙3H2O Тригидраттрихлоротриаквахром[CrCl2(H2O)4]Сl∙2H2OДигидрат хлорида дихлоротетрааквахрома (III)
- 11. Изомерия в неорге? wtf[CrCl(H2O)5]Cl2∙H2OМоногидрат хлорида хлоропентааквахрома (III)[Cr(H2O)6]Сl3Хлорид гексааквахрома(III)Все 4 в-ва описываются CrCl3∙6H2O [Cr(H2O)6]Сl3 зеленыйvs.[CrCl2(H2O)4]Сl∙2H2O сине-фиол.
- 12. Ладно, полегче: номенклатураNa2[Be(OH)4]Тетрагидроксобериллат натрияNa2[Zn(OH)4]тетрагидроксоцинкат натрияNa2[Pb(OH)4] attentionтетрагидроксоплюмбат натрия
- 13. Бок о бок: Fe, Al, Cr? Ну, почти…Na[Al(OH)4]тетрагидроксоалюминат натрияNa3[Cr(OH)6] ¡six!гексагидроксобериллат натрияNa3[Fe(OH)6]Забудьте, нет его!
- 14. Все же Бок о бок: Fe, Al,
- 15. Бок о бок: Fe, Al, Cr? Ну,
- 16. Бок о бок: Fe, Al, Cr? Ну,
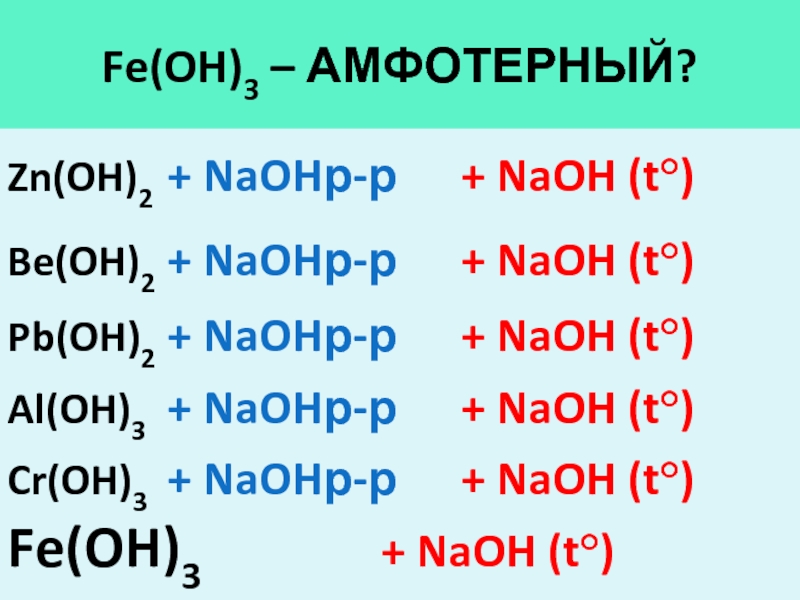
- 17. Fe(OH)3 – Амфотерный?Zn(OH)2 + NaOHр-р + NaOH (t°)Be(OH)2 +
- 18. Путешествие туда и обратноAl3+ Al(OH)3 [Al(OH)4]- Al(OH)3Al3+
- 19. PracticeAl2(SO4)3 Al(OH)3Na[Al(OH)4] Al(OH)3AlCl3
- 20. Не пренебрегай кэфамиAlCl3 + 3NaOH = Al(OH)3
- 21. Practice ZincZnCl2 + 2NaOH = Zn(OH)2 + 2NaClZn(OH)2
- 22. Разрушение комплексовЧастичноеNa2[Zn(OH)4] + 2HCl(нед.) = Zn(OH)2 +
- 23. Ладно, ладно, полегче[Ag(NH3)2]OHгидроксид диамминсеребра(I)[Cu(NH3)4](OH)2 (р-в Швейцера)гидроксид тетраамминмеди(II)Лиганд NH3 – аммин (не амин)
- 24. Гидроксид Ag или оксид Ag?Большинство осаждений щелочью:Mg(NO3)2
- 25. Реактив ТолленсаПишем аммониевую соль, а не к-туСеребряное зеркало2[Ag(NH3)2]OH + RCHO=2Аg + RCOONH4 + 3NH3 + H2O
- 26. Реактив ТолленсаСлабокислотные св-ва алкиновТерминальные алкины[Ag(NH3)2]OH + RC≡CH=RC≡CAg + 2NH3 + H2O
- 27. Реактив ТолленсаВзрывчатыеТерминальные алкиныOnly ONE: дважды терминальный
- 28. Реактив ШвейцераНу цвет-то какой!!!Свежеосажденный или иначе сложнее
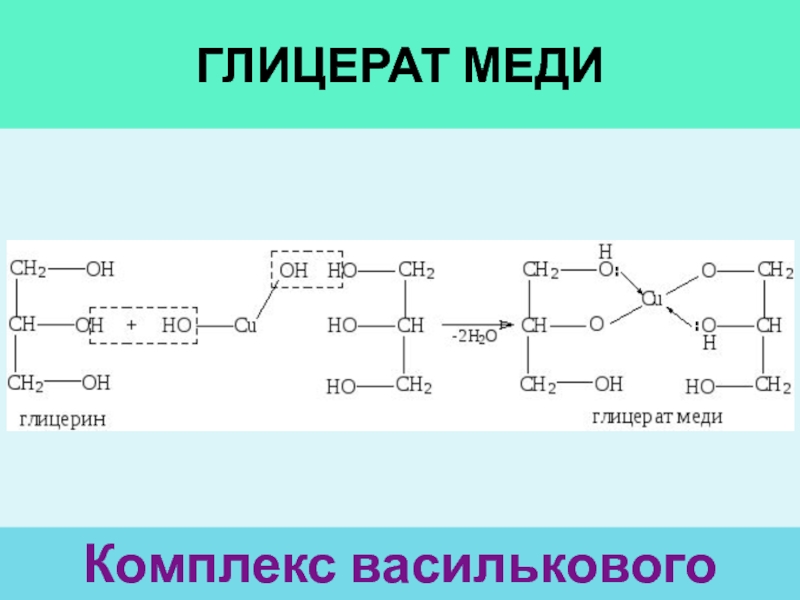
- 29. Глицерат медиКомплекс василькового цвета
- 30. Сu(OH)2 + орга И многоатомные, и альдегиды
- 31. Freddy HgHgCl2 + 2KI = HgI2↓ + 2KClHgI2 + 2KI = K2[HgI4]Реактив Несслера
- 32. Thank you@OhZadorin
- 33. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Complex object?
Complex subject?
Coordination
complexes
Lyceum #23 26 Feb 2019
Задорин
Александр Александрович
Слайд 5Строение, сферы
K4[Fe(CN)6]
[Ni(СО)4]
[Ag(NH3)2]OH
центральный атом (ц.а.) лиганды КЧ
внутренняя сфера = комплекс
внешняя сфера
Слайд 6терминология
Комплексы – соединения, образованные в результате присоединения
к данному иону/атому (ц.а.)
молекул или ионов (лигандов)
Слайд 7терминология
Ц.а. – акцептор ē (свободные ē орбитали)
Лиганды – донор ē
(молекула или ион), связанный с ц.а.
КЧ (координационное число) – количество
связей между ц.а. и лигандомВнутренняя сфера – ц.а. + лиганды
Внешняя сфера – противоионы
Связь ков., мех-м – донорно-акцепторный
по типу H+ + NH3 (пара ē на N)
Слайд 9номенклатура КС
K4[Fe(CN)6] ЖКС
гексацианоферрат(III) калия
[Ag(NH3)2]OH р-в Толленса
гидроксид диамминсеребра(I)
Анион, катион
КЧ, анионные лиганды,
нейтральные лиганды, ц.а.
(ст.ок.)
K4[Fe(CN)6] + FeCl3 = KFe[Fe(CN)6] + 3KCl
ЖКС берлинская
лазурьK3[Fe(CN)6] + FeSO4 = KFe[Fe(CN)6] + K2SO4
ККС турнбуллева синь
Доказано: структура одинакова
Слайд 10Изомерия в неорге? wtf
[CrCl3(H2O)3]∙3H2O
Тригидрат
трихлоротриаквахром
[CrCl2(H2O)4]Сl∙2H2O
Дигидрат хлорида дихлоротетрааквахрома (III)
Слайд 11Изомерия в неорге? wtf
[CrCl(H2O)5]Cl2∙H2O
Моногидрат хлорида хлоропентааквахрома (III)
[Cr(H2O)6]Сl3
Хлорид гексааквахрома(III)
Все 4 в-ва
описываются CrCl3∙6H2O
[Cr(H2O)6]Сl3 зеленый
vs.
[CrCl2(H2O)4]Сl∙2H2O сине-фиол.
Слайд 12Ладно, полегче: номенклатура
Na2[Be(OH)4]
Тетрагидроксобериллат натрия
Na2[Zn(OH)4]
тетрагидроксоцинкат натрия
Na2[Pb(OH)4] attention
тетрагидроксоплюмбат натрия
Слайд 13Бок о бок: Fe, Al, Cr? Ну, почти…
Na[Al(OH)4]
тетрагидроксоалюминат натрия
Na3[Cr(OH)6] ¡six!
гексагидроксобериллат натрия
Na3[Fe(OH)6]
Забудьте,
нет его!
Слайд 14Все же Бок о бок: Fe, Al, Cr
__ + H2SO4(р.)
= FeSO4 + H2
__ + H2SO4(к.) = не идет; пассивация
2__
+ 6H2SO4(к.) = Fe2(SO4)3 + 3SO2 + 6H2O (t°)__ + 4HNO3(р.) = Fe(NO3)3 + NO + 2H2O
__ + HNO3(к.) = не идет; пассивация
__ + 6HNO3(к.) = Fe(NO3)3 + 3NO2 + 3H2O (t°)
__ обозначает Ме из этой тройки
При ком. t° из-за оксидной пленки.
Пассивация снимается при t°.
Слайд 15Бок о бок: Fe, Al, Cr? Ну, почти…
Полный гидролиз: здесь
Al = Fe = Cr
и [синие скобки] – не комплекс
[Al2(CO3)3]
+ 3H2O = 2Al(OH)3 + 3CO22AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 6NaCl + 3CO2
[Al2(SO3)3] + 3H2O = 2Al(OH)3 + 3SO2
2AlCl3 + 3Na2SO3 + 3H2O = 2Al(OH)3 + 6NaCl + 3SO2
Слайд 16Бок о бок: Fe, Al, Cr? Ну, почти…
Полный гидролиз сульфидов:
здесь Al = Cr
Fe(III) восстанавливается и Na2S, и KI
Al2S3 +
6H2O = 2Al(OH)3 + 3H2SСульфиды можно получить, не только [in situ]
[Al2S3] + 6H2O = 2Al(OH)3 + 3H2S
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 6NaCl + 3CO2
Увы… Еще одна особенность
[Fe2S3] в воде = 2FeS + S (два осадка: легкий и тяж.)
[2FeI3] в воде = 2FeI2 + I2
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + 6KI = 2FeI2 + I2 + 6KCl
Слайд 17Fe(OH)3 – Амфотерный?
Zn(OH)2 + NaOHр-р + NaOH (t°)
Be(OH)2 + NaOHр-р + NaOH
(t°)
Pb(OH)2 + NaOHр-р + NaOH (t°)
Al(OH)3 + NaOHр-р + NaOH (t°)
Cr(OH)3 + NaOHр-р
+ NaOH (t°)Fe(OH)3 + NaOH (t°)
Слайд 20Не пренебрегай кэфами
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
Al(OH)3 +
NaOH = Na[Al(OH)4]
Na[Al(OH)4] + HCl = Al(OH)3 + NaCl
Al(OH)3 +
3HCl = AlCl3 + 3H2OСлайд 21Practice Zinc
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Zn(OH)2 + 2NaOH =
Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2HCl = Zn(OH)2 + 2NaCl
Zn(OH)2 + 2HCl =
ZnCl2 + 2H2OСлайд 22Разрушение комплексов
Частичное
Na2[Zn(OH)4] + 2HCl(нед.) = Zn(OH)2 + 2NaCl
Na2[Zn(OH)4] + СO2
= Zn(OH)2 + Na2CO3 + H2O
Na2[Zn(OH)4] + H2S = Zn(OH)2
+ Na2S + 2H2OПолное
Na2[Zn(OH)4] + 4HСl(изб.) = ZnСl2 + 2NaCl + 4H2O
Слайд 23Ладно, ладно, полегче
[Ag(NH3)2]OH
гидроксид диамминсеребра(I)
[Cu(NH3)4](OH)2 (р-в Швейцера)
гидроксид тетраамминмеди(II)
Лиганд NH3 – аммин (не
амин)
Слайд 24Гидроксид Ag или оксид Ag?
Большинство осаждений щелочью:
Mg(NO3)2 + 2NaOH =
Mg(OH)2 + 2NaNO3
Но: 2AgNO3 + 2NaOH = Ag2O + 2NaNO3
+ H2Oи это оксид
Реактив Толленса
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
Поэтому аммиачный р-р оксида серебра
Ag2O – коричневый осадок
Слайд 25Реактив Толленса
Пишем аммониевую соль, а не к-ту
Серебряное зеркало
2[Ag(NH3)2]OH + RCHO
=
2Аg
+ RCOONH4 + 3NH3 + H2O
Слайд 26Реактив Толленса
Слабокислотные св-ва алкинов
Терминальные алкины
[Ag(NH3)2]OH + RC≡CH
=
RC≡CAg + 2NH3 +
Слайд 28Реактив Швейцера
Ну цвет-то какой!!!
Свежеосажденный или иначе сложнее р-рять:
CuSO4 + 2NaOH
= Cu(OH)2 + Na2SO4
Реактив Швейцера
Cu(OH)2 + 4NH3 = [Сu(NH3)4](OH)2
аммиачный р-р
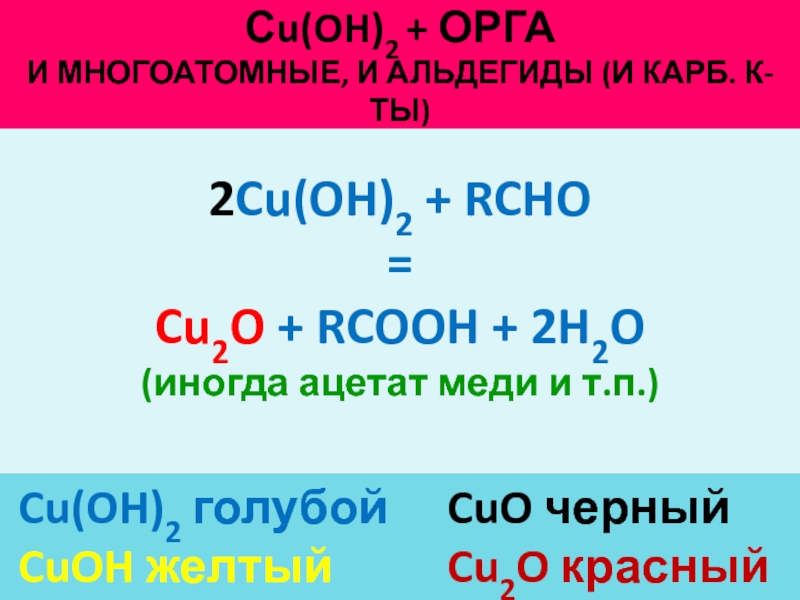
гидроксида медиСлайд 30Сu(OH)2 + орга
И многоатомные, и альдегиды (и карб. К-ты)
Cu(OH)2
голубой CuO черный
CuOH желтый Cu2O красный
2Cu(OH)2 + RCHO
=
Cu2O + RCOOH +
2H2O(иногда ацетат меди и т.п.)

![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Откуду есть пошли комплексы?Благородные металлы: Pt, Au, RuH[AuCl4] Na[Au(CN)2] Откуду есть пошли комплексы?Благородные металлы: Pt, Au, RuH[AuCl4] Na[Au(CN)2]](/img/thumbs/24bcde8274e4e791d06756670eda6c52-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Строение, сферыNa2[Zn(OH)4] Строение, сферыNa2[Zn(OH)4]](/img/thumbs/0d69aff180460225059f35e5a7fdae01-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Строение, сферыK4[Fe(CN)6][Ni(СО)4][Ag(NH3)2]OH центральный атом (ц.а.) лиганды КЧ внутренняя сфера = комплекс внешняя сфера Строение, сферыK4[Fe(CN)6][Ni(СО)4][Ag(NH3)2]OH центральный атом (ц.а.) лиганды КЧ внутренняя сфера = комплекс внешняя сфера](/img/thumbs/39fa0b0f582c099a81d45dd42b46f5e9-800x.jpg)


![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb номенклатура КСNaCl хлорид натрияNa3[Cr(OH)6]гексагидроксохромит/-ат натрия номенклатура КСNaCl хлорид натрияNa3[Cr(OH)6]гексагидроксохромит/-ат натрия](/img/tmb/4/314870/8e219f210e2f02b385c47b9b0cd30300-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb номенклатура КСK4[Fe(CN)6] ЖКСгексацианоферрат(III) калия[Ag(NH3)2]OH р-в Толленсагидроксид диамминсеребра(I)Анион, катионКЧ, анионные лиганды,нейтральные лиганды, ц.а. (ст.ок.)K4[Fe(CN)6] номенклатура КСK4[Fe(CN)6] ЖКСгексацианоферрат(III) калия[Ag(NH3)2]OH р-в Толленсагидроксид диамминсеребра(I)Анион, катионКЧ, анионные лиганды,нейтральные лиганды, ц.а. (ст.ок.)K4[Fe(CN)6] + FeCl3 = KFe[Fe(CN)6] + 3KCl ЖКС](/img/thumbs/8b214ffa0c84fe9b467a44a1f405ae6b-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Изомерия в неорге? wtf[CrCl3(H2O)3]∙3H2O Тригидраттрихлоротриаквахром[CrCl2(H2O)4]Сl∙2H2OДигидрат хлорида дихлоротетрааквахрома (III) Изомерия в неорге? wtf[CrCl3(H2O)3]∙3H2O Тригидраттрихлоротриаквахром[CrCl2(H2O)4]Сl∙2H2OДигидрат хлорида дихлоротетрааквахрома (III)](/img/thumbs/bb735c8232b356379e60e055ee7b6ee0-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Изомерия в неорге? wtf[CrCl(H2O)5]Cl2∙H2OМоногидрат хлорида хлоропентааквахрома (III)[Cr(H2O)6]Сl3Хлорид гексааквахрома(III)Все 4 в-ва описываются CrCl3∙6H2O [Cr(H2O)6]Сl3 зеленыйvs.[CrCl2(H2O)4]Сl∙2H2O сине-фиол. Изомерия в неорге? wtf[CrCl(H2O)5]Cl2∙H2OМоногидрат хлорида хлоропентааквахрома (III)[Cr(H2O)6]Сl3Хлорид гексааквахрома(III)Все 4 в-ва описываются CrCl3∙6H2O [Cr(H2O)6]Сl3 зеленыйvs.[CrCl2(H2O)4]Сl∙2H2O сине-фиол.](/img/thumbs/4e3205f1496e83293c518e1bde4eafd4-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Ладно, полегче: номенклатураNa2[Be(OH)4]Тетрагидроксобериллат натрияNa2[Zn(OH)4]тетрагидроксоцинкат натрияNa2[Pb(OH)4] attentionтетрагидроксоплюмбат натрия Ладно, полегче: номенклатураNa2[Be(OH)4]Тетрагидроксобериллат натрияNa2[Zn(OH)4]тетрагидроксоцинкат натрияNa2[Pb(OH)4] attentionтетрагидроксоплюмбат натрия](/img/thumbs/e252371f99fe140ae693013c0ffd6603-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Бок о бок: Fe, Al, Cr? Ну, почти…Na[Al(OH)4]тетрагидроксоалюминат натрияNa3[Cr(OH)6] ¡six!гексагидроксобериллат натрияNa3[Fe(OH)6]Забудьте, нет его! Бок о бок: Fe, Al, Cr? Ну, почти…Na[Al(OH)4]тетрагидроксоалюминат натрияNa3[Cr(OH)6] ¡six!гексагидроксобериллат натрияNa3[Fe(OH)6]Забудьте, нет его!](/img/thumbs/2f32a5441301cdb72757b384f2dbdab3-800x.jpg)

![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Бок о бок: Fe, Al, Cr? Ну, почти…Полный гидролиз: здесь Al Бок о бок: Fe, Al, Cr? Ну, почти…Полный гидролиз: здесь Al = Fe = Crи [синие скобки]](/img/thumbs/bc9cfa269cb438ee9cf5347c4efb894d-800x.jpg)

![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Путешествие туда и обратноAl3+ Al(OH)3 [Al(OH)4]- Al(OH)3Al3+ Путешествие туда и обратноAl3+ Al(OH)3 [Al(OH)4]- Al(OH)3Al3+](/img/thumbs/70756ea9a98dca3dc6232e38e8852ff2-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb PracticeAl2(SO4)3 Al(OH)3Na[Al(OH)4] Al(OH)3AlCl3 PracticeAl2(SO4)3 Al(OH)3Na[Al(OH)4] Al(OH)3AlCl3](/img/thumbs/1247796753dbcc783e765977be51ad1a-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Не пренебрегай кэфамиAlCl3 + 3NaOH = Al(OH)3 + 3NaClAl(OH)3 + NaOH Не пренебрегай кэфамиAlCl3 + 3NaOH = Al(OH)3 + 3NaClAl(OH)3 + NaOH = Na[Al(OH)4]Na[Al(OH)4] + HCl = Al(OH)3](/img/thumbs/918d67a405422d7b008c1742f7fed58c-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Practice ZincZnCl2 + 2NaOH = Zn(OH)2 + 2NaClZn(OH)2 + 2NaOH = Na2[Zn(OH)4]Na2[Zn(OH)4] Practice ZincZnCl2 + 2NaOH = Zn(OH)2 + 2NaClZn(OH)2 + 2NaOH = Na2[Zn(OH)4]Na2[Zn(OH)4] + 2HCl = Zn(OH)2 + 2NaClZn(OH)2](/img/thumbs/cb6bab3354f12f7a699cc4d4f5660786-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Разрушение комплексовЧастичноеNa2[Zn(OH)4] + 2HCl(нед.) = Zn(OH)2 + 2NaClNa2[Zn(OH)4] + СO2 = Разрушение комплексовЧастичноеNa2[Zn(OH)4] + 2HCl(нед.) = Zn(OH)2 + 2NaClNa2[Zn(OH)4] + СO2 = Zn(OH)2 + Na2CO3 + H2ONa2[Zn(OH)4] +](/img/thumbs/cf0e9d1ba1d9a96c9ba156fa476a8221-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Ладно, ладно, полегче[Ag(NH3)2]OHгидроксид диамминсеребра(I)[Cu(NH3)4](OH)2 (р-в Швейцера)гидроксид тетраамминмеди(II)Лиганд NH3 – аммин (не амин) Ладно, ладно, полегче[Ag(NH3)2]OHгидроксид диамминсеребра(I)[Cu(NH3)4](OH)2 (р-в Швейцера)гидроксид тетраамминмеди(II)Лиганд NH3 – аммин (не амин)](/img/thumbs/071d4834a12ba22ddb0cb4ec56880839-800x.jpg)

![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Реактив ТолленсаПишем аммониевую соль, а не к-туСеребряное зеркало2[Ag(NH3)2]OH + RCHO=2Аg + RCOONH4 + 3NH3 + H2O Реактив ТолленсаПишем аммониевую соль, а не к-туСеребряное зеркало2[Ag(NH3)2]OH + RCHO=2Аg + RCOONH4 + 3NH3 + H2O](/img/thumbs/31e09a2c1b26d26016c8dbef1292c8dc-800x.jpg)
![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Реактив ТолленсаСлабокислотные св-ва алкиновТерминальные алкины[Ag(NH3)2]OH + RC≡CH=RC≡CAg + 2NH3 + H2O Реактив ТолленсаСлабокислотные св-ва алкиновТерминальные алкины[Ag(NH3)2]OH + RC≡CH=RC≡CAg + 2NH3 + H2O](/img/thumbs/6326b25115b80d6b2566055fc98d1be7-800x.jpg)


![Complex object?
Complex subject?
Coordination
complexes
Lyceum # 23 26 Feb Freddy HgHgCl2 + 2KI = HgI2↓ + 2KClHgI2 + 2KI = K2[HgI4]Реактив Несслера Freddy HgHgCl2 + 2KI = HgI2↓ + 2KClHgI2 + 2KI = K2[HgI4]Реактив Несслера](/img/thumbs/08fc03748b2b5efeb601b0e32ec3ec7a-800x.jpg)