Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ХИМИЯ
Содержание
- 1. ХИМИЯ
- 2. Глинка Н.Л. Общая химия. – М., КНОРУС,
- 3. Тема: Строение атома и Периодический закон
- 4. 1. Современные квантово-механические представления о строении атомаУчение
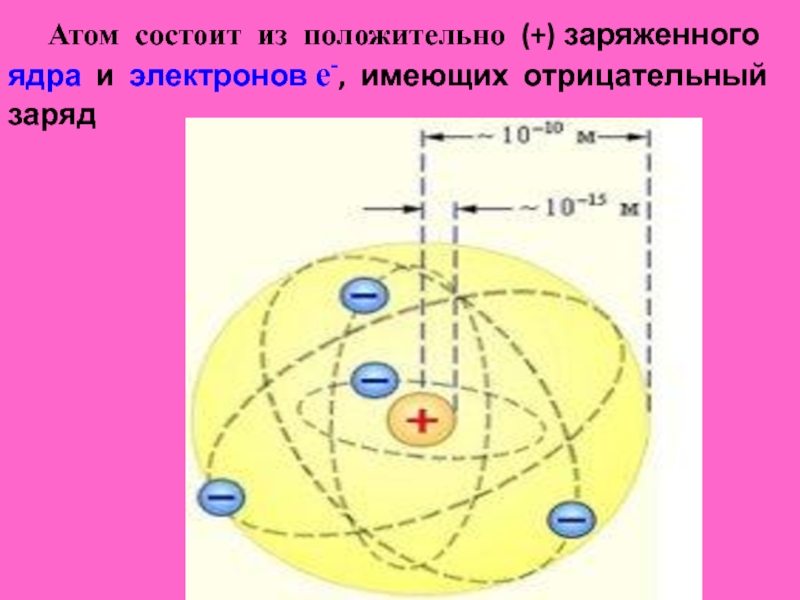
- 5. Атом состоит из положительно (+) заряженного ядра и электронов е-, имеющих отрицательный заряд
- 6. Вся масса атома сосредоточена в ядре, образован-ного
- 7. Слайд 7
- 8. Данная модель не укладывалась в рамки класси-ческой
- 9. Слайд 9
- 10. В химических превращениях масса и заряд
- 11. Пространство вокруг ядра, в котором может нахо-диться
- 12. В реально существующих атомах электронами могут
- 13. Слайд 13
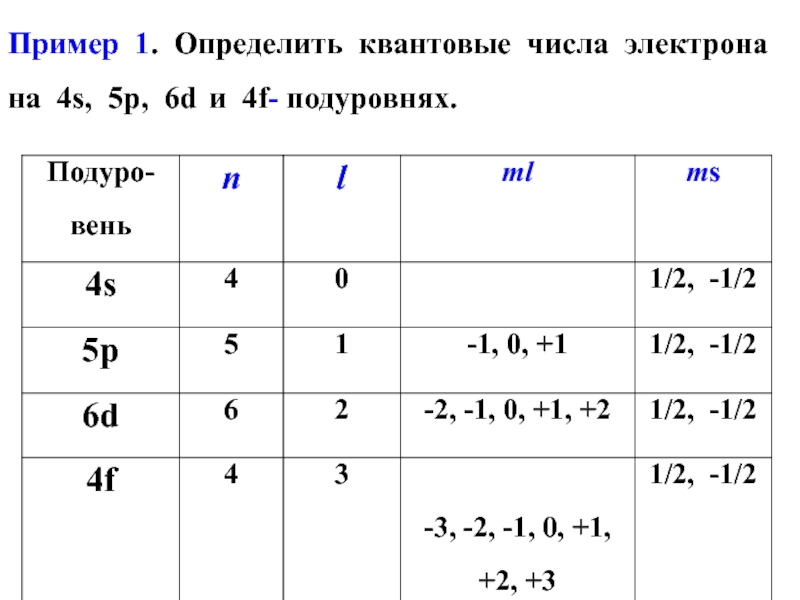
- 14. 3. Магнитное квантовое число ml. Подуровни также
- 15. 3 первых квантовых числа характеризуют
- 16. 2. Правила квантовой механики Состояние е- в атоме
- 17. На одной АО по принципу Паули
- 18. 2) Правило Гунда. Заполнение электронами АО
- 19. Пример 1. Определить квантовые числа электрона на 4s, 5р, 6d и 4f- подуровнях.
- 20. Электронную структуру атома принято записывать двумя квантовыми
- 21. 3) Правила Клечковского (принцип наименьшей энергии атома)
- 22. (n – 1)d4 ns2 → (n –
- 23. Слайд 23
- 24. Номер периода совпадает со значением главного квантового
- 25. Количество элементов в периоде: χчетн = (N
- 26. Из электронной формулы атома легко определить валентные
- 27. Металлы - это элементы, способные отдавать
- 28. Потенциал ионизации I - наименьшее
- 29. Характеристики свойств элементовХарактеристика Период
- 30. Изменение кислотно-основных свойств гидроксидов:(3-ий период): NaOH (щел)
- 31. As - s2р3, Se - s2р4, Br
- 32. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Глинка Н.Л. Общая химия. – М., КНОРУС, 2009.
Коровин Н.В.
Общая химия. – М., ВШ, 2006.
упражнения по общей химии. – М. Интеграл-пресс, 2007Слайд 3
Тема: Строение атома и Периодический закон
Д.И. Менделеева
1. Современные квантово-механические
представления о строении атома.
2. Правила квантовой механики.
3. Периодический закон
Д.И. Менделеева. Структура периодической системы химических элементов. Слайд 41. Современные квантово-механические представления о строении атома
Учение о строении вещества
является основным в системе знаний современной химии. С его позиций
рассматривают физико-химические свойства ве-ществ, химических элементов, процессы химичес-ких превращений.Современные представления о строении атома ба-зируются на квантово-механической модели. Ядерная модель атома была создана Э. Резер-фордом в 1911 г.
Слайд 5 Атом состоит из положительно (+) заряженного ядра и электронов е-,
имеющих отрицательный заряд
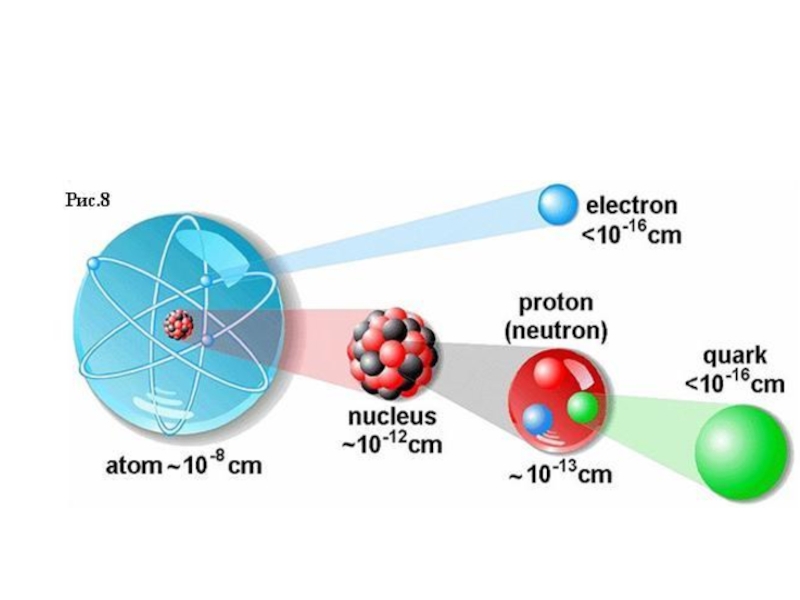
Слайд 6Вся масса атома сосредоточена в ядре, образован-ного протонами p+ (частицы
с зарядом +1,60 ∙ 10-19 Кл и массой ~ 1,67
∙ 10-27 кг) и нейтронами по - нейтральными частицами той же массой (нукло-ны). Каждый нуклон включает 3 кварка.
Основную часть объема атома составляют элект-роны, заряд которых - 1,60 ∙ 10-19 Кл, а масса все-го 5∙ 10-4 от массы p+ . Электроны двигаются вокруг ядра по орбиталям и удерживаются около него электростатическими силами; их число соответствует заряду ядра атома. Заряд ядра z по абсолютной величине совпадает с порядковым номером элемента в Периодической системе Д. И. Менделеева.
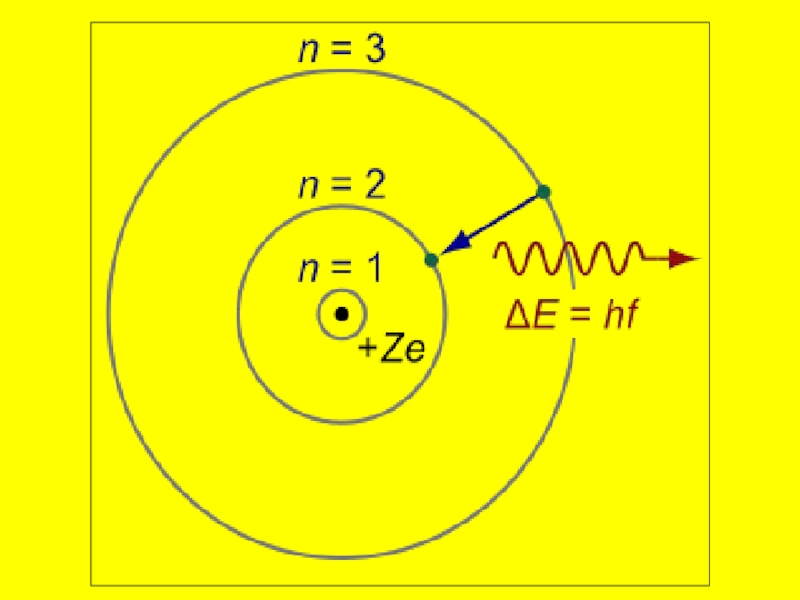
Слайд 8Данная модель не укладывалась в рамки класси-ческой физики, т.к. вращающийся
по орбите электрон должен терять энергию.
Теория Н.
Бора объяснила это противоречие, в ее постулатах показано:Электрон может вращаться вокруг ядра только
по стационарным орбитам определенного радиуса, при этом его энергия остается постоянной.
2) При переходе электрона с одной стационарной орбиты на другую происходит поглощение или излучение кванта энергии - это порция света (фотон).
Слайд 10 В химических превращениях масса и заряд ядра не меняются, поэтому
на них базируется электронная структура атома.
Увеличение заряда ядра z на
1 приводит к увеличению числа е- . Получаются новые химические элементы с индивидуальными свойст-вами. Энергия е- различна и зависит от общего числа электронов, расстояния от центра ядра и других факторов. Чем ближе расположен е- к ядру, тем прочнее связь и меньше энергия электрона. На далеко расположенных орбитах энергия е- больше, а связь с ядром слабее.
Слайд 11Пространство вокруг ядра, в котором может нахо-диться е- , называется
орбиталью. В соответствии с дискретностью энергии электрона каждая орбиталь характеризуется
тремя квантовыми числами: главным n, орбитальным l и магнитным ml.1. Главное квантовое число n. Совокупность близ-ких по энергии атомных орбиталей (АО) образует энергетический уровень, для обозначения кото-рого используется главное квантовое число n. Оно может принимать целочисленные значения 1, 2, 3 до ∞ (исторически энергетическим уровням приписаны обозначения K, L, M, N, O, P; К → n = 1). n определяет общий уровень энергии и степень удаленности уровня от ядра.
Слайд 12В реально существующих атомах электронами могут быть заполнены 6
уровней, 7-ой заполнен частично (табл.).
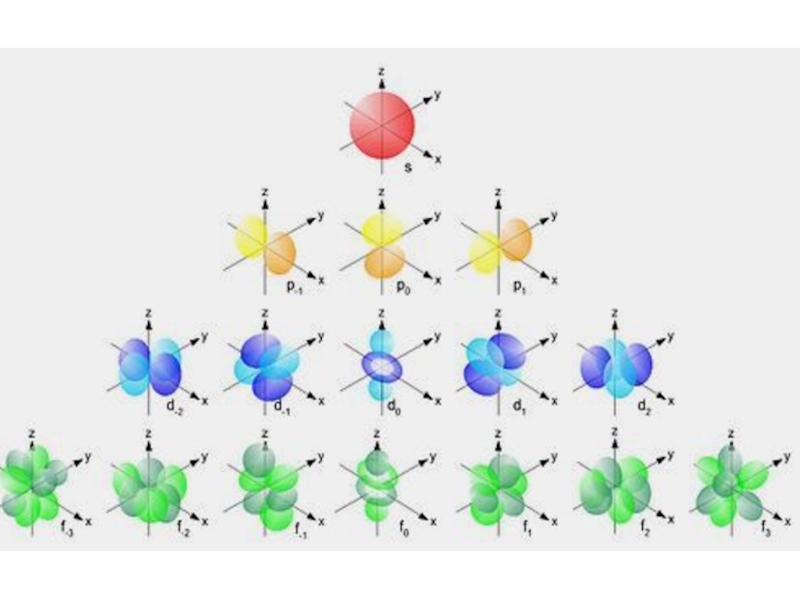
Орбитальное квантовое число l. Каждый уровень
(кроме n = 1) имеет несколько подуров-ней, которые обозначаются орбитальным кван-товым числом l и изменяются от 0 до (n - 1). Каждому значению l соответствует орбита осо-бой формы: s, p, d, f и др. При l = 0 АО (s-орбиталь) имеет сферическую форму; значению l = 1 соответствует АО (p-орбиталь) в виде гантели.
Например, при n = 1 l = 0 (только s-подуровень); при n = 3 подуровни s, p и d (l = 3).
Слайд 143. Магнитное квантовое число ml. Подуровни также делятся на атомные
орбитали АО, обозначаемые квантовым числом ml.
ml зависит
от l, принимает значения от - l до + l, включая 0, т. е. число АО на подуровне l равно (2 l + 1). По физическому смыслу ml определяет направле-ние, в котором вытянуто электронное облако. Подуровни АО имеют одинаковую энергию, т. к. все направления равноценны.
Слайд 15 3 первых квантовых числа характеризуют вращение электронов вокруг ядра
атома (отсюда название Планетарная модель атома Резерфорда), 4-е кв. ч.
– вращение вокруг оси.4. Спиновое квантовое число ms. Имеет лишь два возможных значения: - ½ и +1/2, что связано с вращением электронов в двух противополож-ных направлениях вокруг собственной оси.
Слайд 162. Правила квантовой механики
Состояние е- в атоме определяется набором 4-х
квантовых чисел.
Подобно любой системе, атомы стремятся к ми-нимуму энергии, что
достигается распределением электронов по орбиталям.1). Согласно принципу Паули, в атоме не может быть 2-х электронов с одинаковым набором всех квантовых чисел.
Электрон на схеме изображается стрелкой: вверх ↑ - положительное значение спина +1/2, вниз ↓ - отрицательное - ½ ; атомная орбиталь - ячейкой.
Слайд 17На одной АО по принципу Паули не может быть
больше 2-х электронов (е- на одной АО имеют одинаковые
значения n, l и ml , могут отличаться только ms). Этот принцип позволяет также опре-делить максимальное число электронов на уровне (таблица).Максимальное число е- в подуровне 2(2 l + 1), в уровне - 2n2.
Слайд 182) Правило Гунда. Заполнение электронами АО одного подуровня происходит
таким образом, чтобы суммарный спин (по модулю) был максимальным.
Слайд 20Электронную структуру атома принято записывать двумя квантовыми числами в виде
nl. Число
электронов на подуровне обозначается цифрой справа вверху. Например, электронная
конфигу-рация атома Na: 11Na 1s22s22р63s1 .Энергия не занятых электронами уровней увеличи-вается с ростом n, а в пределах уровня - с уве-личением l: ns < nр < nd < nf. До аргона 18Аr электронные подуровни будут заполняться в по-рядке возрастания энергии, а далее за счет роста числа электронов усиливается межэлектронное отталкивание, подуровни смещаются.
Слайд 213) Правила Клечковского (принцип наименьшей энергии атома) устанавливают последовательность заполнения
электронами энергетических подуров-ней в зависимости от n и
l:а) При увеличении заряда ядра атома заполнение электронных орбиталей происходит в порядке увеличения суммы (n + l).
б) При равенстве суммы (n + l) в первую очередь заполняется подуровень с меньшим значением n.
Явление проскока электронов – исключение из пра-вила: когда при заполнении d-подуровня наполо-вину или полностью не хватает 1 электрона, происходит проскок электрона с s-подуровня:
Слайд 22(n – 1)d4 ns2 → (n – 1)d5 ns1 (n
– 1)d9 ns2 → (n – 1)d10 ns1
3. Периодический
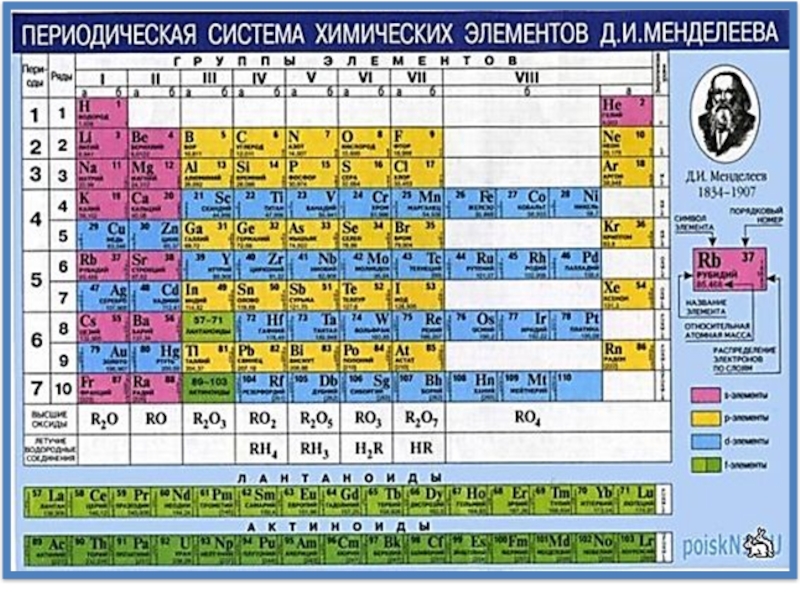
закон Д.И. Менделеева. Структура периодической системы химических элементов. Современная формулировка периодического закона Д.И. Менделеева: Свойства элементов и их соединений находятся в периодической зависимос-ти от заряда ядра (порядкового номера) элемента. В классической формулировке - от атомного веса.
Положение элемента в периодической системе од-нозначно связано с его электронным строением:
Слайд 24Номер периода совпадает со значением главного квантового числа n внешнего
уровня.
Каждый период начинается с s- элемента (запол-няется s-подуровень).
Номер группы
для элементов главных под-групп соответствует числу электронов на внешнем уровне (т. к. максимальное число элек-тронов на внешнем уровне = 8, число групп в системе 8).Период - горизонтальный ряд элементов с последо-вательно меняющимися свойствами. 1, 2, 3 - малые периоды; 4 – 7 - большие периоды, сос-тоящие из 2-х рядов.
Слайд 25Количество элементов в периоде: χчетн = (N + 2)2/2; χнечетн
= (N + 1)2/2, N – номер периода
Группа -
вертикальный ряд, в котором друг под другом расположены сходные между собой элементы. Выделяют главные и побочные под-группы: главные образованы элементами малых периодов и сходными с ними по свойствам эле-ментами больших периодов; побочные подгруппы - элементами больших периодов.Слайд 26Из электронной формулы атома легко определить валентные электроны и орбитали:
им соответству-ют подуровни с максимальным значением n и l.
Внешние, наиболее
удаленные от ядра и наименее связанные с ним электроны, легко вступают во взаимодействие с другими атомами. Общее коли-чество электронов на внешнем уровне элемента определяет максимально достижимую валентность и равно номеру группы в таблице.Химические элементы, имеющие сходство в структуре внешнего электронного слоя, проявля-ют общие химические свойства.
Слайд 27 Металлы - это элементы, способные отдавать электроны, превращаясь в положительно
(+) заряженный ион, проявляют восстановительные свойства.
Ме - n е- →
Меn+3Li 1s22s1 → Li+ 1s22s0
Все s, d, f - элементы - металлы, из р-элементов к Ме относится 10 элементов.
Неметаллы способны принимать электроны, превра-щаясь в отрицательно (-) заряженный ион, проявляют окислительные свойства.
R + n е- → R n-
C l …..3s23р5 → C l - ….3s23р6 (∑е- = 8)
Слайд 28 Потенциал ионизации I - наименьшее значение энергии, необходимое для
отрыва одного электрона от атома. Эта энергия увеличивается в периоде,
а в группе уменьшается с ростом порядкового номера.
Энергия сродства к электрону Е - энергия, которая выделяется при присоединении е- к атому (выигрыш энергии), эВ, Дж (кал)/ г-атом.
Электроотрицательность ЭО - сумма потенциала ионизации и энергии Е, определяет способность атома оттягивать на себя электроны.
ЭО = I + Е
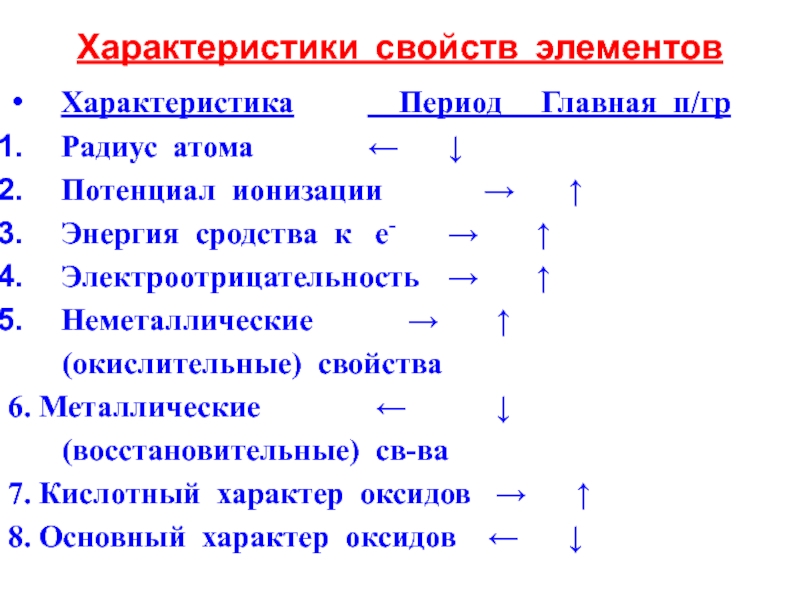
Слайд 29Характеристики свойств элементов
Характеристика Период Главная п/гр
Радиус атома ← ↓
Потенциал
ионизации → ↑
Энергия сродства к
е- → ↑Электроотрицательность → ↑
Неметаллические → ↑
(окислительные) свойства
6. Металлические ← ↓
(восстановительные) св-ва
7. Кислотный характер оксидов → ↑
8. Основный характер оксидов ← ↓
Слайд 30Изменение кислотно-основных свойств гидроксидов:
(3-ий период): NaOH (щел) → Mg(OH)2 (осн)
→ Al(OH)3 (амфот. гидроксид) → H2SiO3 (слабая к-та) → H3PO4
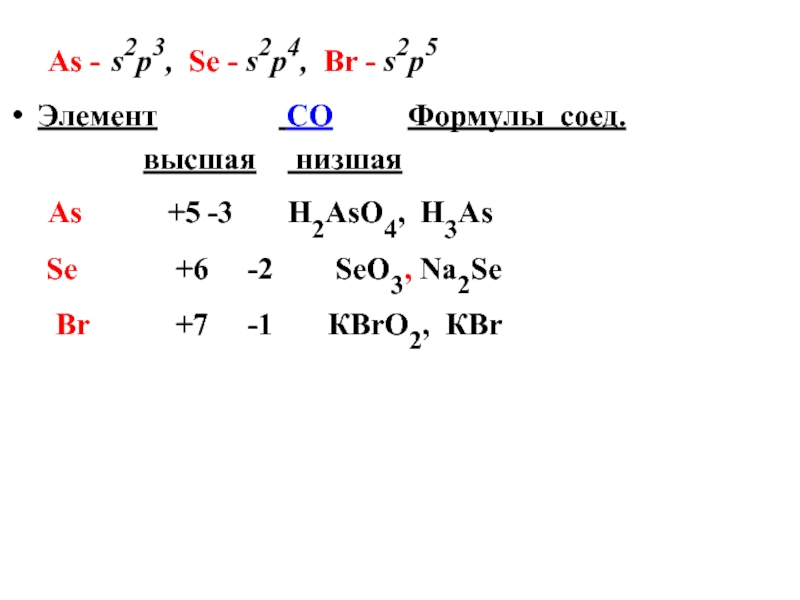
(к-та средней силы) → H2SO4 (сильная к-та) → HClO4 (очень сильная к-та).Пример. Какую высшую и низшую степень окисле-ния (СО) проявляют As, Se, Br?
Высшую СО элемента определяет № группы в табл. Менделеева. Низшая СО - условный заряд, который приобретает атом при присоединении того количества е- , которое необходимо для образования устойчивой оболочки из 8 е-
(ns2nр6 ).
Слайд 31As - s2р3, Se - s2р4, Br - s2р5
Элемент
СО Формулы соед.
высшая
низшаяAs +5 -3 Н2AsО4, Н3As
Se +6 -2 SeО3, Na2Se
Br +7 -1 КBrО2, КBr