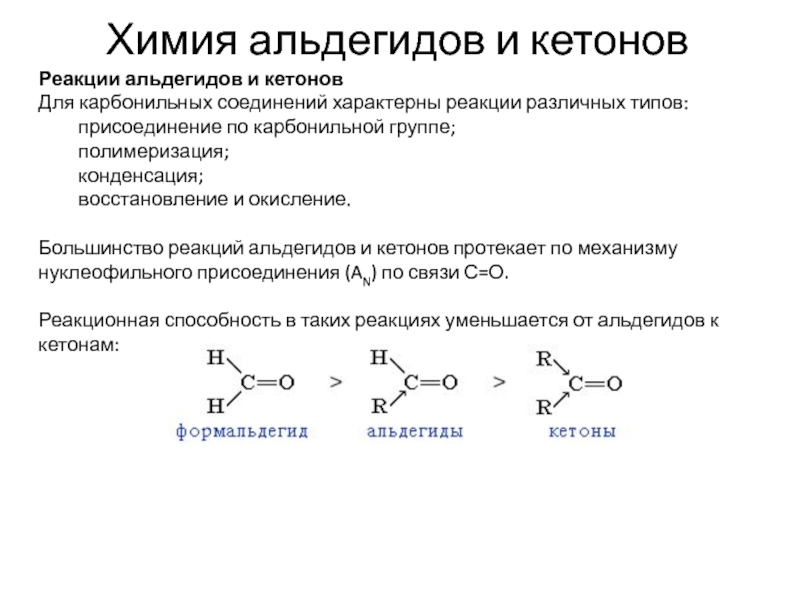
Слайд 2Химия альдегидов и кетонов
Реакции альдегидов и кетонов
Для карбонильных соединений характерны
реакции различных типов:
присоединение по карбонильной группе;
полимеризация;
конденсация;
восстановление
и окисление.
Большинство реакций альдегидов и кетонов протекает по механизму нуклеофильного присоединения (AN) по связи С=О.
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Слайд 3Химия альдегидов и кетонов
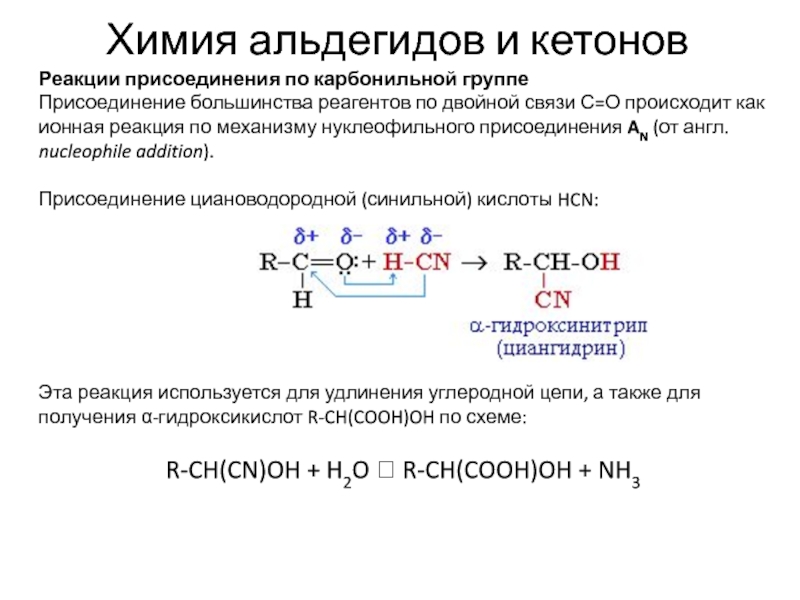
Реакции присоединения по карбонильной группе
Присоединение большинства реагентов
по двойной связи С=О происходит как ионная реакция по механизму
нуклеофильного присоединения AN (от англ. nucleophile addition).
Присоединение циановодородной (синильной) кислоты HCN:
Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме:
R-CH(CN)OH + H2O R-CH(COOH)OH + NH3
Слайд 4Химия альдегидов и кетонов
Реакции присоединения по карбонильной группе
Присоединение спиртов с
образованием полуацеталей (в присутствии кислоты или основания как катализатора):
Полуацетали -
соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:
Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными (-OR) группами.
Реакции карбонильных соединений со спиртами играют важную роль в химии углеводов
Слайд 5Химия альдегидов и кетонов
Реакции присоединения по карбонильной группе
Присоединение реактива Гриньяра
к альдегидам и кетонам
Присоединение R-MgHal к формальдегиду приводит к образованию
первичных спиртов:
Из альдегидов получаются вторичные спирты:
В реакции с кетонами образуются третичные спирты:
Слайд 6Химия альдегидов и кетонов
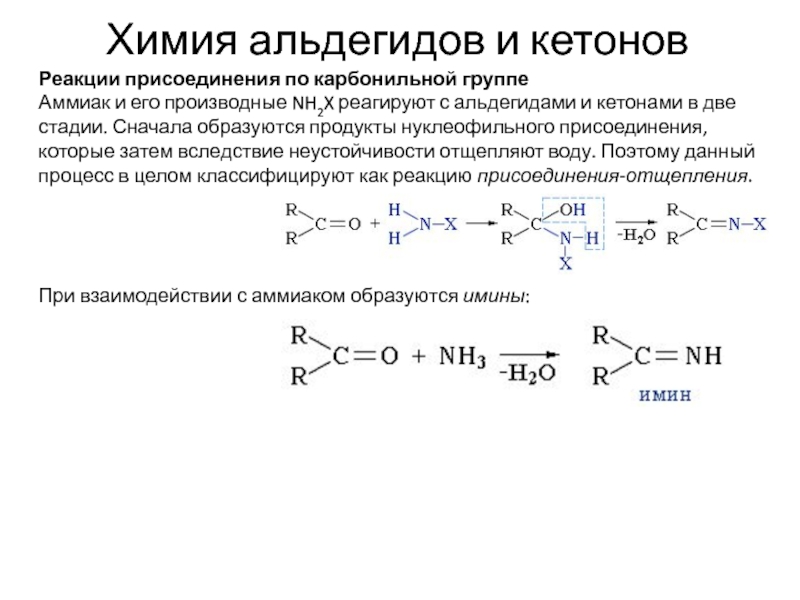
Реакции присоединения по карбонильной группе
Аммиак и его
производные NH2X реагируют с альдегидами и кетонами в две стадии.
Сначала образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. Поэтому данный процесс в целом классифицируют как реакцию присоединения-отщепления.
При взаимодействии с аммиаком образуются имины:
Слайд 7Химия альдегидов и кетонов
Реакции присоединения по карбонильной группе
Реакция альдегидов и
кетонов с аммиаком может сопровождаться циклизацией продуктов присоединения. Например, взаимодействие
аммиака с формальдегидом, как показал А.М. Бутлеров, приводит к образованию гексаметилентетрамина, известного как медицинский препарат уротропин:
Нитрование гексаметилентетрамина приводит к образованию сильного взрывчатого вещества "гексоген":
Слайд 8Химия альдегидов и кетонов
Реакции полимеризации карбонильных соединений
Полимеризация - частный случай
реакций присоединения - характерна в основном для альдегидов. Например, при
стоянии 40% водного раствора формальдегида (формалина), в виде белого осадка образуется полимер формальдегида с невысокой молекулярной массой - параформ:
n H2C=O + H2O HOCH2–(OCH2)n-2–OCH2OH
( n = 7, 8 )
Образование полимеров можно рассматривать как результат нуклеофильной атаки атомом кислорода одной молекулы альдегида карбонильного атома углерода другой молекулы.
Полимеры альдегидов довольно неустойчивы: в кислой среде они гидролизуются с образованием исходных продуктов.
Слайд 9Химия альдегидов и кетонов
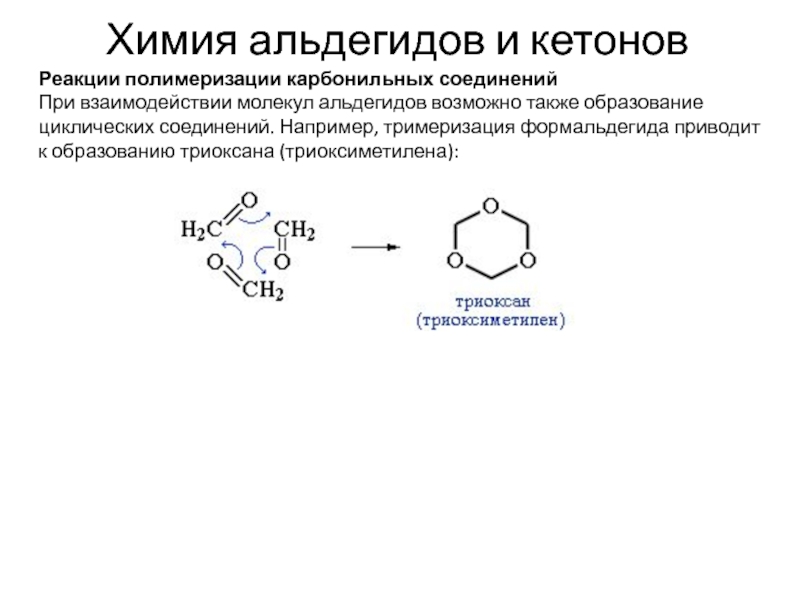
Реакции полимеризации карбонильных соединений
При взаимодействии молекул альдегидов
возможно также образование циклических соединений. Например, тримеризация формальдегида приводит к
образованию триоксана (триоксиметилена):
Слайд 10Химия альдегидов и кетонов
Реакции конденсации карбонильных соединений
Конденсацией называется реакция, приводящая
к усложнению углеродного скелета и возникновению новой углеродной связи, причем
из двух или более относительно простых молекул образуется новая, более сложная молекула.
1) Конденсация с фенолами. Практическое значение имеет реакция формальдегида с фенолом (катализаторы - кислоты или основания):
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол.
Слайд 11Химия альдегидов и кетонов
Конденсация с фенолами. Идет далее с образованием
фенол-формальдегидных смол по схеме :
Слайд 12Химия альдегидов и кетонов
При использовании щелочных катализаторов и избытка альдегида
в начальной стадии поликонденсации получаются линейные цепи резола:
При нагревании их
с дополнительной порцией формальдегида в щелочной среде эти цепи "сшиваются" между собой за счет групп CH2OH, находящихся в пара-положении фенольного кольца, с образованием трехмерного полимера – резита:
Слайд 13Химия альдегидов и кетонов
Карбамидные (мочевиноформальдегидные) смолы
ВИДЕО
Кто напишет реакцию в конспекте
– тому дополнительные баллы.
Слайд 14Химия альдегидов и кетонов
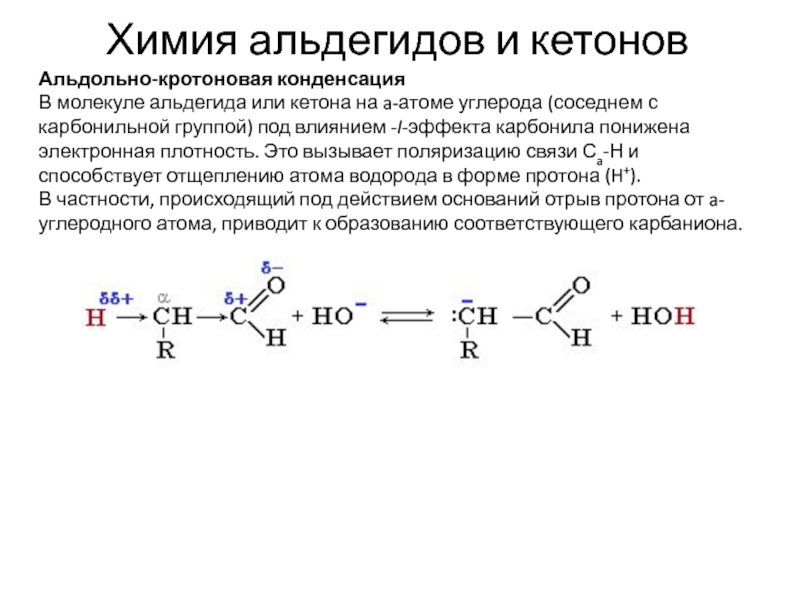
Альдольно-кротоновая конденсация
В молекуле альдегида или кетона на
a-атоме углерода (соседнем с карбонильной группой) под влиянием -I-эффекта карбонила
понижена электронная плотность. Это вызывает поляризацию связи Сa-Н и способствует отщеплению атома водорода в форме протона (H+).
В частности, происходящий под действием оснований отрыв протона от a-углеродного атома, приводит к образованию соответствующего карбаниона.
Слайд 15Химия альдегидов и кетонов
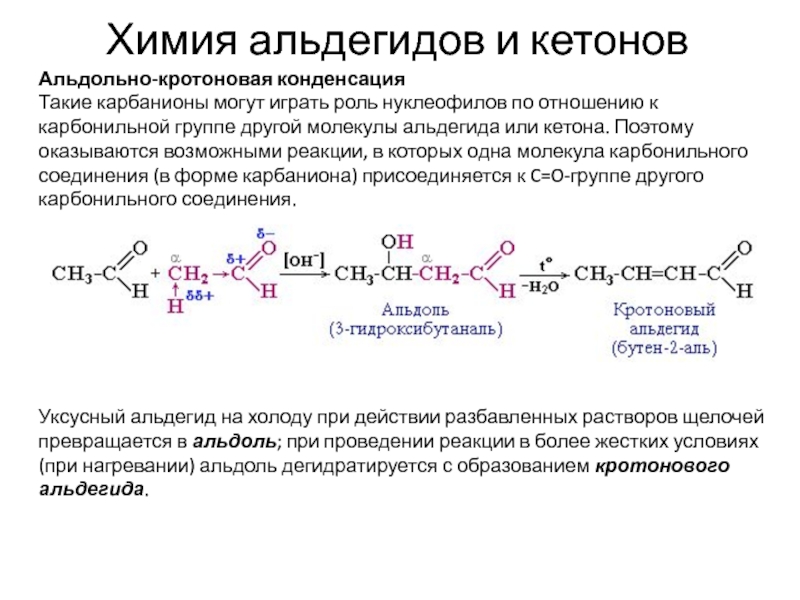
Альдольно-кротоновая конденсация
Такие карбанионы могут играть роль нуклеофилов
по отношению к карбонильной группе другой молекулы альдегида или кетона.
Поэтому оказываются возможными реакции, в которых одна молекула карбонильного соединения (в форме карбаниона) присоединяется к C=O-группе другого карбонильного соединения.
Уксусный альдегид на холоду при действии разбавленных растворов щелочей превращается в альдоль; при проведении реакции в более жестких условиях (при нагревании) альдоль дегидратируется с образованием кротонового альдегида.
Слайд 16Химия альдегидов и кетонов
Реакции восстановления альдегидов и кетонов
Альдегиды при взаимодействии
с водородом в присутствии Ni-катализатора образуют первичные спирты, кетоны -
вторичные:
В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития LiAlH4
Слайд 17Химия альдегидов и кетонов
Реакции окисления альдегидов и кетонов
Альдегиды очень легко
окисляются в соответствующие карбоновые кислоты под действием даже таких мягких
окислителей, как оксид серебра и гидроксид меди (II).
Окисление происходит по связи С–Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(OH)=O.
Реакция "серебрянного зеркала" – окисление аммиачным раствором оксида серебра (реактив Толленса):
R–CH=O + 2[Ag(NH3)2]OH RCOOH + 2Ag↓ + 4NH3 + H2O
Слайд 18Химия альдегидов и кетонов
Реакции окисления альдегидов и кетонов
Окисление гидроксидом меди (II):
а)
в виде свежеприготовленного осадка Cu(OH)2 при нагревании,
б) в форме комплекса
с аммиаком [Cu(NH3)4](OH)2,
в) в составе комплекса с солью винной кислоты (реактив Фелинга).
При этом образуется красно-кирпичный осадок оксида меди (I) или металлическая медь (реакция "медного зеркала", более характерная для формальдегида):
R-CH=О + 2Cu(OH)2 RCOOH + Cu2O↓ + H2О
H2C=О + Cu(OH)2 HCOOH + Cu↓ + H2О
R–CH=O + 2[Cu(NH3)4](OH)2 RCOOH + Cu2O↓ + 4NH3 + 2H2O
R–CH=O + 2Cu(OH)2/соль винной кислоты RCOOH + Cu2O↓ + 2H2O
ВИДЕО
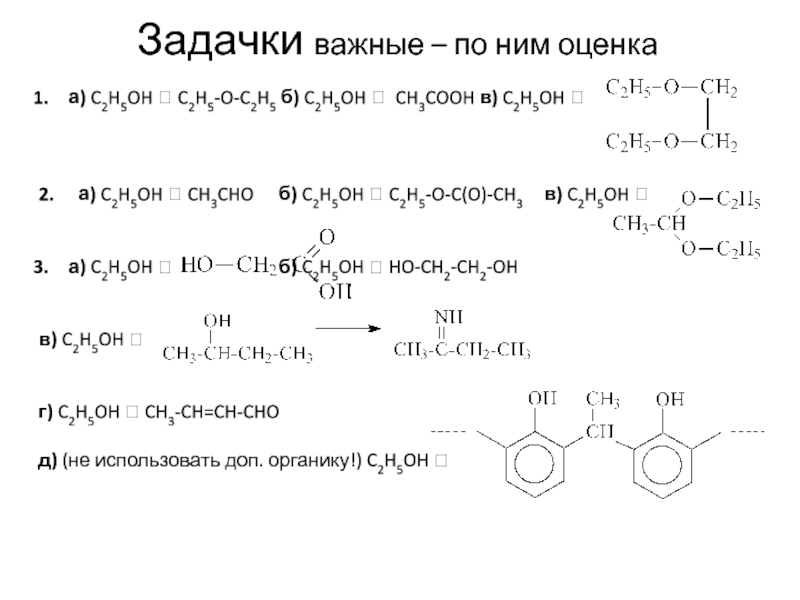
Слайд 19Задачки важные – по ним оценка
а) C2H5OH C2H5-O-C2H5 б)
C2H5OH CH3COOH в) C2H5OH
2. а) C2H5OH
CH3CHO б) C2H5OH C2H5-O-C(O)-CH3 в) C2H5OH
а) C2H5OH б) C2H5OH HO-CH2-CH2-OH
в) C2H5OH
г) C2H5OH CH3-CH=CH-CHO
д) (не использовать доп. органику!) C2H5OH