Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ХИМИЯ ЭЛЕМЕНТОВ ПОДГРУППЫ УГЛЕРОДА
Содержание
- 1. ХИМИЯ ЭЛЕМЕНТОВ ПОДГРУППЫ УГЛЕРОДА
- 2. Основные минералыбурый угольграфитантрациткаменный угольгорючий сланецторф
- 3. Основные минералыкварцевый песокSiO2кварцSiO2кременьSiO2ортоклазК[АlSi3О8]альбитNa[АlSi3О8]анортитCa[Al2Si2O8]
- 4. Основные минералыгерманитCu13Fe2Ge2S16галенитPbSаргиродитAg8GeS6касситеритSnO2станнинCu2FeSnS4церусситPbCO3англезитPbSO4
- 5. Получениеуглеродпиролиз органического сырья кремнийметаллотермиявосстановление коксом из оксидапиролиз силанагерманий, олово, свинецвосстановление коксом или водородом из оксидов
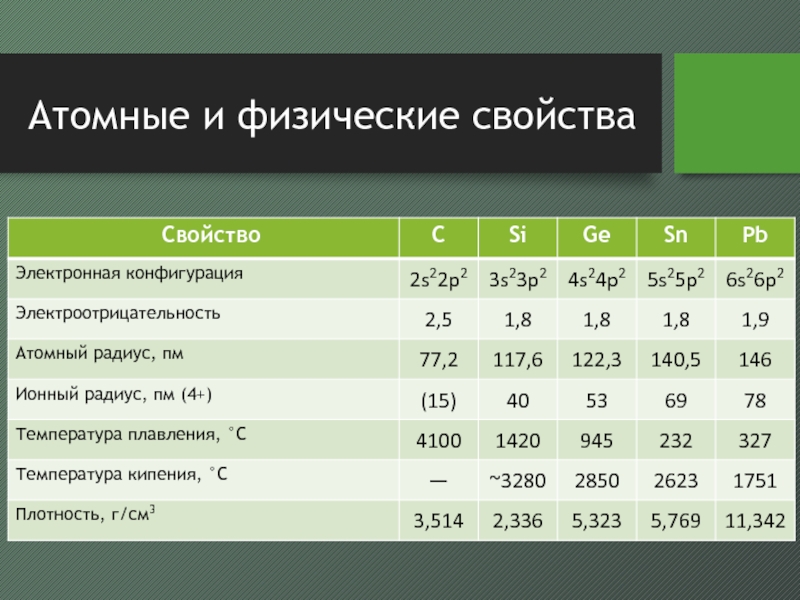
- 6. Атомные и физические свойства
- 7. Углерод аллотропияизвестно большое количество аллотропных модификаций углеродаα- и β графиталмазлонсдейлит (гексагон. алмаз)карбинфуллереныграфенУНТ и др.
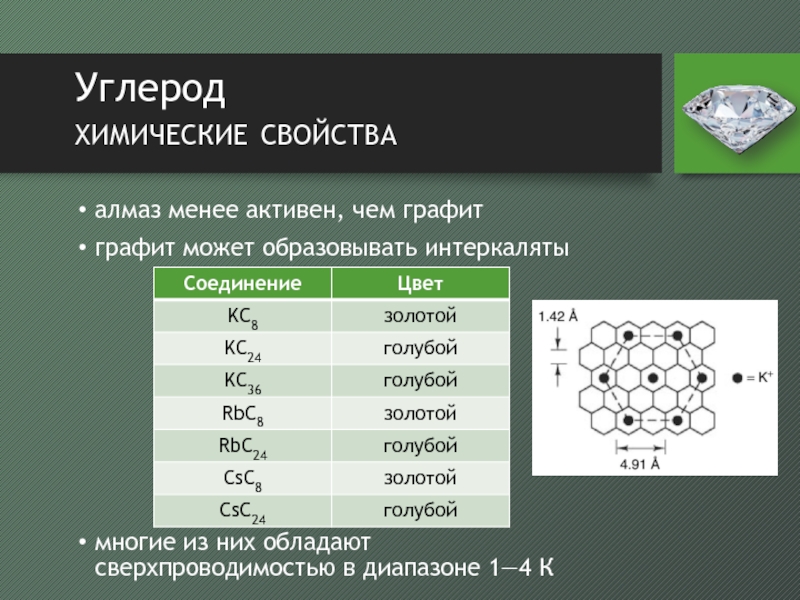
- 8. Углерод химические свойстваалмаз менее активен, чем графитграфит
- 9. Углерод химические свойства
- 10. Оксиды углеродауглерод образует оксиды CO, CO2, а
- 11. Оксиды углеродадиоксид углерода (углекислый газ) получают при
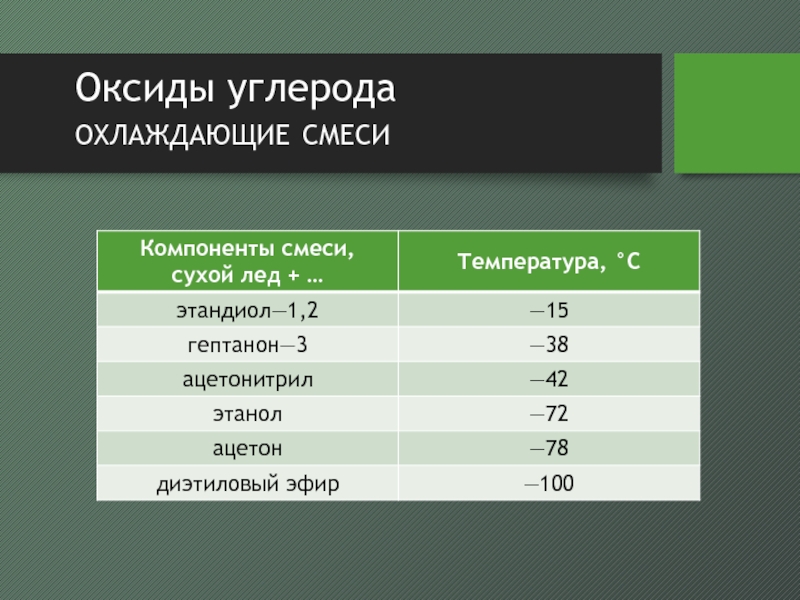
- 12. Оксиды углерода охлаждающие смеси
- 13. Оксиды углеродасубоксид углерода C3O2 получается при дегидратации
- 14. Оксиды углерода
- 15. Оксиды углеродасубоксид углерода C3O2 получается при дегидратации
- 16. Кислоты и оксоанионы углерода
- 17. Кислоты и оксоанионы углерода
- 18. Кислоты и оксоанионы углеродапри реакции CO2 и
- 19. Кислоты и оксоанионы углеродауглерод образует несколько циклических
- 20. Галогениды углеродафторид углерода можно получить при взаимодействии
- 21. Галогениды углерода
- 22. Кремнийпри обычной температуре довольно инертен (не окисляется
- 23. Силицидыдля элементов 11—15 групп (кроме меди) силициды
- 24. Силициды свойствасилициды ЩМ и ЩЗМ подвергаются гидролизу
- 25. Силаныобразуют гомологический ряд SinH2n+2
- 26. Силаны свойствабесцветные газы или жидкости (с трисилана),
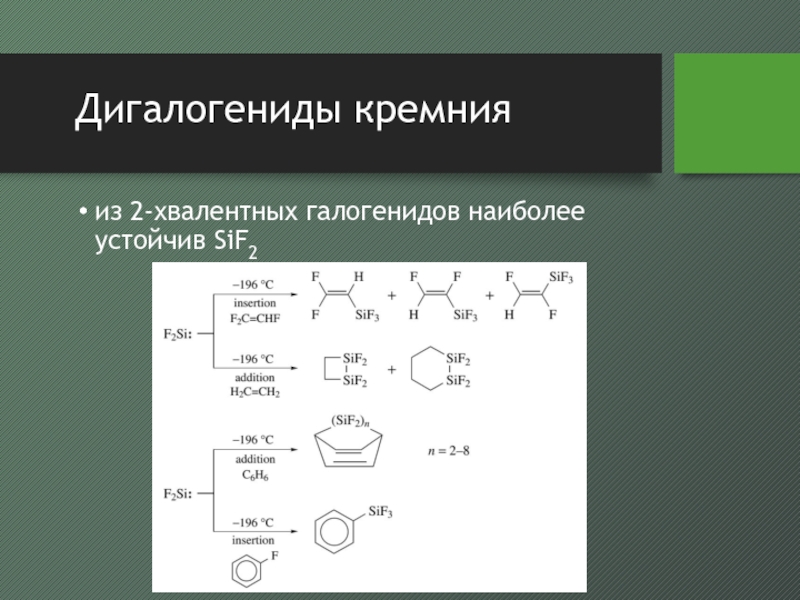
- 27. Дигалогениды кремнияиз 2-хвалентных галогенидов наиболее устойчив SiF2
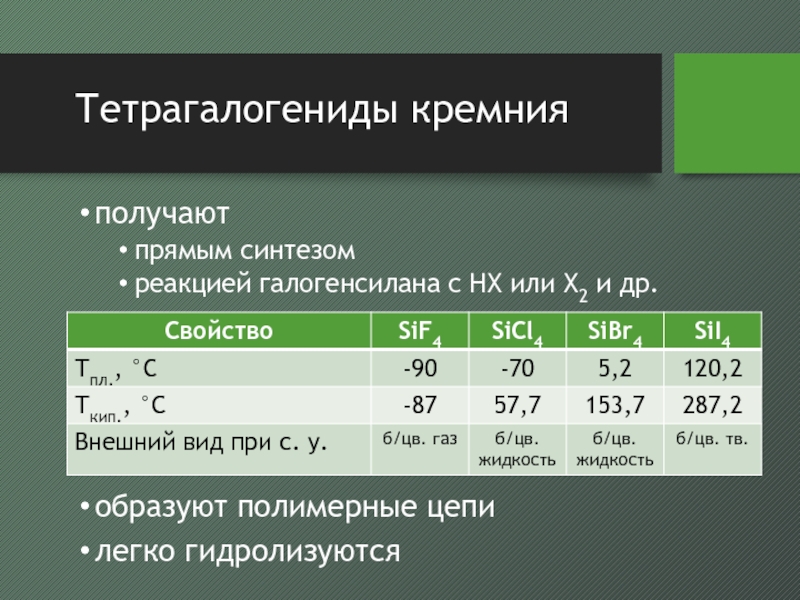
- 28. Тетрагалогениды кремнияполучаютпрямым синтезомреакцией галогенсилана с HX или X2 и др.образуют полимерные цепилегко гидролизуются
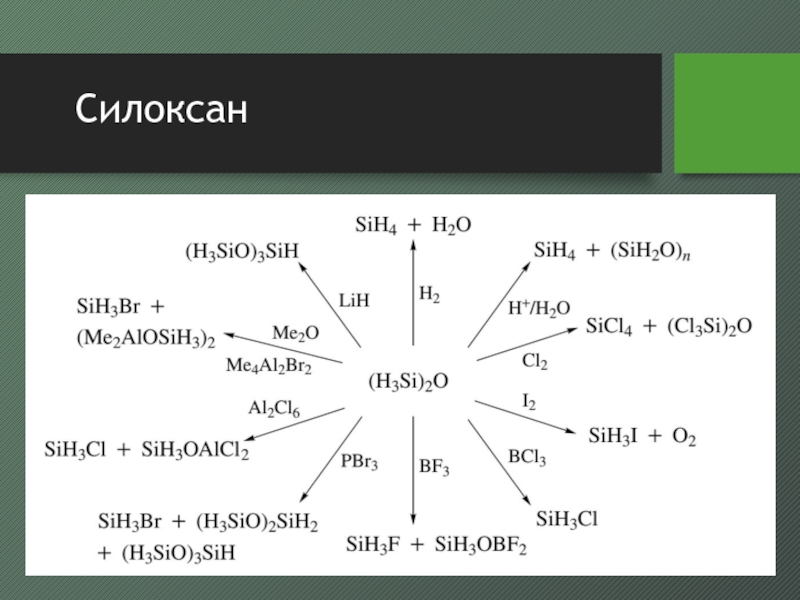
- 29. Силоксан
- 30. Оксиды кремниядиоксид кремния существует во множестве форм,
- 31. Оксиды кремнияSiO2 инертен почти ко всем реактивами
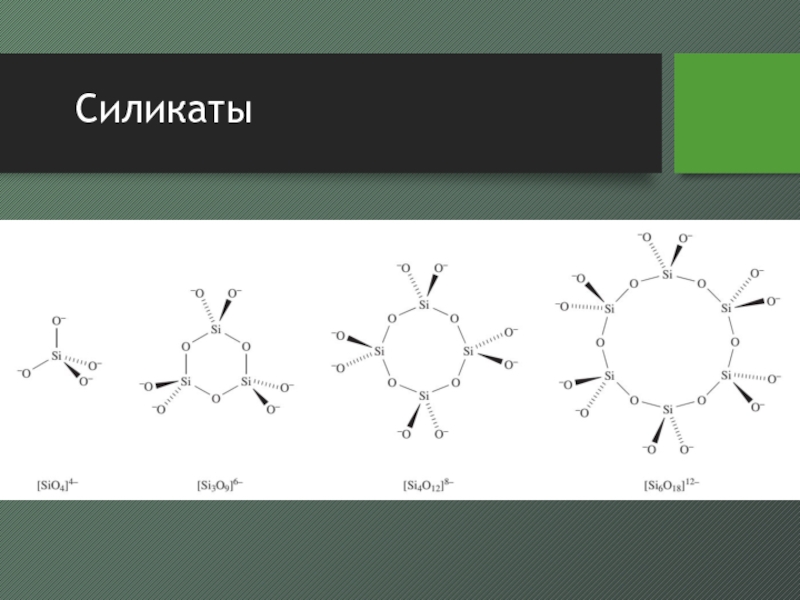
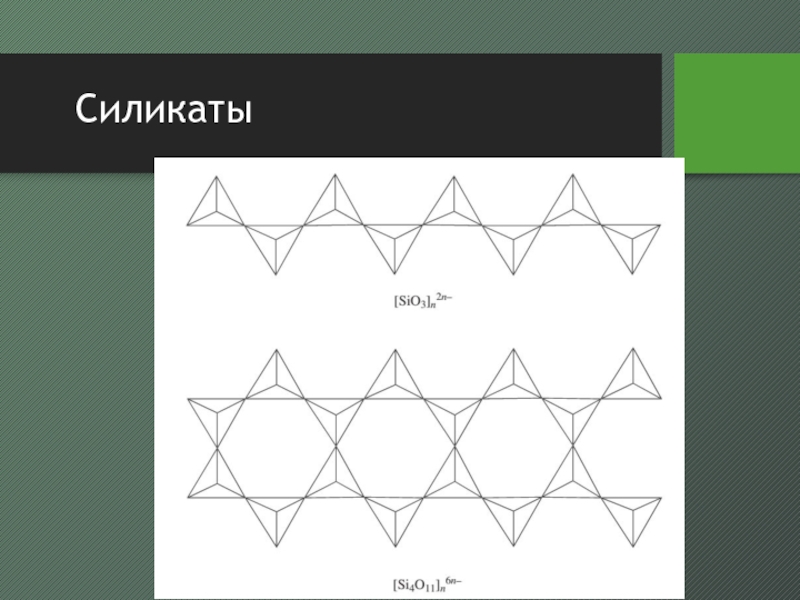
- 32. Силикаты
- 33. Силикаты
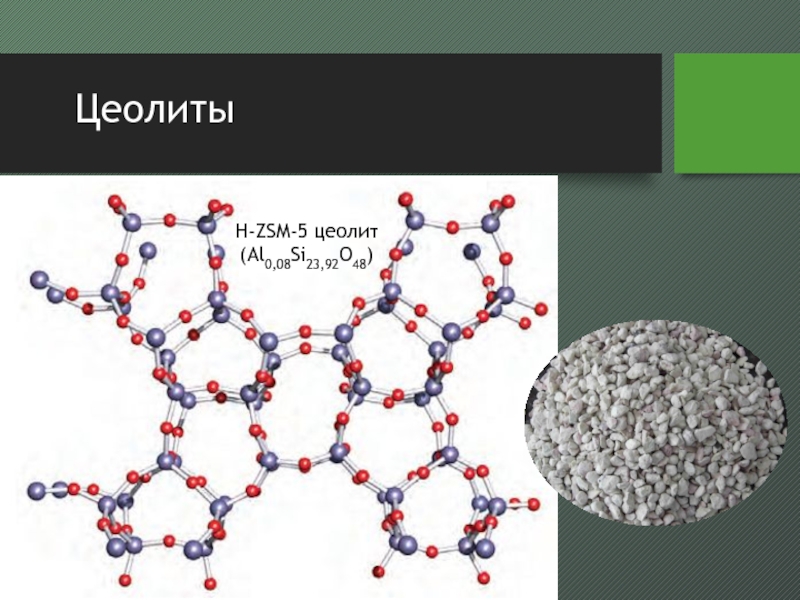
- 34. ЦеолитыH-ZSM-5 цеолит (Al0,08Si23,92O48)
- 35. Германийпо свойствам похож на кремний, но более
- 36. Гидриды германияGeH, GeH2, GeH0,9—1,2 — в основном
- 37. Германыполучениекислотный гидролиз Mg2Ge (Ge1—Ge5 + изомеры)реакция диоксида
- 38. Германы химические свойстваменее реакционноспособны, чем силаныне самовозгораются
- 39. Оксиды и гидроксиды германиягерманий образует 2 оксида:
- 40. Оксиды и гидроксиды германиягидроксид германия (II) получается
- 41. Галогениды германиятетрагалогениды мономернывсе галогениды GeX4 можно синтезировать
- 42. Олово и свинецметаллы более реакционноспособны, чем германийпри
- 43. Гидриды олова и свинцаSnH4 — станнан, PbH4
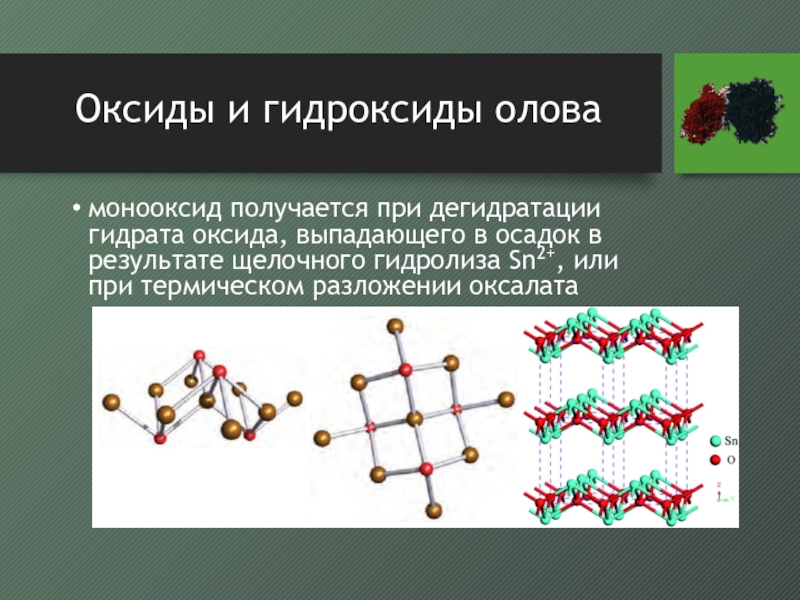
- 44. Оксиды и гидроксиды оловамонооксид получается при дегидратации
- 45. Оксиды и гидроксиды оловагидроксид олова (II) не
- 46. Оксиды и гидроксиды оловадиоксид образуется при прямом
- 47. Оксиды и гидроксиды свинцамонооксид свинца существует в
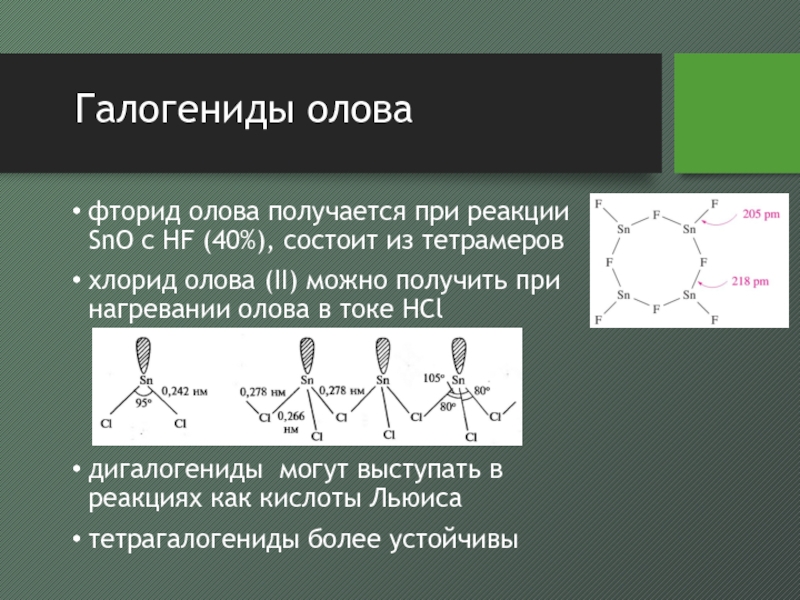
- 48. Галогениды оловафторид олова получается при реакции SnO
- 49. Галогениды оловатетрафторид олова получается действием б/в HF
- 50. Галогениды свинцаиз тетрахлоридов свинца устойчивы только фторид
- 51. Применение
- 52. Применение
- 53. Применение
- 54. Скачать презентанцию
Основные минералыбурый угольграфитантрациткаменный угольгорючий сланецторф
Слайды и текст этой презентации
Слайд 3Основные минералы
кварцевый песок
SiO2
кварц
SiO2
кремень
SiO2
ортоклаз
К[АlSi3О8]
альбит
Na[АlSi3О8]
анортит
Ca[Al2Si2O8]
Слайд 4Основные минералы
германит
Cu13Fe2Ge2S16
галенит
PbS
аргиродит
Ag8GeS6
касситерит
SnO2
станнин
Cu2FeSnS4
церуссит
PbCO3
англезит
PbSO4
Слайд 5Получение
углерод
пиролиз органического сырья
кремний
металлотермия
восстановление коксом из оксида
пиролиз силана
германий, олово, свинец
восстановление
коксом или водородом из оксидов
Слайд 7Углерод
аллотропия
известно большое количество аллотропных модификаций углерода
α- и β графит
алмаз
лонсдейлит (гексагон.
алмаз)
карбин
фуллерены
графен
УНТ и др.
Слайд 8Углерод
химические свойства
алмаз менее активен, чем графит
графит может образовывать интеркаляты
многие из
них обладают сверхпроводимостью в диапазоне 1—4 К
Слайд 10Оксиды углерода
углерод образует оксиды CO, CO2, а также C3O2, C5O2,
C12O9 и др.
угарный газ образуется при дегидратации муравьиной или щавелевой
кислоты, при реакции угля с парами водыв молекуле СО одна из связей образована по донорно-акцепторному механизму
СО не реагирует с водой, но с расплавленными щелочами дает формиаты. Получают дегидратацией муравьиной кислоты
обнаружить угарный газ можно по реакции с реактивом Толленса или с хлоридом платины (II)
легко вступает в реакции соединения
Слайд 11Оксиды углерода
диоксид углерода (углекислый газ) получают при горении угля, органических
веществ, при разложении карбонатов и гидрокарбонатов
в качестве химического реагента используется
редкоего основное применение связано с физическими свойствами: охлаждающий агент, газирование напитков, получение вспененных пластмасс, для создания инертной атмосферы
электрохимически восстанавливается до метанола, формиатов, оксалатов, метана и др.
используется для введения меток 14С
Слайд 13Оксиды углерода
субоксид углерода C3O2 получается при дегидратации малоновой кислоты
молекула линейна
при
комнатной температуре полимеризуется до желтого твердого вещества, а выше 100°С
до рубиново-красного тв. вещества, растворимого в воделегко гидратируется обратно с образованием малоновой кислоты
реагирует с аммиаком и хлороводородом с образованием производных малоновой кислоты
при фотолизе образуется C2O
Слайд 15Оксиды углерода
субоксид углерода C3O2 получается при дегидратации малоновой кислоты
молекула линейна
при
комнатной температуре полимеризуется до желтого твердого вещества, а выше 100°С
до рубиново-красного тв. вещества, растворимого в воделегко гидратируется обратно с образованием малоновой кислоты
реагирует с аммиаком и хлороводородом с образованием производных малоновой кислоты
при фотолизе образуется C2O
Слайд 18Кислоты и оксоанионы углерода
при реакции CO2 и KOH в 86%
растворе H2O2 при —10°С получается пероксокарбонат — K2C2O6
также пероксокарбонат можно
получить при электролизе раствора карбоната при —20°С, используя высокую плотность токапри реакции углекислого газа с надпероксидами пероксокарбонат получается как интермедиат
Слайд 19Кислоты и оксоанионы углерода
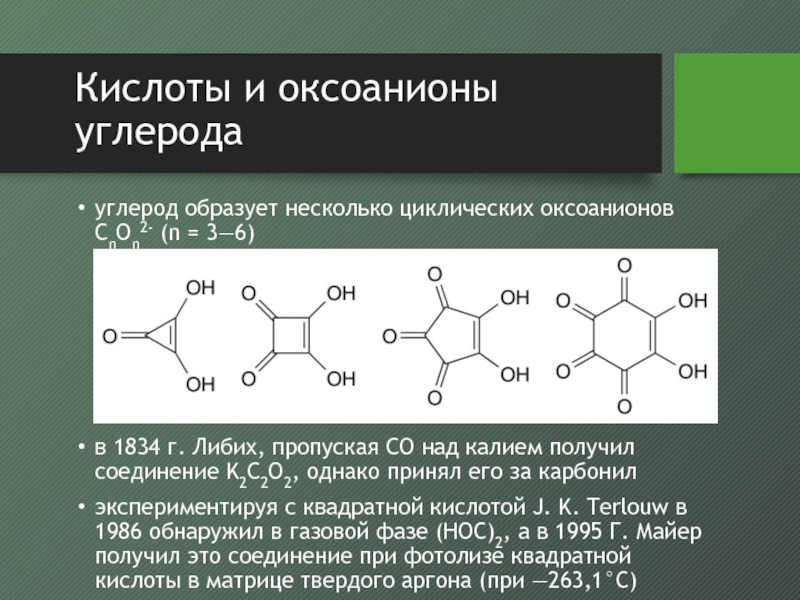
углерод образует несколько циклических оксоанионов CnOn2- (n
= 3—6)
в 1834 г. Либих, пропуская CO над калием получил
соединение K2C2O2, однако принял его за карбонилэкспериментируя с квадратной кислотой J. K. Terlouw в 1986 обнаружил в газовой фазе (HOC)2, а в 1995 Г. Майер получил это соединение при фотолизе квадратной кислоты в матрице твердого аргона (при —263,1°С)
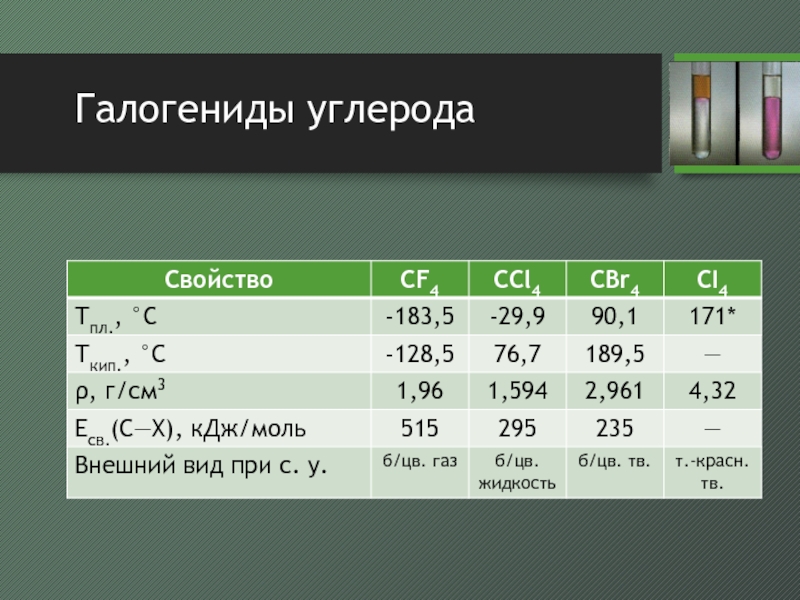
Слайд 20Галогениды углерода
фторид углерода можно получить при взаимодействии SiC с F2
или при фторировании CO2, CO или COCl2 фторидом серы (IV)
в
промышленности получают фторированием фреоновхимически инертен по отношению к большинству веществ вплоть до 600°С
хлорид получают при реакции CS2 (кат. Fe) или CH4 (250—400 °С) с хлором
бромид получают бромированием метана или при взаимодействии CCl4 с Al2Br6 при 100°С
иодид получают при взаимодействии CCl4 с C2H5I в присутствие Al2Cl6
Слайд 22Кремний
при обычной температуре довольно инертен (не окисляется на воздухе вплоть
до 900°С)
устойчив к действию кислот, но реагирует со смесью HNO3
+ HFхорошо растворяется в щелочах
из галогенов при н. у. реагирует только с фтором, с хлором — при 300°С, с бромом и иодом — при 500°С
Слайд 23Силициды
для элементов 11—15 групп (кроме меди) силициды неизвестны
получают:
сплавлением металлов или
гидридов металлов с кремнием
восстановлением оксидов металлов кремнием или углеродом в
присутствии SiO2обменной реакцией
Слайд 24Силициды
свойства
силициды ЩМ и ЩЗМ подвергаются гидролизу (по-разному в зависимости от
строения)
остальные силициды водой не разлагаются, а кислотами разлагаются до силанов
реагируют
со щелочами с образованием силикатовтермически очень устойчивы
ковалентные силициды – химически стойкие и тугоплавкие вещества
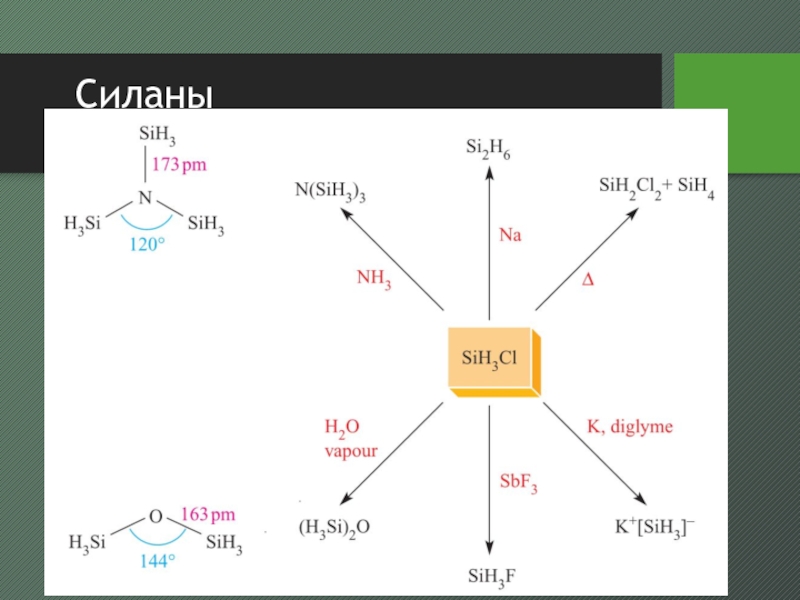
Слайд 25Силаны
образуют гомологический ряд SinH2n+2
(n = 1—10) и циклические SinH2n (n = 5,
6)впервые получены Ф. Вёлером и Г. Буффом в 1857 г. действием соляной кислоты на сплав кремния с алюминием
в 1902 А. Муассан и С. Смайлс при действии соляной кислоты на Mg2Si получили смесь Si1—Si4
чистый SiH4 получают при реакции SiCl4 или SiF4 с Li[AlH4]
Слайд 26Силаны
свойства
бесцветные газы или жидкости (с трисилана), нерастворимые в воде
горят на
воздухе, часто со взрывом
реагируют с растворами щелочей и ЩМ
при реакции
с галогенидами серебра в присутствии галогенида алюминия образуется SiH3XСлайд 28Тетрагалогениды кремния
получают
прямым синтезом
реакцией галогенсилана с HX или X2 и др.
образуют
полимерные цепи
легко гидролизуются
Слайд 30Оксиды кремния
диоксид кремния существует во множестве форм, каждая из которых
содержит тетраэдр SiO4
при атмосферном давлении существует 3 модификации
при быстром охлаждении
жидкого SiO2 получается стеклоподобная форма (размягчается при 1470°С)Слайд 31Оксиды кремния
SiO2 инертен почти ко всем реактивами при комнатной температуре
исключения:
HF, MeOH, F2 и др.
при 1500°С сплавляется с карбонатом натрия,
образуя «жидкое стекло»при добавлении кислоты к нему получается силикагель
Слайд 35Германий
по свойствам похож на кремний, но более электроположителен
германий стабилен на
воздухе и в воде
медленно растворяется в конц. HCl и HNO3,
не растворяется в разбавленных кислотах в щелочах без присутствия окислителяс расплавами щелочей образует германаты
с расплавами ЩМ образует кластерные германиды Ge42-, Ge92- и др.
Слайд 36Гидриды германия
GeH, GeH2, GeH0,9—1,2 — в основном полимеры
получаются гидролизом Na2Ge
или CaGe
(GeH2)n — белое твердое вещество, разлагается при –33°С на
моногерман и желтый полимер (GeH)nгерманы образуют гомологический ряд GenH2n+2 (n = 1—9)
по свойствам (химическим и физическим) очень напоминают силаны
Слайд 37Германы
получение
кислотный гидролиз Mg2Ge (Ge1—Ge5 + изомеры)
реакция диоксида германия с LiAlH4
или NaBH4 (Ge1—Ge3)
тихий электрический разряд через GeH4 (высшие
германы)свойства
Слайд 38Германы
химические свойства
менее реакционноспособны, чем силаны
не самовозгораются на воздухе
не реагируют с
кислотами и щелочами (до 30%)
растворы в жидком аммиаке ведут себя
как кислоты, образуя ионы GeH3-, и реагируют со ЩМ, образуя MeGeH3 белого цветаобразуют галогенпроизводные
Слайд 39Оксиды и гидроксиды германия
германий образует 2 оксида: GeO и GeO2
монооксид
получается при нагревании германия с диоксидом до 1000°С, при восстановлении
диоксида H3PO2 в растворе HCl, при термическом разложении Ge(OH)2стабилен при комнатной температуре, при нагревании на воздухе до 550°С окисляется
не реагирует с растворами HCl, H2SO4 и NaOH
с хлороводородом при 175°С образует GeHCl3
хлор и бром окисляют монооксид до диоксида и тетрагалогенида
Слайд 40Оксиды и гидроксиды германия
гидроксид германия (II) получается при гидролизе дигалогенидов
в виде желтого тв. вещества
диоксид образуется при гидролизе тетрахлорида, при
прямом окислении германиясуществует в трех модификациях
образует большое разнообразие германат ионов: GeO32−, GeO44−, Ge2O76−, Ge3O108−, Ge5O112−, Ge5O124−, Ge6O1812−, Ge8O172− и Ge9O204−
между германатами и силикатами нет структурного сродства
Слайд 41Галогениды германия
тетрагалогениды мономерны
все галогениды GeX4 можно синтезировать из простых веществ
ил при реакции раствора HCl с GeO2
GeF4 также получается при
разложении BaGeF6легко гидролизуются, образуя оксид и HX
в отличие от SiCl4, GeCl4 может присоединять хлорид, образуя анион
реагируя с германием конмутируют
дигалогениды легко гидролизуются
окисляются кислородом и галогенами
сильные кислоты Льюиса
Слайд 42Олово и свинец
металлы более реакционноспособны, чем германий
при комн. температурах устойчивы
на воздухе и в воде, НО свинцовый порошок пирофорен
при нагревании
на воздухе образуются SnO2 и PbOолово растворяется в разб. HNO3, конц. HCl и H2SO4, в горячих растворах щелочей
свинец медленно раств. в HCl, быстро — в HNO3
галогены окисляют олово до 4+, а свинец — до 2+
Слайд 43Гидриды олова и свинца
SnH4 — станнан, PbH4 — плюмбан
станнан получается
при взаимодействии хлорида олова (IV) аланатом лития
образуется также при восстановлении
солей олова (II) цинком или магнием в солянокислой средебесцветный газ (tпл. = —146°С, tкип. = —52,5°С)
на воздухе самовозгорается и горит голубым пламенем
при комнатной температуре медленно разлагается
не взаимодействует с разбавленными кислотами и щелочами
Слайд 44Оксиды и гидроксиды олова
монооксид получается при дегидратации гидрата оксида, выпадающего
в осадок в результате щелочного гидролиза Sn2+, или при термическом
разложении оксалатапри нагревании на воздухе окисляется до диоксида, без воздуха диспропорционирует
Слайд 45Оксиды и гидроксиды олова
гидроксид олова (II) не получается в водном
растворе, вместо него выпадает гидрат состава 3SnO·H2O
получается в виде аморфного
белого вещества с использованием металлоорганики в неводных растворахи оксид и гидроксид олова (II) амфотерны
растворяясь в щелочах дают пирамидальные ионы [Sn(OH)3]-
Слайд 46Оксиды и гидроксиды олова
диоксид образуется при прямом окислении металла или
при дегидратации гидрата оксида
нерастворим в воде и разбавленных растворах щелочей,
но легко растворяется в их расплавахгидроксид олова (IV) неизвестен, при щелочном гидролизе образуется SnO2·H2O
Слайд 47Оксиды и гидроксиды свинца
монооксид свинца существует в двух модификациях
глет имеет
структуру SnO
образуется при прямом окислении кислородом при нагревании, НО нагревание
при 490°С приводит к образованию Pb3O4гидроксид свинца (II) не образуется, при ↑рН растворов Pb2+ образуется [Pb6O(OH)6]4+
диоксид свинца также существует в двух модификациях
получается при окислении монооксида, например, гипохлоритами
при нагревании разлагается
проявляет кислотные свойства
Слайд 48Галогениды олова
фторид олова получается при реакции SnO с HF (40%),
состоит из тетрамеров
хлорид олова (II) можно получить при нагревании олова
в токе HClдигалогениды могут выступать в реакциях как кислоты Льюиса
тетрагалогениды более устойчивы
Слайд 49Галогениды олова
тетрафторид олова получается действием б/в HF на SnCl4
белые гигроскопичные
кристаллы
обладает полимерной структурой
другие галогениды можно получить прямым синтезом
они представляют собой
летучие жидкости или твердые веществалегко гидролизуются
как кислоты Льюиса, образуют аддукты состава SnX4·2L
Слайд 50Галогениды свинца
из тетрахлоридов свинца устойчивы только фторид и хлорид
фторид —
твердый, обладает полимерной структурой
хлорид — маслянистая жидкость — получается при
действии конц. серной кислоты на гексахлороплюмбат пиридина, разлагается со взрывом на хлор и дихлорид выше 50°Сдигалогениды более устойчивы
образуются в виде осадков в обменных реакциях


![ХИМИЯ ЭЛЕМЕНТОВ ПОДГРУППЫ УГЛЕРОДА Основные минералыкварцевый песокSiO2кварцSiO2кременьSiO2ортоклазК[АlSi3О8]альбитNa[АlSi3О8]анортитCa[Al2Si2O8] Основные минералыкварцевый песокSiO2кварцSiO2кременьSiO2ортоклазК[АlSi3О8]альбитNa[АlSi3О8]анортитCa[Al2Si2O8]](/img/tmb/4/352786/eccb086f0ba3e56fd201b3b3a676748a-800x.jpg)