Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия титанорганических соединений
Содержание
- 1. Химия титанорганических соединений
- 2. Чистый образец Ti получили голландцы А. ван
- 3. Порядковый номер: 22IV Б – группа Период
- 4. 1s22s22p63s23p63d24s2 Строение электронной оболочки атома титана
- 5. Физические свойстваЛёгкий прочный металл серебристо-белого цвета;Существует в виде
- 6. Коррозионные свойства
- 7. Нахождение в природе
- 8. Тi образует органические производные 2ух основных типов:1-тип
- 9. Алкилгалогениды титана(IV) TiXnR4-nR – метил, этил, бутилX
- 10. Метилтрихлорид титанаTiCl3(CH3)темно-фиолетовые кристаллырастворим в углеводородах и их галогенпроизводныхустойчив в отсутствии влаги и воздуха при 20 °С
- 11. Этилтрихлорид титанаTiCl3(C2H5)красноватая жидкостьраспадающуюся за 24 ч при
- 12. Диалкилдигалогениды титана
- 13. Диметилдихлорид и диэтилдихлорид титана ТiСl2(СН3)2черно-фиолетовые кристаллырастворимые в углеводородах (гексан)растворы окрашены в желтый цветТiСl2(СН3)2
- 14. Триалкилмоногалогениды титана
- 15. ТетраметилтитанTi(CH3)4Блестящие желтые иглообразные кристаллыУстойчив лишь при низких температурахпри температуре выше 0° С спонтанно разлагается
- 16. Тетраэтилтитан и тетрапропилтитанTi(C2H5)4 Ti(C3H7)4 оранжево-желтые кристаллычрезвычайно неустойчив
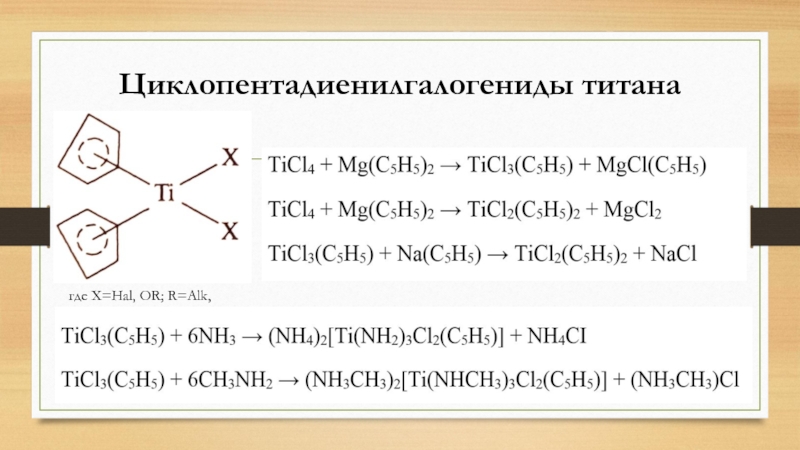
- 17. Циклопентадиенилгалогениды титанагде X=Hal, OR; R=Alk, Аг
- 18. ДиметилдициклопентадиенилтитанТi(С5Н5)2(СН3)2 Оранжевые иглообразные кристаллыВ темноте устойчив к
- 19. ДициклопентадиенилтитанЧрезвычайно легко окисляется кислородом воздухаС концентрированной соляной
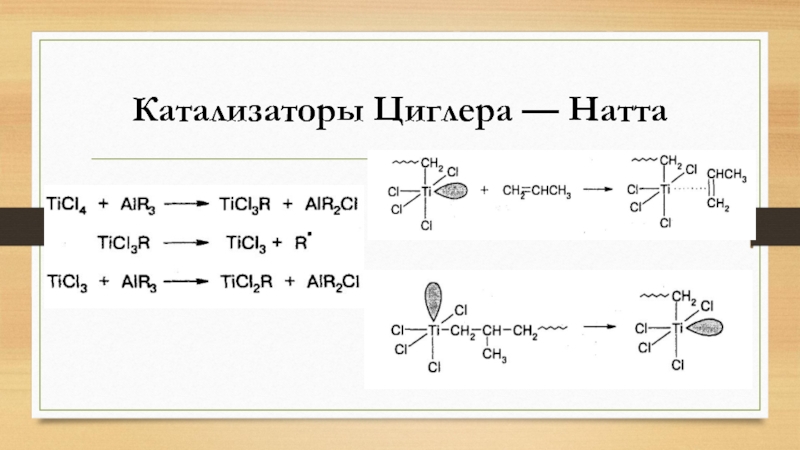
- 20. Катализаторы Циглера — Натта
- 21. Производные ортотитановой кислотыВ качестве производных ортотитановой кислоты
- 22. Получение в промышленностиВ промышленности получают при взаимодействии
- 23. Эфиры ортотитановой кислоты способны к реакции переэтерификации:Тетрахлорид
- 24. Химические свойстваГидролиз эфиров ортотитановой кислоты:Комплекс распадается на
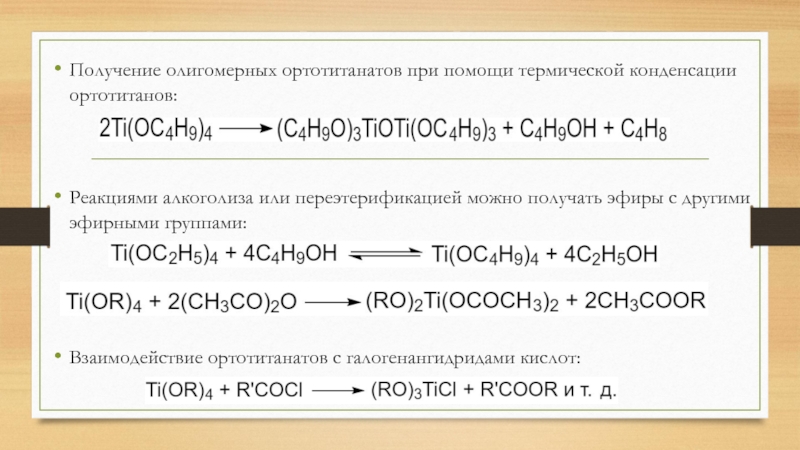
- 25. Получение олигомерных ортотитанатов при помощи термической конденсации
- 26. Реакции ортотитанатов с органическими кислотами или их
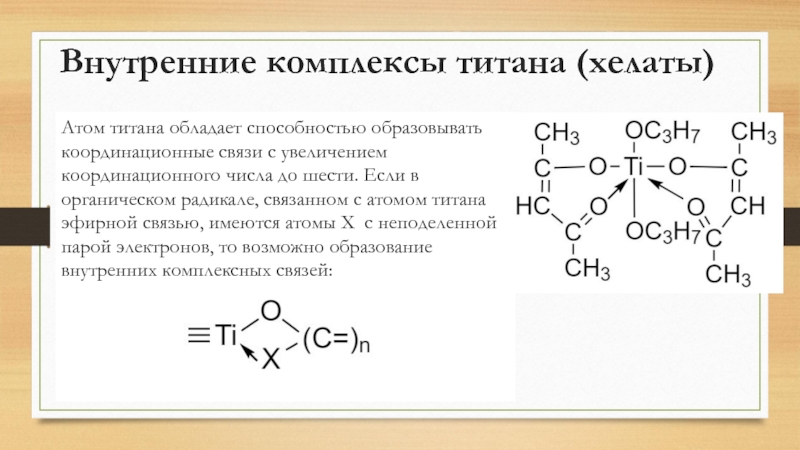
- 27. Внутренние комплексы титана (хелаты)Атом титана обладает способностью
- 28. Получение и химические свойстваАцетилацетон легко взаимодействует с ортоэфирами титана, образуя моно- и дизамещенные ацетилацетонатные производные:
- 29. Реакция между ацетилацетоном и тетрахлоридом титана дает
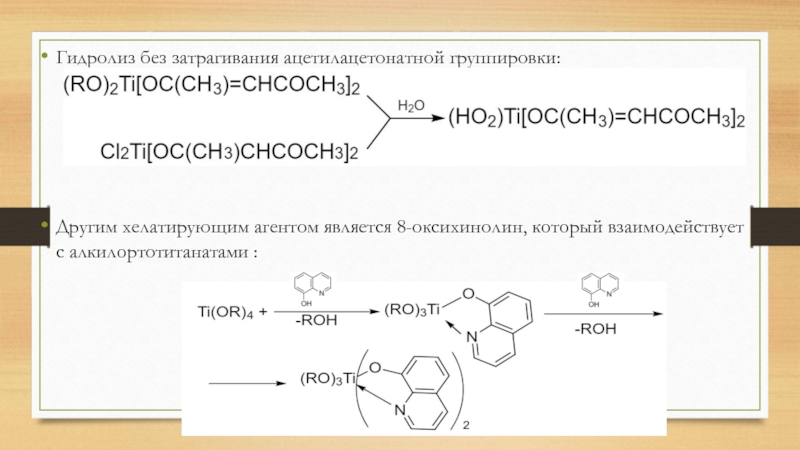
- 30. Гидролиз без затрагивания ацетилацетонатной группировки:Другим хелатирующим агентом является 8-оксихинолин, который взаимодействует с алкилортотитанатами :
- 31. ПрименениеЭфиры ортотитановой кислоты могут катализировать полимеризацию некоторых
- 32. Элементоорганические титансодержащие полимеры Полититаноорганооксаны В
- 33. При введении большего количества воды или при
- 34. Свойства полимерных титанорганических соединений:Высокая химическая устойчивостьТеплостойкостьХорошая адгезия к металлу и стеклу.
- 35. ПолититаноорганосилоксаныРеакция гетерофункциональной конденсацииПри соконденсации α,ω-диорганодигидроксисилоксанов с такими
- 36. Полученные тетрафункциональные крестообразные олигомеры имеют четыре равных
- 37. Полититаноорганосилоксаны спироциклического строенияГетерофункциональная соконденсация ди- и тетрафункциональных
- 38. При гетерофункциональной конденсации тетрагидрокситетрафенилциклотетрасилоксана с тетрабутоксититаном, взятых
- 39. Полититаноорганосилоксаны разветвленного строенияОсуществлена реакция между α,ω-дигидроксидиметилсилоксанами и
- 40. Применение полититанорганосилоксановПолититанорганосилоксаны применяются в качестве связующих для
- 41. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Химия титанорганических соединений
Москва 2019
Институт тонких химических технологий имени М.В. Ломоносова
Проект
выполнили
Слайд 2Чистый образец Ti получили голландцы А. ван Аркел и И.
де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Историческая справка
Г. Кролл в 1940
г. запатентовал простой магниетермический метод восстановления металлического титана из тетрахлоридаУильям Грегор
Мартин Генрих Клапрот
Открытие диоксида титана (TiO2) сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот.
Л. Воклен
Обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные оксиды титана.
Первый образец металлического титана получил в 1825 г. швед Й.Я. Берцелиус.
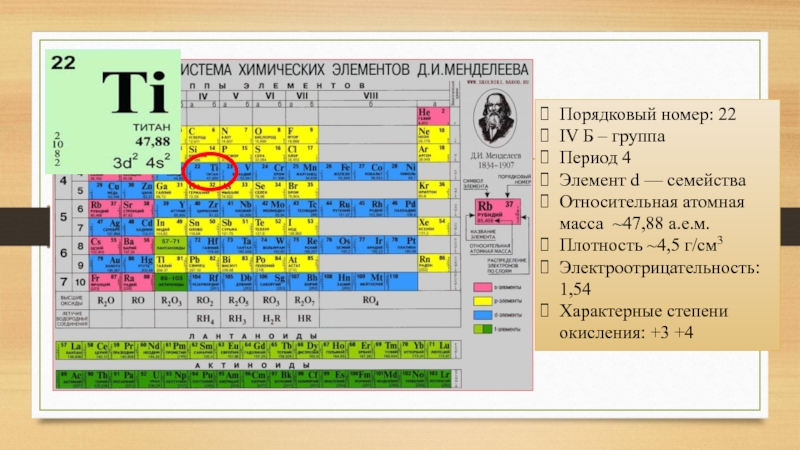
Слайд 3Порядковый номер: 22
IV Б – группа
Период 4
Элемент d — семейства
Относительная атомная
масса ~47,88 а.е.м.
Плотность ~4,5 г/см3
Электроотрицательность: 1,54
Характерные степени окисления: +3 +4
Слайд 5Физические свойства
Лёгкий прочный металл серебристо-белого цвета;
Существует в виде двух аллотропических модификаций:
ниже температуры 882,5 °С устойчива α-форма с гексагональной плотноупакованной решёткой,
а выше этой температуры — β-форма с кубической объёмно-центрированной решёткой;Tпл. = 1668 ºС, Ткип. = 3287 ºС;
Обладает высокой коррозионной стойкостью;
По сравнению с другими металлами обладает малой плотностью, высокой коррозионной стойкостью, пластичностью и прочностью.
Слайд 8Тi образует органические производные 2ух основных типов:
1-тип производных, в которых
атом титана непосредственно связан с углеродом обычной σ-связью или в
π-комплексах;2-тип производных, в которых атом титана связан с углеродом через атомы кислорода, азота и некоторых других элементов.
Слайд 9Алкилгалогениды титана(IV)
TiXnR4-n
R – метил, этил, бутил
X – Cl, Br,
I
Также могут быть алкильные производные лития, цинка, свинца и других
металловТемпература от 0 до -80 °С
Алифатические или ароматические растворители
Соотношением исходных компонентов регулируют степень замещения образующихся органотитанов
Слайд 10Метилтрихлорид титана
TiCl3(CH3)
темно-фиолетовые кристаллы
растворим в углеводородах и их галогенпроизводных
устойчив в отсутствии
влаги и воздуха при 20 °С
Слайд 11Этилтрихлорид титана
TiCl3(C2H5)
красноватая жидкость
распадающуюся за 24 ч при 20 °С
Пропилтрихлорид титана
TiCl3(С3Н7) и изобутилтрихлорид TiCl3(изо-С4Н9) образуются аналогично метилтрихлориду, но только при
более низкой температуре.Слайд 13Диметилдихлорид и диэтилдихлорид титана
ТiСl2(СН3)2
черно-фиолетовые кристаллы
растворимые в углеводородах (гексан)
растворы окрашены
в желтый цвет
ТiСl2(СН3)2
Слайд 15Тетраметилтитан
Ti(CH3)4
Блестящие желтые иглообразные кристаллы
Устойчив лишь при низких температурах
при температуре выше
0° С спонтанно разлагается
Слайд 16Тетраэтилтитан и тетрапропилтитан
Ti(C2H5)4
Ti(C3H7)4
оранжево-желтые кристаллы
чрезвычайно неустойчив
Слайд 18Диметилдициклопентадиенилтитан
Тi(С5Н5)2(СН3)2
Оранжевые иглообразные кристаллы
В темноте устойчив к действию кислорода и
воды
на свету быстро разлагается
Неустойчив к действию галогенов, даже к йоду
Слайд 19Дициклопентадиенилтитан
Чрезвычайно легко окисляется кислородом воздуха
С концентрированной соляной кислотой образует дициклопентадиенилдихлорид
титана
Труднорастворим в жидких алканах, циклоалканах и тетрагидрофуране
По свойствам дициклопентадиенилтитан сильно
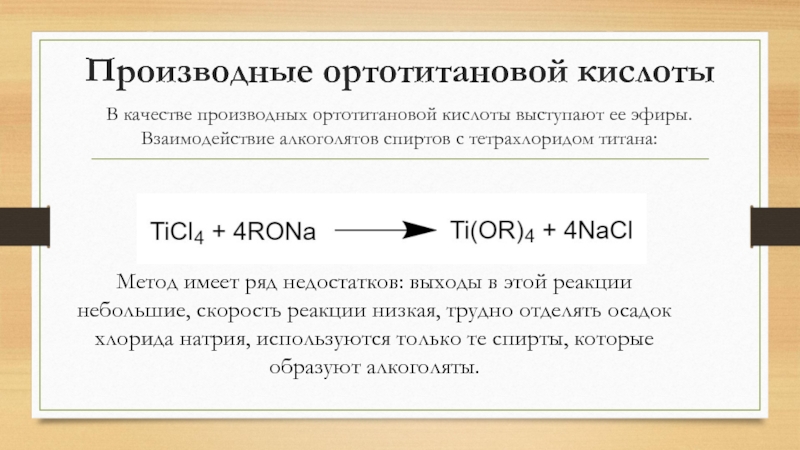
отличается от аналогичного ему ферроценаСлайд 21Производные ортотитановой кислоты
В качестве производных ортотитановой кислоты выступают ее эфиры.
Взаимодействие
алкоголятов спиртов с тетрахлоридом титана:
Метод имеет ряд недостатков: выходы в
этой реакции небольшие, скорость реакции низкая, трудно отделять осадок хлорида натрия, используются только те спирты, которые образуют алкоголяты.Слайд 22Получение в промышленности
В промышленности получают при взаимодействии тетрахлорида титана с
органическими спиртами в присутствии акцептора выделяющегося хлороводорода:
В качестве акцепторов предложено
использовать жидкий или газообразный аммиак, формамид или диметилформамид, пиридин.Слайд 23
Эфиры ортотитановой кислоты способны к реакции переэтерификации:
Тетрахлорид титана реагирует с
алкиленоксидами в среде органических растворителей:
Алкокси- и арилоксититанаты могут быть получены
взаимодействием сульфида титана со спиртом или фенолом:Обработка натрий- или калийтитангексафторида алкогалятами Mg, Ca, Al :
, где М=Mg, Ca; n=2 или М=Al; n=3
Слайд 24Химические свойства
Гидролиз эфиров ортотитановой кислоты:
Комплекс распадается на спирт и оксиэфир,
который выделить не удается, так как он немедленно конденсируется, образуя
титанооксановую связь:Слайд 25
Получение олигомерных ортотитанатов при помощи термической конденсации ортотитанов:
Реакциями алкоголиза или
переэтерификацией можно получать эфиры с другими эфирными группами:
Взаимодействие ортотитанатов с
галогенангидридами кислот:Слайд 26
Реакции ортотитанатов с органическими кислотами или их ангидридами приводят к
получению ацильных производных. Достаточно легко происходит образование моно- и диацилатов,
дальнейшее замещение осуществить трудно, так как образующиеся ацилаты неустойчивы и легко конденсируются с образованием титанооксановых связей:Слайд 27Внутренние комплексы титана (хелаты)
Атом титана обладает способностью образовывать координационные связи
с увеличением координационного числа до шести. Если в органическом радикале,
связанном с атомом титана эфирной связью, имеются атомы X с неподеленной парой электронов, то возможно образование внутренних комплексных связей:Слайд 28Получение и химические свойства
Ацетилацетон легко взаимодействует с ортоэфирами титана, образуя
моно- и дизамещенные ацетилацетонатные производные:
Слайд 29
Реакция между ацетилацетоном и тетрахлоридом титана дает трихлортитанацетилацетонат и дихлортитан-бис-(ацетилацетонат):
Эти
же соединения могут быть получены из натрийацетилацетона:
Слайд 30Гидролиз без затрагивания ацетилацетонатной группировки:
Другим хелатирующим агентом является 8-оксихинолин, который
взаимодействует с алкилортотитанатами :
Слайд 31Применение
Эфиры ортотитановой кислоты могут катализировать полимеризацию некоторых непредельных органических соединений,
а также реакции переэтерификации эфиров ортокремневой кислоты
Эфиры ортотитановой кислоты
используются в качестве отверждения полиэпоксидовПродукт частичного гидролиза бутилтитанат с наполнителями цинковой пылью и алюминиевой пудрой является термостойкой краской на рабочие температуры до 650 oC
Введение атомов титана в полимерные цепи, осуществляемое взаимодействием эфиров ортотитановой кислоты с олигосилоксанами с концевыми силанольными группами, позволяет получать полититаноорганосилоксаны, обладающие повышенной термостойкостью. Термостойкие полимеры были получены и на основе триметилсилоксипроизводных титана.
Слайд 32Элементоорганические титансодержащие полимеры
Полититаноорганооксаны
В качестве исходных продуктов для получения
титанорганических полимеров применяют соединения четырехвалентного титана. Например, если на н-бутилортотитанат
действовать водой в соотношении 1:1, то он переходит в линейный полимер (R=н-С4Н9):н-бутилортотитанат полититанорганооксан
Кислородная связь между атомами титана и углеводородными остатками придает полимерам этого типа высокую стабильность.
Слайд 33При введении большего количества воды или при нагреве продуктов реакции
происходит дальнейшее отщепление бутоксигрупп и поликонденсация протекает с образованием пространственного
полимераСлайд 34Свойства полимерных титанорганических соединений:
Высокая химическая устойчивость
Теплостойкость
Хорошая адгезия к металлу и
стеклу.
Слайд 35Полититаноорганосилоксаны
Реакция гетерофункциональной конденсации
При соконденсации α,ω-диорганодигидроксисилоксанов с такими тетрафункциональными соединениями, как
тетрахлориды или тетраалкоксиды кремния, титана, олова и т. д., в
мольном соотношении 4:1 могут быть получены олигомеры крестообразного строения:где Э = Si, Ti, Sn; X = —Cl, —OC2H5; R = —CH3; R' = —C6H5; n составляет от нескольких единиц до нескольких десятков.