Слайд 2Хром. Общая информация.
Положение в Периодической системе: VIB группа, 4-й
период
Электронная конфигурация: [Ar]4s13d5 (проскок электрона)
Типичный переходный металл
Основные степени окисления: +3
и +6, более редкие: +2, +4.
Происхождение названия: от греч. «хрома» – цвет (богатство окрасок соединений).
Слайд 3Хром. Применение
Твердые, прочные, химически стойкие сплавы (в т.ч. нержавеющая сталь)
Определение:
легирование – добавление к металлу/сплаву примесей, улучшающих его функциональные свойства.
Покрытия: инертные плёнки (Cr, Cr2O3), магнитные ленты (CrO2), абразивы.
Катализаторы полимеризации, дегидрирования, конверсии CO
(Cr2O3 и смешанные оксиды).
Конверсия CO (р-я сдвига водяного газа) : CO + H2O = H2 + CO2
Лазеры: Al2O3(корунд) с примесью Cr3+ (рубин, красный)
Слайд 4Хром. Получение
Хром - 21-й элемент по распространенности в земной коре
Основной
минерал: FeCr2O4 (хромит, хромистый железняк)
Основные добывающие страны: ЮАР, Казахстан, Индия,
Турция
Получение хрома:
1. 4FeCr2O4 + 8Na2CO3 + 7O2 →(t°C) 8Na2CrO4 + 2Fe2O3 + 8CO2↑
(окислительная щелочная плавка)
2. 2Na2CrO4 + H2SO4(р-р) → Na2Cr2O7 + Na2SO4 + H2O
3. Na2Cr2O7 + C →(t°C) Cr2O3 + Na2CO3 + CO↑
4. Cr2O3 + 2Al →(t°C) Al2O3 + 2Cr (алюмотермия)
Также: FeCr2O4 + 4С →(t°C) Fe + 2Cr (феррохром) + 4CO↑
Менее распространенный минерал: PbCrO4 (крокоит)
Слайд 5Хим. свойства Cr0
Находится левее водорода в ряду напряжений
2Cr + 6HCl(р-р)
→ 2CrCl3 (зеленая окраска) + 3H2
или
4Cr + 12HCl
+ 3O2 → 4CrCl3 + 6H2O
В отсутствие воздуха реакция идёт через образование CrCl2 (голубая окраска)
Cr + NaOH(р-р) → не идёт из-за пассивации
2Cr + 3H2O(пар) →(t°C) Cr2O3 + 3H2
Реакции с простыми веществами (примеры):
4Cr + 6O2 →(t°C) 2Cr2O3 2Cr + 3Cl2 →(t°C) 2CrCl3
2Cr + 3S →(t°C) Cr2S3. Cr2S3 может быть получен только в твердом виде!
Cr2(SO4)3 + 3Na2S + 6H2O → 2Cr(OH)3↓ + 3H2S↑ + 3Na2SO4 (полный гидролиз)
Слайд 6Хим. свойства Cr+3
Cr2O3 – амфотерный оксид, но очень инертный
С
растворами кислот, щелочей, конц.кислотами Cr2O3 не реагирует
Получение из него растворимых
соединений – только путем сплавления:
2Cr2O3 + 6NaHSO4 →(t°C) 2Cr2(SO4)3 + 3Na2SO4 + 3H2O
Cr2O3 + 2NaOH →(t°C) 2NaCrO2 + H2O
( NaCrO2 + 2H2O → Na[Cr(OH)4] (раствор) )
Получение хроматов:
Cr2O3 + 3KNO3 + 4KOH →(t°C) 2K2CrO4 + 3KNO2 + 2H2O↑
(окислительная щелочная плавка)
Слайд 7Хим. свойства Cr+3
Cr(OH)3 – амфотерный гидроксид. Серый или зеленый (из-за
непостоянства состава)
Осаждение:
CrCl3 (зеленый р-р) + 3NaOH(недост.) → Cr(OH)3↓ +
3NaCl
или
CrCl3 + 3NH3∙H2O → Cr(OH)3↓ + 3NH4Cl
Растворение:
Cr(OH)3 + NaOH(изб.) → Na[Cr(OH)4] (темно-зеленый р-р)
2Cr(OH)3 + 3H2SO4(р-р) → Cr2(SO4)3 + 6H2O (зеленый р-р)
Na[Cr(OH)4]
CrCl3
Cr(OH)3 в растворе NH3 не растворяется.
Слайд 8Хим. свойства Cr+6
H2Cr2O7, двухромовая кислота – сильная кислота. Её соли
– дихроматы(бихроматы)
H2CrO4, хромовая кислота – неустойчива в растворе. Её соли
– хроматы
2Na2CrO4 (желтый р-р) + H2SO4(р-р) → Na2Cr2O7 (оранжевый р-р) + Na2SO4 + H2O
Na2Cr2O7 (оранжевый р-р) + 2NaOH(р-р) → 2Na2CrO4 (желтый р-р)+ H2O
Na2CrO4
Na2Cr2O7
Получение CrO3:
Na2Cr2O7 + 2H2SO4(конц.) → 2CrO3↓(красный) + 2NaHSO4 + H2O
Слайд 9Хим. свойства Cr+6
Дихроматы – сильные окислители:
В кислой среде восстанавливается
до Cr3+ (зеленый р-р)
K2Cr2O7 + SO2 + H2SO4 →
Cr2(SO4)3 + K2SO4 + H2O
В нейтральной (или слабокислой) среде восстанавливается до Cr(OH)3
K2Cr2O7 + H2S → Cr(OH)3↓ + S↓ + K2S + H2O
В щелочной среде восстанавливается до [Cr(OH)4]- (темно-зеленый р-р-)
K2Cr2O7 + K[Sn(OH)3] + KOH + H2O → K[Cr(OH)4] + K2[Sn(OH)6]
Дихроматы окисляют спирты, альдегиды, алкены, алкины и т.п.:
K2Cr2O7 + C2H5OH + H2SO4 → CH3COOH + …
Задание для самостоятельного выполнения:
Уравнять реакции методом электронного баланса или полуреакциями!
Слайд 10«Химический вулкан»
(NH4)2Cr2O7 →(t°C) Cr2O3 + N2↑ + 4H2O↑
http://school-collection.edu.ru/catalog/rubr/eb17b17a-6bcc-01ab-0e3a-a1cd26d56d67/23571/
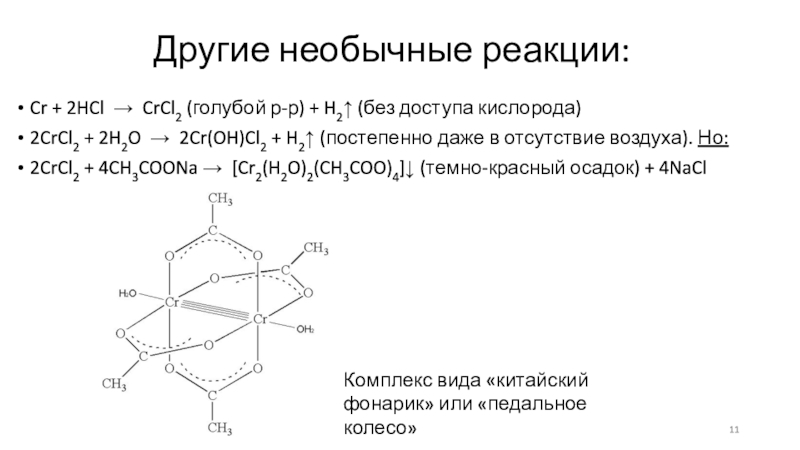
Слайд 11Другие необычные реакции:
Cr + 2HCl → CrCl2 (голубой р-р)
+ H2↑ (без доступа кислорода)
2CrCl2 + 2H2O → 2Cr(OH)Cl2 +
H2↑ (постепенно даже в отсутствие воздуха). Но:
2CrCl2 + 4CH3COONa → [Cr2(H2O)2(CH3COO)4]↓ (темно-красный осадок) + 4NaCl
Комплекс вида «китайский фонарик» или «педальное колесо»
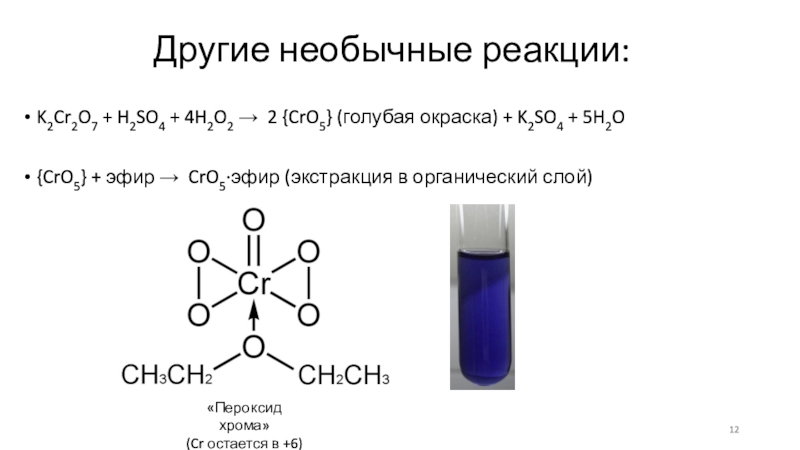
Слайд 12Другие необычные реакции:
K2Cr2O7 + H2SO4 + 4H2O2 → 2
{CrO5} (голубая окраска) + K2SO4 + 5H2O
{CrO5} + эфир →
CrO5∙эфир (экстракция в органический слой)
«Пероксид хрома»
(Cr остается в +6)
Слайд 13Марганец. Общая информация.
Положение в Периодической системе: VIIB группа, 4-й
период
Электронная конфигурация: [Ar]4s23d5
Основные степени окисления: +2, +4, +6, +7.
Происхождение
названия: неясно. По одной из версий, от «Магнисия» - названия греческой провинции, где с древности обнаруживали марганцевую руду (MnO2, ныне пиролюзит).
Слайд 14Марганец. Применение
Легирование стали (износостойкие стали, ферромарганец)
Легирование алюминия (алюминиевые банки, кровельные
листы и т.п.)
Окислители и катализаторы окисления в органической химии
(MnO2, смешанные оксиды, KMnO4), в т.ч. и в промышленных процессах.
Литий-марганцевые аккумуляторы (большая мощность тока и стабильность)
Слайд 15Марганец. Получение
15-й элемент по распространенности в земной коре
Основной минерал: MnO2
(пиролюзит)
Основные добывающие страны: ЮАР, Австралия, Китай
Получение марганца:
MnO2 + 2C
→(t°C) Mn + 2CO («дешевый» способ)
3MnO2 + 4Al →(t°C) 2Al2O3 + 3Mn (алюмотермия, «дорогой» способ)
Другие минералы: Mn3O4 (гаусманит), MnCO3 (родохрозит), MnO(OH) (манганит) и т.д.
Марганец является значительной примесью в железных рудах. Ферромарганец (сплав Fe с Mn) получают напрямую из железо-марганцевых руд
Слайд 16Хим. свойства Mn0
Находится левее водорода в ряду напряжений
Mn + 2HCl(р-р)
→ MnCl2 + H2↑
Mn + NaOH(р-р) → не идёт
(Mn не амфотерен)
Чистый Mn медленно подвергается коррозии в воде:
Mn + 2H2O → Mn(OH)2 + H2↑
Mn + 2H2SO4(конц.) → MnSO4 + SO2↑ + 2H2O (пассивация нехарактерна)
Взаимодействие с простыми веществами:
3Mn + 2O2 →(t°C) Mn3O4 (смешанновалентный оксид)
Mn + Cl2 →(t°C) MnCl2
Mn + S →(t°C) MnS
Слайд 17Хим. свойства Mn+2
Mn(OH)2 – основный гидроксид, но в воде нерастворим
С растворами кислот реагирует, с р-рами щелочей – нет.
Mn(OH)2
+ 2HCl → MnCl2 + 2H2O
Mn(OH)2 + NaOH(изб.) → не идёт
Осаждение Mn(OH)2 :
MnCl2 + 2NaOH(изб.) → Mn(OH)2↓ + 2NaCl
MnCl2 + 2NH3∙H2O(изб.) → Mn(OH)2↓ + 2NH4Cl
Но! Mn(OH)2 быстро окисляется на воздухе:
2Mn(OH)2 (бесцв.) + O2 → 2MnO2 (коричневый) + 2H2O
Окисление
Mn(OH)2
Mn(OH)2 в растворе NH3 не растворяется
Слайд 18Хим. свойства Mn+2
Осадки с катионом Mn2+:
1. MnCl2 + (NH4)2S
→ MnS↓ (розовый, «телесный») + 2NH4Cl
Сульфид марганца(II) растворяется в сильнокислой
среде:
MnS + 2HCl(20% р-р) → MnCl2 + H2S↑
2. MnCl2 + 2NaHCO3 → MnCO3↓ (розовый) + 2NaCl + CO2↑ + H2O
При использовании средних карбонатов образуются оснОвные соли:
2MnCl2 + 3Na2CO3 + 2H2O → Mn(OH)2∙MnCO3↓ + 2NaHCO3 + 4NaCl
(частичный гидролиз)
Окисление до Mn+7 сильными окислителями:
2MnSO4 + 5O3 + 3H2O → 2HMnO4 (фиолетовый р-р) + 2H2SO4 + 5O2
MnS
Слайд 19Хим. свойства Mn+4
MnO2 в щелочах не растворяется, с кислотами реагирует
как окислитель. Сильный окислитель!
MnO2 + 4HCl(конц.) → MnCl2 +
Cl2↑ + H2O
2MnO2 + 4HNO3(конц.) → 2Mn(NO3)2 + 2H2O + O2↑ (!!!)
MnO2 является источником и для получения KMnO4:
MnO2 + KNO3 + K2CO3 →(t°C) K2MnO4 + KNO2 + CO2
(окислительная щелочная плавка!) Затем:
2K2MnO4 + Cl2 → 2KMnO4 + 2KCl (в щелочной среде)
или
2K2MnO4 + 2H2O →(электролиз) 2KMnO4 + H2↑ + 2KOH
Слайд 20Хим. свойства Mn+7
HMnO4 – сильная кислота. Растворы фиолетовые (как и
у ее солей).
Её соли – перманганаты. Сильный окислитель!
В кислой
среде перманганат восстанавливается до Mn2+
2KMnO4 + 10KI + 8H2SO4 → 2MnSO4 (бесцветный р-р) + 5I2↓ + 6K2SO4 + 8H2O
В нейтральной среде перманганат восстанавливается до MnO2
2KMnO4 + 3CH2=CH2 + 4H2O → 2MnO2↓ (бурый осадок) + 3HOCH2-CH2OH + 2KOH
В щелочной среде перманганат восстанавливается до MnO42- (до манганата)
2KMnO4 + 2KOH + K2SO3 → 2K2MnO4 (темно-зеленый р-р) + K2SO4 + H2O
растворы KMnO4
Слайд 21Хим. свойства Mn+7
Получение кислорода:
2KMnO4 (тв.) →(t°C) K2MnO4 + MnO2
+ O2↑
K2MnO4 устойчив только в твердом виде или в щелочной
среде,
кислота H2MnO4 не существует:
3K2MnO4 + 2H2O → 2KMnO4↓ + MnO2↓ + 4KOH (разбавление раствора)
Получение Cl2:
2KMnO4 + 16HCl(конц.) → 2MnCl2 + 5Cl2↑ + 2KCl + 8H2O
Получение Mn2O7:
2KMnO4 + 2H2SO4(конц.) → Mn2O7 (темно-зеленая жидкость) + 2KHSO4 + H2O
Слайд 22«Гейзер»
2KMnO4 + 3H2O2 → 2MnO2 + 3O2↑ + 2KOH +
2H2O

![Хром, марганец Хром. Общая информация. Положение в Периодической системе: VIB группа, 4-й периодЭлектронная Хром. Общая информация. Положение в Периодической системе: VIB группа, 4-й периодЭлектронная конфигурация: [Ar]4s13d5 (проскок электрона)Типичный переходный металлОсновные](/img/tmb/7/616962/cd633861d1029d4883a4272489222b80-800x.jpg)








![Хром, марганец Марганец. Общая информация. Положение в Периодической системе: VIIB группа, 4-й периодЭлектронная Марганец. Общая информация. Положение в Периодической системе: VIIB группа, 4-й периодЭлектронная конфигурация: [Ar]4s23d5Основные степени окисления: +2, +4,](/img/tmb/7/616962/53b6cf185dd68cd025b5d97efc4e34a9-800x.jpg)