Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям
Содержание
- 1. Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям
- 2. ПодлинностьОбщие реакции подлинностиСравнительная характеристика химических свойств солей
- 3. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором натрия
- 4. Висмута ионРеакция осаждения с раствором натрия гидроксида белый осадок висмута гидроксида
- 5. Висмута ионПрибавление избытка реактива к осадку висмута гидроксидаизб. NaOH
- 6. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором натрия
- 7. Цинка ионРеакция осаждения с раствором натрия гидроксидабелый студенистый осадок
- 8. Цинка ионРастворение цинка гидроксида в избытке натрия гидроксидаизб.NaOH
- 9. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором натрия
- 10. голубой осадок меди(II)гидроксидаМеди(II) ионРеакция осаждения с раствором натрия гидроксида
- 11. изб. NaOHМеди(II) ионРастворение осадка меди(II) гидроксида в избытке натрия гидроксида
- 12. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором натрия
- 13. темно-коричневый осадок смеси железа(II) и железа(III) гидроксидаЖелеза ионРеакция осаждения с раствором натрия гидроксида
- 14. Темно-коричневый осадок (смесь железа(II) и железа(III) гидроксида) нерастворим в избытке реактиваизб.NaOH
- 15. Сравнительная характеристикаРеакция осаждения с раствором натрия гидроксидаСоединения висмута, цинка,меди и железарастворимв избыткереактиварастворимв избыткереактива
- 16. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором аммония
- 17. Висмута ионРеакция осаждения с раствором аммония гидроксида
- 18. изб. NH4OHВисмута ионПрибавление избытка раствора аммиака к осадку висмута гидроксида
- 19. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором аммония
- 20. Цинка ионРеакция осаждения с раствором аммония гидроксидабелый студенистый осадок цинка гидроксида
- 21. Цинка ионРастворение осадка цинка гидроксида в избытке раствора аммиакаизб. NH4OH
- 22. Соединения висмута, цинка,меди и железаОбщие реакции подлинностиРеакция
- 23. голубой осадок меди(II)дигидроксо-сульфатаМеди(II) ионРеакция осаждения с раствором аммония гидроксида
- 24. Меди(II) ионРастворение осадка меди(II) дигидроксосульфата в избытке аммония гидроксидаизб. NH4OH
- 25. Подлинность Общие реакции подлинностиРеакция осаждения с раствором
- 26. Железа(II) ионРеакция осаждения с раствором аммония гидроксидаизб. NH4OH
- 27. Сравнительная характеристикаРеакция осаждения с раствором аммония гидроксидаСоединения висмута, цинка,меди и железарастворимв избыткереактиварастворимв избыткереактива
- 28. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором натрия
- 29. Коричневато-черный осадок висмутасульфидаВисмута ион Реакция осаждения с раствором натрия сульфида
- 30. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором натрия
- 31. Цинка ионРеакция осаждения с раствором натрия сульфида
- 32. Подлинность Общие реакции подлинностиМеди(II) ионРеакция осаждения с
- 33. Черный осадокмеди(II) сульфидаМеди(II) ионРеакция осаждения с раствором натрия сульфида
- 34. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором натрия
- 35. Черный осадок железа(II) сульфидаЖелеза(II) ионРеакция осаждения с раствором натрия сульфида
- 36. Сравнительная характеристикаРеакция осаждения с раствором натрия сульфидаСоединения висмута, цинка, меди и железа
- 37. ПодлинностьОбщие реакции подлинностиРеакция осаждения с раствором калия
- 38. Слайд 38
- 39. черный осадок висмута йодидаоранжевый раствор калия тетрайодо-висмутатаизб. KI Висмута ионРеакция осаждения с раствором калия йодида
- 40. ПодлинностьОбщие реакции подлинностиРеакция с раствором калия йодидаМеди(II)
- 41. Меди(II) ион Реакция осаждения с раствором калия йодида+ KI (изб.)
- 42. Сравнительная характеристикаРеакция осаждения и комплексообразования с раствором калия йодидаСоединения висмута, цинка,меди и железа
- 43. ПодлинностьОбщие реакции подлинностиРеакция с раствором калия йодидаЦинка
- 44. ПодлинностьОбщие реакции подлинностиРеакция с раствором калия йодидаЖелеза(II)
- 45. ПодлинностьСпецифические реакции подлинностиРеакция осаждения с раствором натрия
- 46. Коричневато-черный осадок висмутасульфидаВисмута ион Реакция осаждения с раствором натрия сульфида
- 47. Висмута ион Реакция осаждения с раствором натрия сульфидаРастворение осадка висмута сульфида в азотной кислоте концентрированнойконц. HNO3
- 48. ПодлинностьСпецифические реакции подлинности Висмута нитрат основнойДоказательство нитрат
- 49. ПодлинностьСпецифические реакции подлинностиВисмута нитрат основнойДоказательство нитрат ионаСоединения висмута, цинка,меди и железасинее окрашивание
- 50. ПодлинностьСпецифические реакции подлинностиРеакция осаждения с раствором натрия
- 51. Цинка ионРеакция осаждения с раствором натрия сульфида
- 52. + CH3COOH разв.+ HCl разв.Цинка ионРастворимость осадка
- 53. ПодлинностьСпецифические реакции подлинностиРеакция осаждения с раствором калия
- 54. Картинка Цинка ионРеакция осаждения с раствором калия гексацианоферрата(II)
- 55. + HCl разв.Цинка ионРеакция осаждения с раствором калия гексацианоферрата(II)Осадок нерастворим в хлористоводородной кислоте разведенной
- 56. ПодлинностьСпецифические реакции подлинностиМеди(II) ион Реакция восстановления меди(II)
- 57. красный налет меди на железном гвоздеМеди(II) ион Реакция восстановления меди(II) до меди
- 58. Меди(II) ионРеакция восстановления меди(II) до медиСоединения висмута, цинка,меди и железа
- 59. ПодлинностьСпецифические реакции подлинности Железа(II) ионРеакция комплексообразования с
- 60. Железа(II) ионРеакция комплексообразования с раствором калия гексацианоферрата(III)
- 61. ПодлинностьСпецифические реакции подлинностиРеакция осаждения с раствором аммония
- 62. ПодлинностьРеакция на меди(II) ион Методика. К 1 мл
- 63. Раствор меди сульфата 5%-50,0 мл Реакция на меди(II) ионголубой осадок меди(II)дигидроксо-сульфата
- 64. Раствор меди сульфата 5%-50,0 мл Реакция на
- 65. Подлинность Реакция на сульфат ион Методика.
- 66. Вставить картинку реакцииРаствор меди сульфата 5%-50,0 мл Реакция на сульфат ион
- 67. Осадок бария сульфата нерастворим в разведенных минеральных
- 68. Количественное определениеКосвенный йодометрический метод(прямое титрование)Титрант: 0,1М раствор
- 69. Количественное определениеКосвенный йодометрический метод(прямое титрование) 5 мл
- 70. Отмерива- ют пипеткой навеску препарата
- 71. Прибавляют воду очищенную
- 72. Прибавляют серную кислоту разведенную
- 73. Прибавляют раствор калия йодида
- 74. Окраска раствора до начала титрования
- 75. Выделившийся йод титруют раствором натрия тиосульфата до светло-желтого окрашивания (за 1 мл до точки эквивалентности)
- 76. Окраска раствора за 1 мл до точки эквивалентности
- 77. Прибавляют индикатор крахмал
- 78. Окраска раствора после добавления индикатора
- 79. Продолжают титровать раствором натрия тиосульфата до исчезновения фиолетовой окраски раствора
- 80. Окраска раствора в конце титрования
- 81. Список литературы Беликов, В.Г. Фармацевтическая химия
- 82. Иллюстрированные методики подготовили: Саттарова Ольга Евгеньевна, доцент
- 83. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1 Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям по
фармацевтической химии для студентов 3 курса
железаСлайд 2Подлинность
Общие реакции подлинности
Сравнительная характеристика химических свойств солей цинка, меди(II), железа(II),
висмута
Приготовление растворов субстанций лекарственных средств
Около 0,05-0,1 г цинка сульфата,
меди сульфата, железа сульфата растворяют в 5 мл воды. Около 0,05-0,1 г висмута нитрата основного растворяют в 1-2 мл азотной кислоты разведенной 16% и добавляют воду до общего объема 5 мл. Для проведения реакций берут по 1 мл раствора субстанции каждого лекарственного средства.Соединения висмута, цинка,
меди и железа
Слайд 3Подлинность
Общие реакции подлинности
Реакция осаждения с раствором натрия гидроксида
Висмута ион
Методика.
К 1 мл раствора соли висмута прибавляют по каплям 10%
раствор натрия гидроксида; образуется белый осадок висмута гидроксида, нерастворимый в избытке реактива.Соединения висмута, цинка,
меди и железа
Слайд 6Подлинность
Общие реакции подлинности
Реакция осаждения с раствором натрия гидроксида
Цинка ион
Методика.
К 1 мл раствора соли цинка прибавляют 1-2 капли 10%
раствора натрия гидроксида; образуется белый студенистый осадок, растворимый в избытке реактива.Соединения висмута, цинка,
меди и железа
избыток
Бесцветный прозрачный раствор
Слайд 9Подлинность
Общие реакции подлинности
Реакция осаждения с раствором натрия гидроксида
Меди(II)
ион
Методика. К 1 мл раствора соли меди(II) прибавляют 1-2 капли
10% раствора натрия гидроксида; образуется голубой осадок, растворимый в избытке реактива. Полученный раствор имеет синее окрашивание.Соединения висмута, цинка,
меди и железа
избыток
синий раствор
Слайд 10голубой осадок меди(II)
гидроксида
Меди(II) ион
Реакция осаждения с раствором натрия гидроксида
Слайд 12Подлинность
Общие реакции подлинности
Реакция осаждения с раствором натрия гидроксида Железа(II) ион
Методика.
К 1 мл раствора соли железа(II) прибавляют 2-3 капли 10%
раствора натрия гидроксида. Образуется серо-зеленый осадок железа(II) гидроксида, переходящий в темно-коричневый осадок железа(III) гидроксида. При добавлении избытка раствора натрия гидроксидаосадок не растворяется.
Соединения висмута, цинка,
меди и железа
Слайд 13темно-коричневый осадок смеси железа(II) и железа(III) гидроксида
Железа ион
Реакция осаждения с
раствором натрия гидроксида
Слайд 14Темно-коричневый осадок
(смесь железа(II) и железа(III) гидроксида) нерастворим в избытке
реактива
изб.NaOH
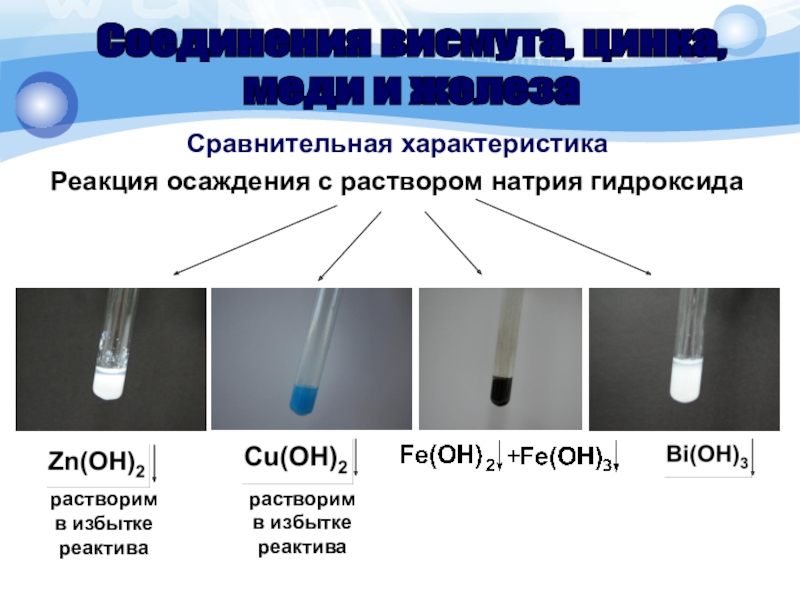
Слайд 15Сравнительная характеристика
Реакция осаждения с раствором натрия гидроксида
Соединения висмута, цинка,
меди и
железа
растворим
в избытке
реактива
растворим
в избытке
реактива
Слайд 16Подлинность
Общие реакции подлинности
Реакция осаждения с раствором аммония гидроксида
Висмута ион
Методика.
К 1 мл раствора соли висмута по каплям прибавляют 10%
раствор аммиака; образуется белый осадок висмута гидроксида, нерастворимый в избытке реактива.Bi3+ + 3NH4OH → Bi(OH)3↓ + 3NH4+
Соединения висмута, цинка,
меди и железа
Слайд 19Подлинность
Общие реакции подлинности
Реакция осаждения с раствором аммония гидроксида
Цинка ион
Методика. К
1 мл раствора соли цинка прибавляют 1-2 капли 10% раствора
аммиака; образуется белый студенистый осадок, растворимый в избытке реактива.Соединения висмута, цинка,
меди и железа
избыток
Бесцветный прозрачный раствор
Слайд 20Цинка ион
Реакция осаждения с раствором аммония гидроксида
белый студенистый осадок цинка
гидроксида
Слайд 22Соединения висмута, цинка,
меди и железа
Общие реакции подлинности
Реакция образования осадка с
раствором аммония гидроксида
Меди(II) ион
Методика. К 1 мл соли меди(II)
прибавляют 1-2 капли10% раствора аммиака; образуется голубой осадок, растворимый в избытке реактива. Полученныйраствор имеет темно-синее окрашивание.
2CuSO4 + 2NH4OH → Cu2(OH)2SO4↓ + (NH4)2SO4
Cu2(OH)2SO4↓+ 6NH4OH + (NH4)2SO4 → 2[Cu(NH3)4]SO4 + 8H2O
избыток темно-синий раствор
Слайд 23голубой осадок меди(II)
дигидроксо-сульфата
Меди(II) ион
Реакция осаждения с раствором аммония гидроксида
Слайд 24Меди(II) ион
Растворение осадка меди(II) дигидроксосульфата в избытке аммония гидроксида
изб. NH4OH
Слайд 25Подлинность
Общие реакции подлинности
Реакция осаждения с раствором аммония гидроксида
Железа(II) ион
Соединения
висмута, цинка,
меди и железа
Методика. К 1 мл раствора соли железа(II)
прибавляют 2-3 капли 10% раствора аммиака. Образуется белый в момент получения осадок железа(II) гидроксида, который быстро окисляется до красновато-коричневого осадка железа(III) гидроксида.Слайд 27Сравнительная характеристика
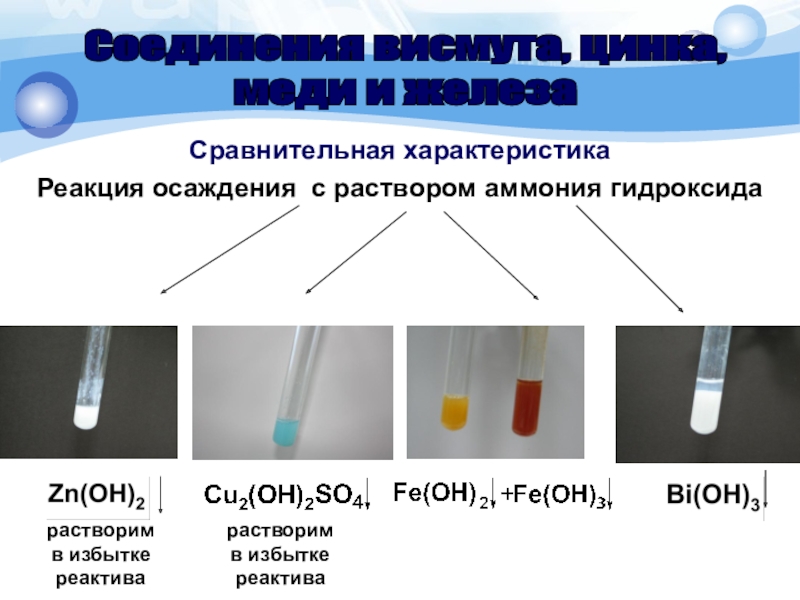
Реакция осаждения с раствором аммония гидроксида
Соединения висмута, цинка,
меди и
железа
растворим
в избытке
реактива
растворим
в избытке
реактива
Слайд 28Подлинность
Общие реакции подлинности
Реакция осаждения с раствором натрия сульфида
Висмута ион
К 1
мл раствора соли висмута прибавляют по каплям 2% раствор натрия
сульфида; образуется коричневато-черный осадок висмута сульфида, нерастворимый в избытке реактива.2Bi3+ + 3Na2S → Bi2S3↓ + 6Na+
Соединения висмута, цинка,
меди и железа
Слайд 29Коричневато-
черный осадок висмута
сульфида
Висмута ион
Реакция осаждения с раствором натрия сульфида
Слайд 30Подлинность
Общие реакции подлинности
Реакция осаждения с раствором натрия сульфида
Цинка ион
Методика. К
1 мл раствора соли цинка прибавляют по каплям 2% раствор
натрия сульфида; образуется белый осадок цинка сульфида, нерастворимый в избытке реактива.ZnSO4 + Na2S → ZnS↓ + Na2SO4
Соединения висмута, цинка,
меди и железа
белый
осадок
Слайд 32Подлинность
Общие реакции подлинности
Меди(II) ион
Реакция осаждения с раствором натрия сульфида
Методика.
К 1 мл раствора соли меди(II) прибавляют по каплям 2%
раствор натрия сульфида. Образуется осадок меди(II) сульфида черного цвета, нерастворимый в избытке реактива.Соединения висмута, цинка,
меди и железа
СuSO4 + Na2S → CuS↓ + Na2SO4
Слайд 34Подлинность
Общие реакции подлинности
Реакция осаждения с раствором натрия сульфида
Железа(II) ион
Соединения висмута,
цинка,
меди и железа
Методика. К 1 мл раствора соли железа(II) прибавляют
по каплям 2% раствор натрия сульфида. Образуется осадок черного цвета, состоящий из смеси железа(II) сульфида и железа(III) сульфида, нерастворимый в избытке реактива.FeSO4 + Na2S FeS + Na2SO4
Слайд 35Черный осадок железа(II) сульфида
Железа(II) ион
Реакция осаждения с раствором натрия сульфида
Слайд 36Сравнительная характеристика
Реакция осаждения с раствором натрия сульфида
Соединения висмута, цинка,
меди
и железа
Слайд 37Подлинность
Общие реакции подлинности
Реакция осаждения с раствором калия йодида
Висмута ион
Методика.
К 1 мл раствора соли висмута прибавляют 1-2 капли 10%
раствора калия йодида; образуется черный осадок висмута йодида, растворимый в избытке реактива с образованием раствора желтовато-оранжевого цвета.Bi(NO3)3 + 3KI → BiI3↓ + 3KNO3
BiI3 + KI → KBiI4
изб. желто-оранжевое
окрашивание
Соединения висмута, цинка,
меди и железа
Слайд 39черный осадок висмута йодида
оранжевый раствор калия тетрайодо-висмутата
изб. KI
Висмута ион
Реакция
осаждения с раствором калия йодида
Слайд 40Подлинность
Общие реакции подлинности
Реакция с раствором калия йодида
Меди(II) ион
Методика. К 1
мл раствора соли меди(II) прибавляют 1-2 капли 10% раствора калия
йодида. Образуется осадок меди(II) йодида белого цвета. При дальнейшем добавлении реактива образуется осадок меди(I) йодида, выделяется йод; реакционная смесь окрашивается в красно-бурый цвет.Соединения висмута, цинка,
меди и железа
2CuSO4 + 4KI 2CuI2 + 2K2SO4
2CuI2 2CuI + I2
______________________________________________________
2CuSO4 + 4KI 2CuI + I2 +2K2SO4
Слайд 42Сравнительная характеристика
Реакция осаждения и комплексообразования с раствором калия йодида
Соединения висмута,
цинка,
меди и железа
Слайд 43Подлинность
Общие реакции подлинности
Реакция с раствором калия йодида
Цинка ион
Соединения висмута, цинка,
меди
и железа
При добавлении к 1 мл
раствора соли цинка
1-2 капель
10% раствора калия йодида раствор
остается прозрачным,
осадок не образуется,
т.к. цинка йодид
растворим в воде.
Слайд 44Подлинность
Общие реакции подлинности
Реакция с раствором калия йодида
Железа(II) ион
Соединения висмута, цинка,
меди
и железа
При добавлении к 1 мл раствора соли железа(II) 1-2
капель 10% раствора калия йодида раствор остается прозрачным, осадок не образуется, т.к. железа(II) йодид растворим в воде. Слайд 45Подлинность
Специфические реакции подлинности
Реакция осаждения с раствором натрия сульфида
Висмута ион
Соль висмута
(около 0,05 г иона висмута) взбалтывают с 3 мл хлористоводородной
кислоты разведенной 8,3% и фильтруют. К фильтрату прибавляют 1 мл 2% раствора натрия сульфида; образуется коричневато-черный осадок, растворимый при прибавлении равного объема азотной кислоты концентрированной.Соединения висмута, цинка,
меди и железа
Слайд 46
Коричневато-
черный осадок висмута
сульфида
Висмута ион
Реакция осаждения с раствором натрия сульфида
Слайд 47Висмута ион
Реакция осаждения с раствором натрия сульфида
Растворение осадка висмута
сульфида в азотной кислоте концентрированной
конц. HNO3
Слайд 48Подлинность
Специфические реакции подлинности
Висмута нитрат основной
Доказательство нитрат иона
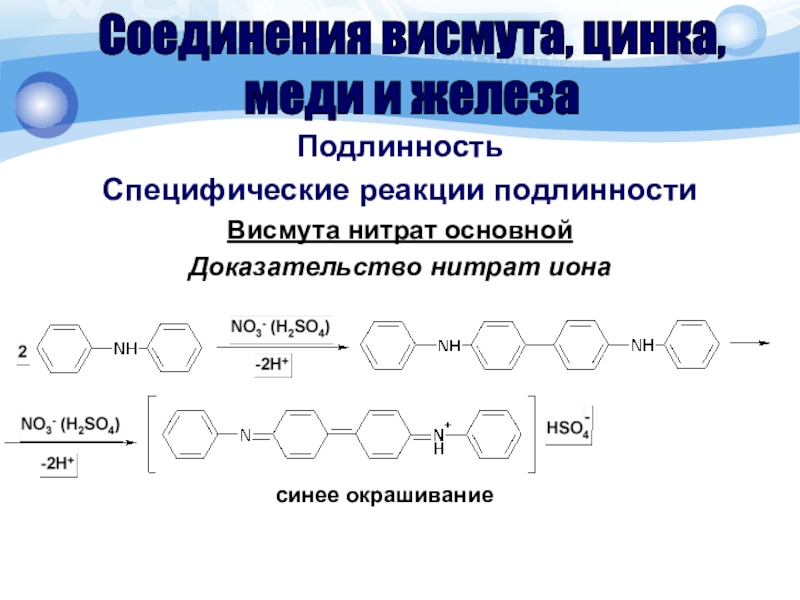
К субстанции (около
0,001 г иона нитрата), помещенной на фарфоровую чашку, прибавляют 2
капли раствора дифениламина; появляется синее окрашивание.Соединения висмута, цинка,
меди и железа
Слайд 49Подлинность
Специфические реакции подлинности
Висмута нитрат основной
Доказательство нитрат иона
Соединения висмута, цинка,
меди и
железа
синее окрашивание
Слайд 50Подлинность
Специфические реакции подлинности
Реакция осаждения с раствором натрия сульфида
Цинка ион
К 2
мл нейтрального раствора соли цинка (0,005-0,02 г иона цинка) прибавляют
0,5 мл 2% раствора натрия сульфида или сероводорода; образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30% и легко растворимый в хлористоводородной кислоте разведенной 8,3%.ZnSO4 + Na2S → ZnS↓ + Na2SO4
Соединения висмута, цинка,
меди и железа
Слайд 52+ CH3COOH разв.
+ HCl разв.
Цинка ион
Растворимость осадка цинка сульфида
Осадок
нерастворим
в уксусной кислоте разведенной
Осадок легко растворим в хлористо-водородной кислоте разведенной
Слайд 53Подлинность
Специфические реакции подлинности
Реакция осаждения с раствором калия гексацианоферрата(II)
Цинка ион
Методика. К
2 мл раствора соли цинка (0,005-0,02 г иона цинка) прибавляют
0,5 мл 5% раствора калия гексацианоферрата(II); образуется белый осадок, нерастворимый в хлористоводородной кислоте разведенной 8,3%.Соединения висмута, цинка,
меди и железа
2ZnSO4 + 2K4[Fe(CN)6] K2Zn3[Fe(CN)6]2 + 3K2SO4
Слайд 55+ HCl разв.
Цинка ион
Реакция осаждения с раствором калия гексацианоферрата(II)
Осадок нерастворим
в хлористоводородной кислоте разведенной
Слайд 56Подлинность
Специфические реакции подлинности
Меди(II) ион
Реакция восстановления меди(II) до меди
Методика. Раствор
соли меди (1:20) при соприкосновении с железом покрывает его красным
налётомметаллической меди.
CuSO4 + Fe → Cu↓ + FeSO4
Соединения висмута, цинка,
меди и железа
Слайд 59Подлинность
Специфические реакции подлинности
Железа(II) ион
Реакция комплексообразования с раствором калия гексацианоферрата(III)
Методика. К 2 мл раствора соли железа(II) (около 0,02 г
иона железа) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3% и 1 мл 5% раствора калия гексацианоферрата(III); образуется синий осадок.3FeSO4 + 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓ + 3K2SO4
Соединения висмута, цинка,
меди и железа
синий осадок
Слайд 61Подлинность
Специфические реакции подлинности
Реакция осаждения с раствором аммония сульфида
Железа(II) ион
Соединения висмута,
цинка,
меди и железа
Методика. К раствору соли железа(II) (около 0,02 г
иона железа) прибавляют 5% раствор аммония сульфида; образуется черный осадок железа(II) сульфида, растворимый в разведенных минеральных кислотах.FeSO4 + (NH4)2S → FeS↓ + (NH4)2SO4
черный осадок
Слайд 62Подлинность
Реакция на меди(II) ион
Методика. К 1 мл препарата прибавляют по
каплям 10% раствор аммония гидроксида; образуется голубой осадок, растворимый в
избытке реактива. Полученный раствор имеет синее окрашивание.Раствор меди сульфата 5%-50мл
2CuSO4 + 2NH4OH Cu2(OH)2SO4 + (NH4)2SO4
Cu2(OH)2SO4↓ + 6NH4OH + (NH4)2SO4 2[Cu(NH3)4]SO4 + 8H2O
избыток синий раствор
Слайд 63Раствор меди сульфата
5%-50,0 мл
Реакция на меди(II) ион
голубой осадок
меди(II)
дигидроксо-сульфата
Слайд 64Раствор меди сульфата 5%-50,0 мл
Реакция на меди(II) ион с
раствором аммония гидроксида
Осадок меди(II) дигидроксосульфата растворим в избытке раствора аммиака
изб.
NH4OHСлайд 65Подлинность
Реакция на сульфат ион
Методика. К 0,5 мл
препарата прибавляют по 2-3 капли хлористоводородной кислоты разведенной 8,3% и
5% раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.Раствор меди сульфата 5%-50мл
Слайд 67Осадок бария сульфата нерастворим в разведенных
минеральных кислотах
Раствор меди сульфата
5%-50,0 мл
Реакция на сульфат ион
+ HCl разв.
Слайд 68Количественное определение
Косвенный йодометрический метод
(прямое титрование)
Титрант: 0,1М раствор натрия тиосульфата.
Индикатор:
раствор крахмала.
2CuSO4 + 4KI → I2 + 2CuI↓ + 2K2SO4
I2
+ 2Na2S2O3 → 2NaI + Na2S4O6Cu2+ + 1ē → Cu+
Раствор меди сульфата 5%-50мл
Слайд 69Количественное определение
Косвенный йодометрический метод
(прямое титрование)
5 мл препарата помещают в
колбу с притертой пробкой, прибавляют 25 мл воды, 2 мл
серной кислоты разведенной 16%, 5 мл 10% раствора калия йодида и выделившийся йод титруют 0,1М раствором натрия тиосульфата (индикатор-крахмал).Раствор меди сульфата 5%-50мл
Слайд 75
Выделившийся йод титруют раствором натрия тиосульфата до светло-желтого окрашивания
(за
1 мл до точки эквивалентности)
Слайд 79
Продолжают титровать раствором натрия тиосульфата до исчезновения фиолетовой окраски раствора
Слайд 81
Список литературы
Беликов, В.Г. Фармацевтическая химия / 4-е
изд., перераб. и доп. – М., МЕДпрессинформ", 2008. – 613
с.Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 10-е изд. – М.: Медицина, 1968. – 1079 с.
Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1987. Вып. 1. – 336 с.
Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1989. Вып. 2. – 400 с.
Государственная фармакопея Российской Федерации [Текст]. – 12-е изд. – М.: Науч. центр экспертизы средств мед. применения, 2007. – Ч. 1. – 696 с.
Практическое руководство к лабораторным занятиям по фармацевтической химии для студентов III курса / Т.И. Ярыгина, О.Л. Визгунова, В.А. Дубовик и др. / под ред. Л.М. Коркодиновой – Пермь, 2011. – 102 с.
Руководство к лабораторным занятиям по фармацевтической химии: учеб. пособие / Э.Н. Аксенова, О.П. Андрианова, А.П. Арзамасцев и др. / под. ред. А.П. Арзамасцева. – 3-е изд., перераб. и доп. – М., Медицина, 2001. – 384 с. : ил.1.