Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ионная хроматография
Содержание
- 1. Ионная хроматография
- 2. Ионный обменИонный обмен - это обратимая химическая
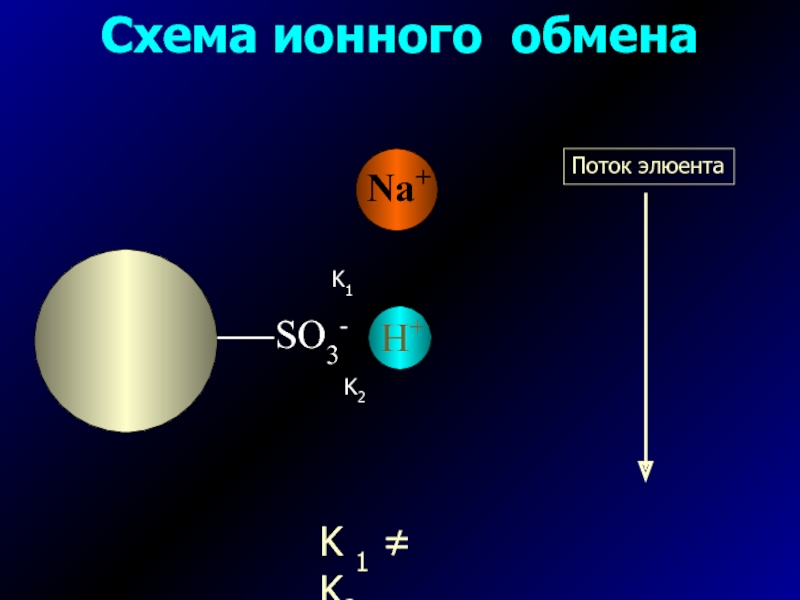
- 3. Схема ионного обменаK1K2K 1 ≠ K2
- 4. Ионообменная хроматографияЖидкостная хроматография, основанная на различной
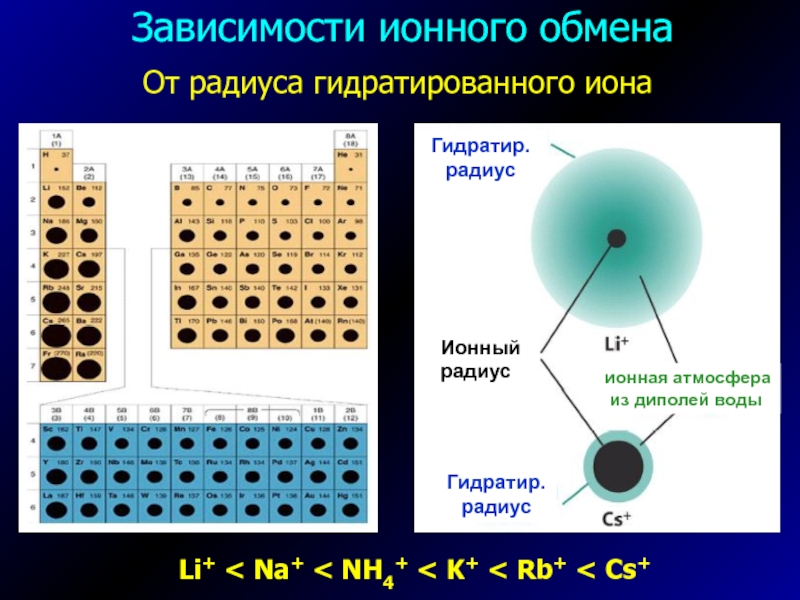
- 5. Зависимости ионного обменаLi+ < Na+ < NH4+ < K+ < Rb+ < Cs+От радиуса гидратированного иона
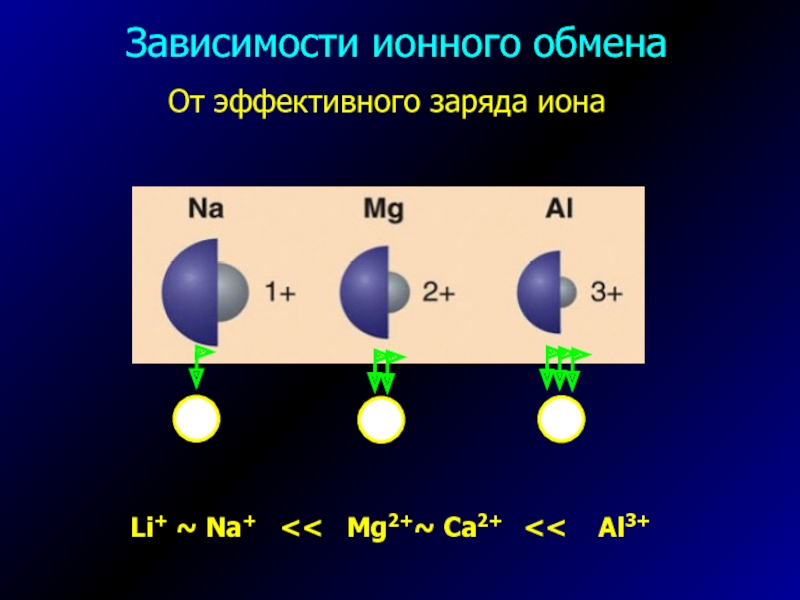
- 6. От эффективного заряда ионаLi+ ~ Na+
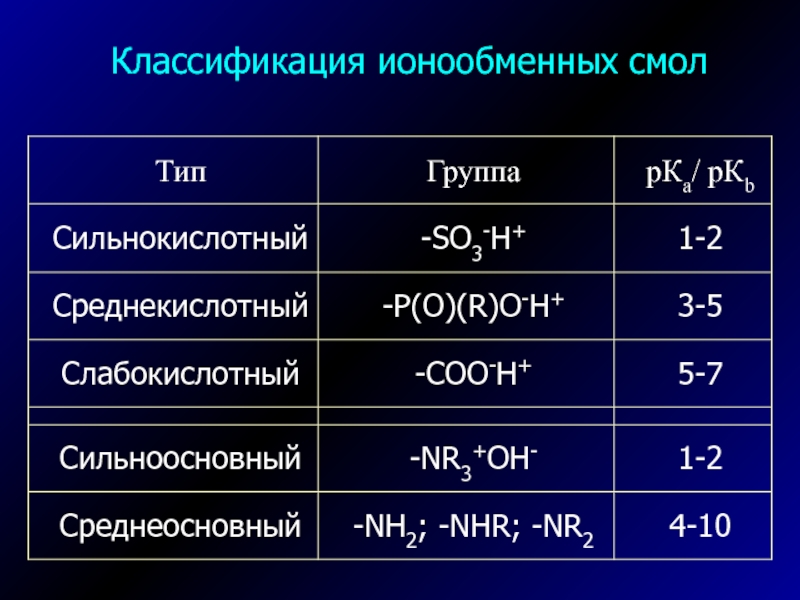
- 7. Классификация ионообменных смол
- 8. Ионная хроматография Весьма эффективный метод определения ионов
- 9. Колонка: IonPac® AS19Элюент: градиент KOH (генератор элюента)Температура:
- 10. Строение сорбентовИонообменная хр-фия Объемно- модифицированные Емкость
- 11. Микрофотография латексного анионообменника
- 12. Матрица сорбентов
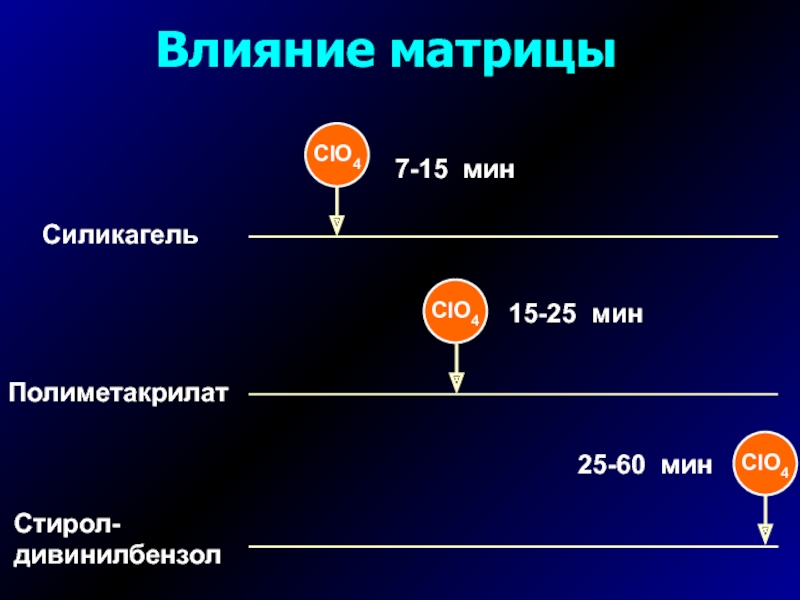
- 13. Влияние матрицы
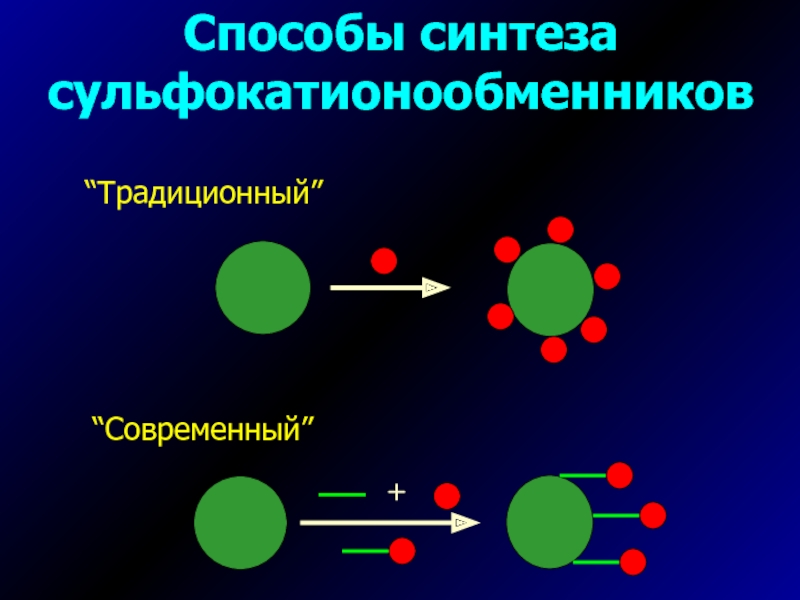
- 14. Способы синтеза сульфокатионообменников
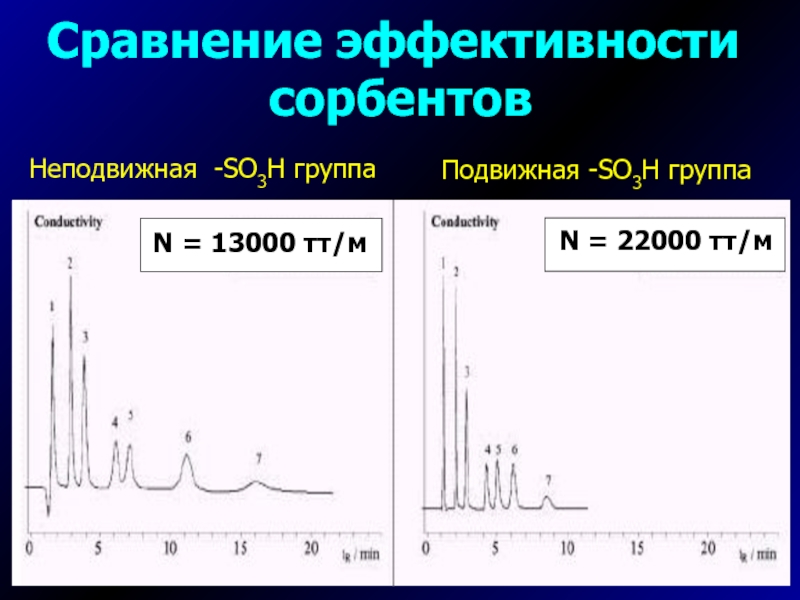
- 15. Сравнение эффективности сорбентовПодвижная -SO3H группаНеподвижная -SO3H группа
- 16. Особенности подвижных фаз в ионной хроматографии
- 17. Схема ионного хроматографа
- 18. Одноколоночный вариант (без подавления фонового сигнала)
- 19. Колоночное подавление (1975 г)Роль подавителя в улучшении
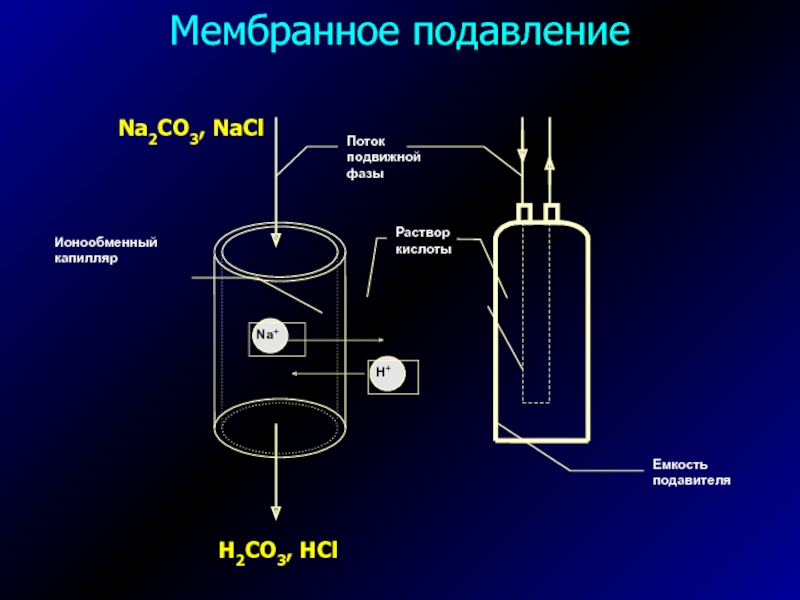
- 20. Мембранное подавление
- 21. Устройство мембранного электролитического подавителя AAES (Anion Atlas
- 22. Мертвый объем систем подавленияКолоночная:
- 23. Принцип работы генератора элюента (KOH)
- 24. Улучшение характеристик определения следовых количеств анионов в
- 25. Превосходная воспроизводимость анализа на системе ICS-3000 с генерацией элюента
- 26. Наиболее часто используемые элюенты при определении анионов с подавлением
- 27. Сравнение двухколоночной (ДК) и одноколоночной (ОК)
- 28. Детектирование в ионной хроматографии
- 29. Детектирование в ионной хроматографии Кондуктометрическое Спектрофотометрическое Электрохимическое Рефрактометрическое (в ионоэксклюзионной хр-фии) Другие
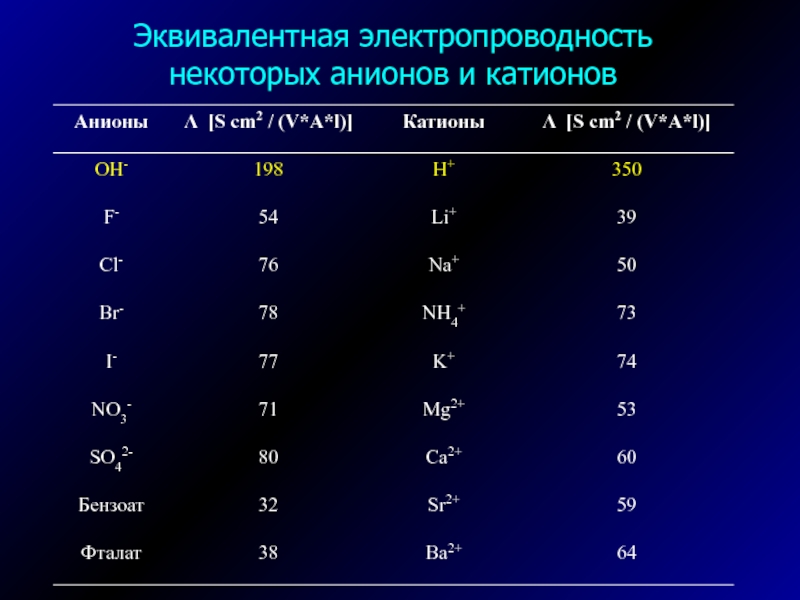
- 30. Эквивалентная электропроводность некоторых анионов и катионов
- 31. Оптимальные длины волн при СФ-детектировании некоторых анионов
- 32. Нитрофенолы, аминофенолы Гидразин, метилгидразин, диметилгидразин,
- 33. Вещества, определяемые с флуоресцентным детектором
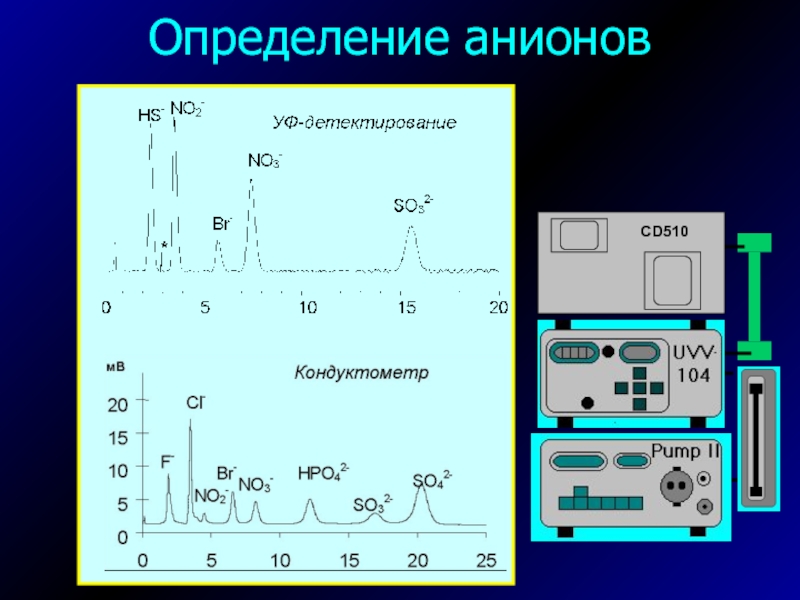
- 34. Определение анионов
- 35. Определение переходных металлов с послеколоночной реакцией
- 36. Определение переходных металлов с послеколоночной реакцией
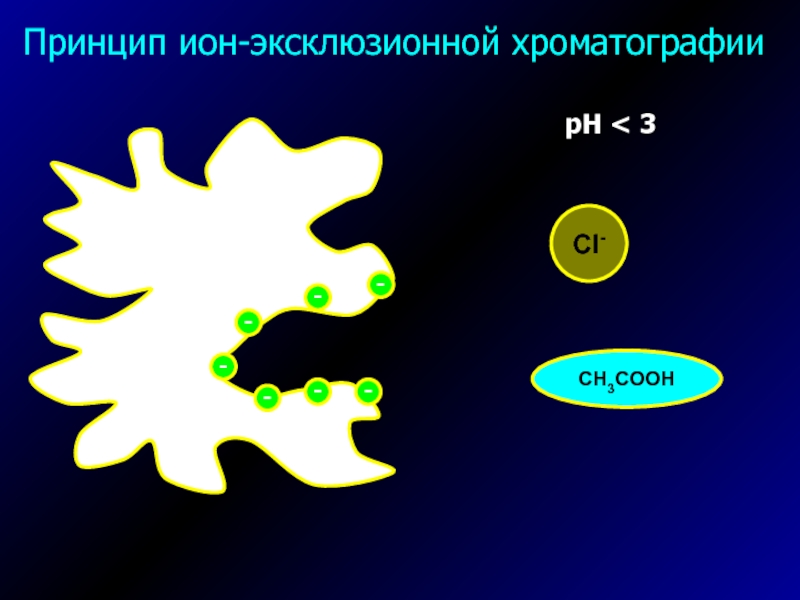
- 37. Ион-эксклюзионная хроматография
- 38. Принцип ион-эксклюзионной хроматографиирН < 3Cl-CH3COOH
- 39. Характеристики сорбентаСорбент: сульфированный СДВБ Степень сшивки:
- 40. Закономерности удерживания органических кислот1. Увеличение рКа ведет
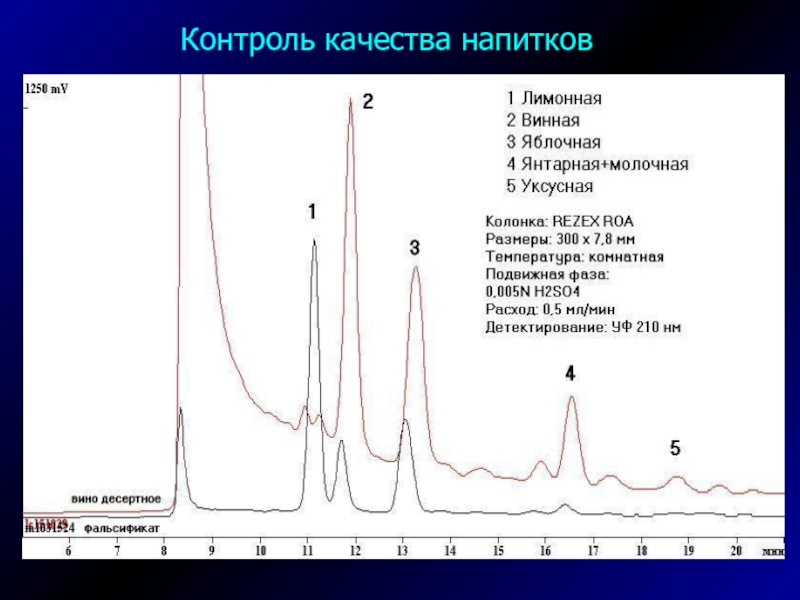
- 41. Контроль качества напитков
- 42. Ион-парная хроматография
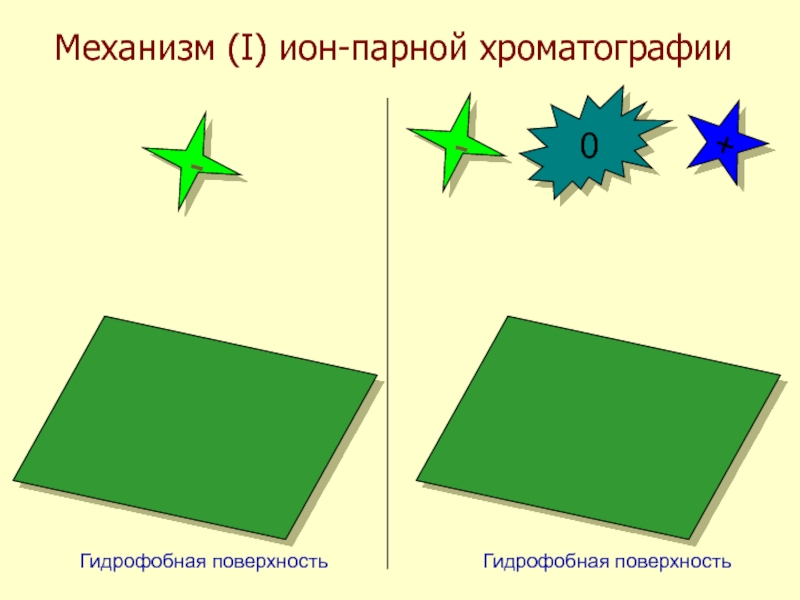
- 43. Механизм (I) ион-парной хроматографии--+0
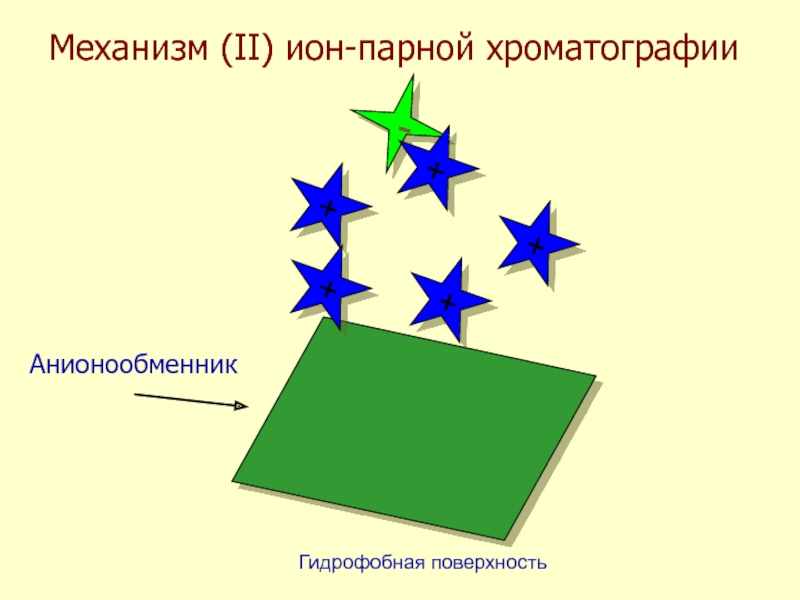
- 44. Механизм (II) ион-парной хроматографии-+++++
- 45. Ион-парная хроматографияСульбактамЦефоперазон
- 46. В элюенте – добавка бромида тетрабутиламмония Хроматограмма
- 47. Микроэмульсии – термодинамически стабильные, оптически прозрачные коллоидные
- 48. Микроэмульсии и МакроэмульсииМикроэмульсияМакроэмульсия (молоко)
- 49. Структура микроэмульсииТипы микроэмульсий:А – «масло в воде»
- 50. Макрогомогенны Оптически прозрачны и устойчивы
- 51. Микроэмульсии как экстрагирующий реагент» Благодаря
- 52. Использование наноэмульсий для пробоподготовкиКосметические и лекарственные средства
- 53. Микроэмульсии как «катализатор» целевых процессовПоверхность капли микроэмульсии
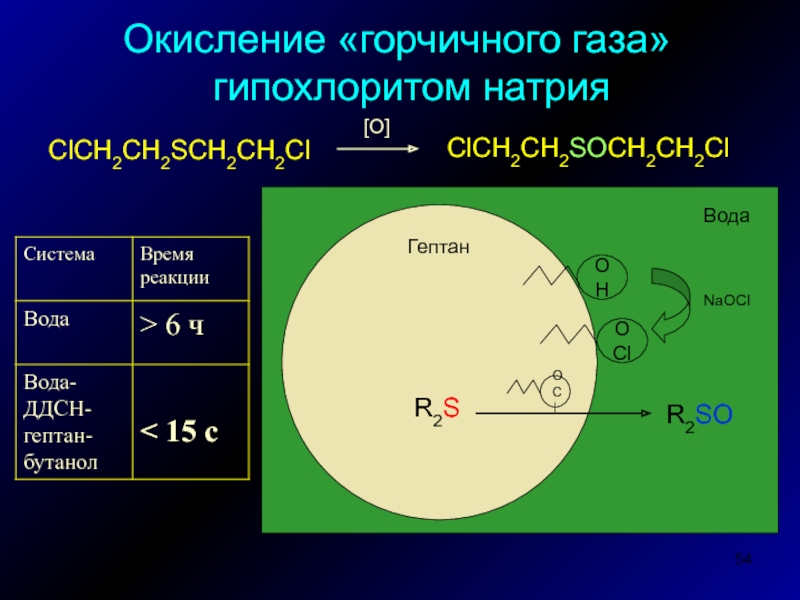
- 54. Окисление «горчичного газа» гипохлоритом натрия
- 55. Проблемы современной ВЭЖХТрудности одновременного изократического определения при значительной разнице в гидрофобностиТрудоемкость и ресурсоемкость пробоподготовки
- 56. Возможные способы снижения давления1. Снижение скорости потока
- 57. Хроматограмма экстракта из препарата Финалгон.1 – сорбиновая
- 58. Хроматограмма экстракта из препарата Финалгон.1 – сорбиновая
- 59. Выбор варианта хроматографии в зависимости от задачи
- 60. Определяемое веществоВарианты эксклюзионной хроматографииЛетучее в-во?Можно ли перевести в летучее ?Неорган. газы?ГАХГЖХ
- 61. Полярное в-во?Стереоизомеры?Варианты хиральной хр-фииНФ ВЭЖХЭто ион? Карбоновая к-та?Ионнаяхр-фия
- 62. Основные преимущества хроматографииВысочайшая селективностьПравильность и воспроизводимость
- 63. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Ионный обмен
Ионный обмен - это обратимая химическая
реакция, при которой происходит
обмен
ионами между твердым веществом
(обычно смолами) и раствором
электролита
Слайд 4Ионообменная хроматография
Жидкостная хроматография,
основанная на различной способности
ионов к ионному обмену
Больше физико-химический, чем аналитический метод
Не высокоэффективная хроматография
Развивается с середины 50-х годов ХХ векаВыявлены основы и закономерности ионного обмена
Слайд 8Ионная хроматография
Весьма эффективный метод определения ионов
Лучший метод определения
анионов, особенно
неорганических
Наиболее распространенные детекторы –
кондуктометрический и
спектрофотометрическийПределы обнаружения на уровне 1-10 нг/мл без концентрирования
Воспроизводимость по высотам и площадям пиков Sr <= 0.05
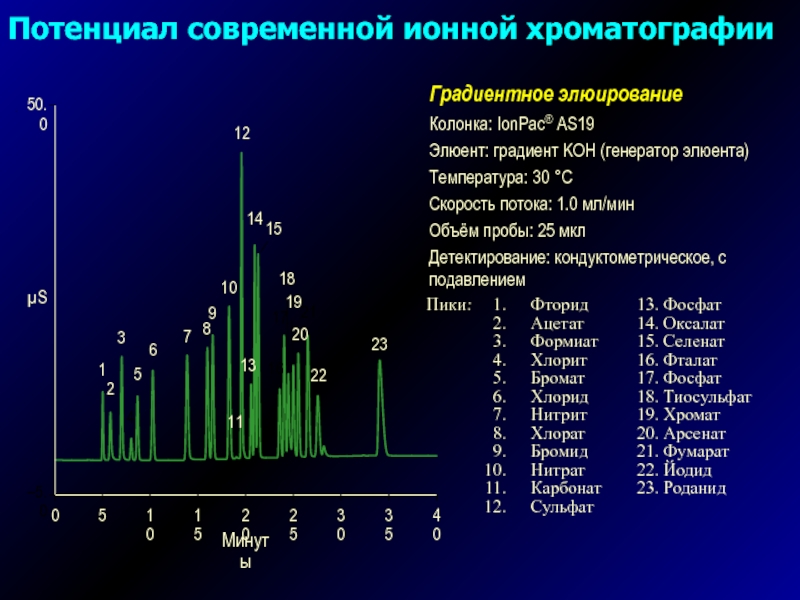
Слайд 9Колонка: IonPac® AS19
Элюент: градиент KOH (генератор элюента)
Температура: 30 °C
Скорость
потока: 1.0 мл/мин
Объём пробы: 25 мкл
Детектирование: кондуктометрическое, с подавлением
Градиентное элюирование
Потенциал
современной ионной хроматографииСлайд 10Строение сорбентов
Ионообменная хр-фия
Объемно-
модифицированные
Емкость до 10 мМ/г
Диаметр 200-2000 мкм
Поверхностно-
модифицированные
Емкость 0.01-0.05 мМ/г
Диаметр 5-10 мкмСлайд 16Особенности подвижных фаз
в ионной хроматографии
Практически всегда только водные
растворы электролитов (солей или кислот)
Элюирующая сила зависит от
типа
используемого электролита
Сильное влияние рН
«Совместимость» с кондуктометрическим детектированием
Слайд 18Одноколоночный вариант (без подавления фонового сигнала) Двухколоночный вариант (с
подавлением фонового сигнала)
Варианты ионной хроматографии
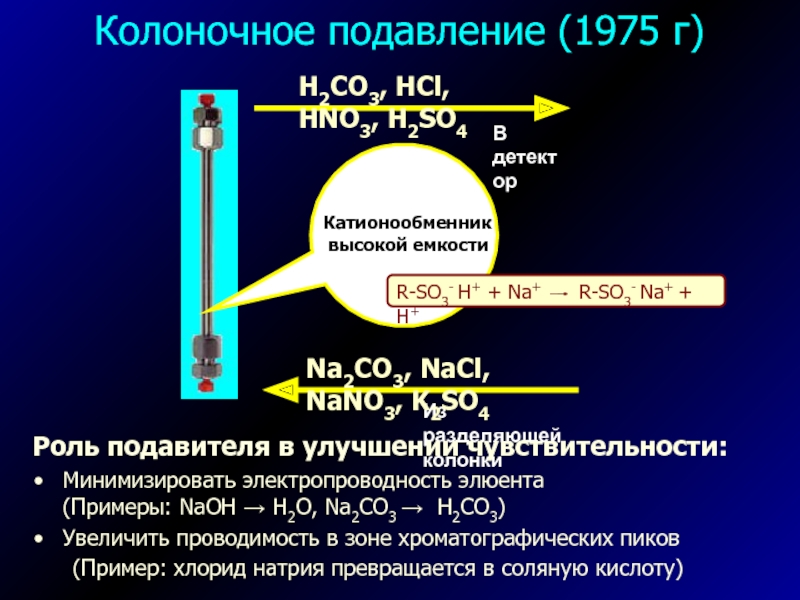
Слайд 19Колоночное подавление (1975 г)
Роль подавителя в улучшении чувствительности:
Минимизировать электропроводность элюента
(Примеры: NaOH → H2O, Na2CO3 → H2CO3)
Увеличить проводимость в зоне
хроматографических пиков(Пример: хлорид натрия превращается в соляную кислоту)
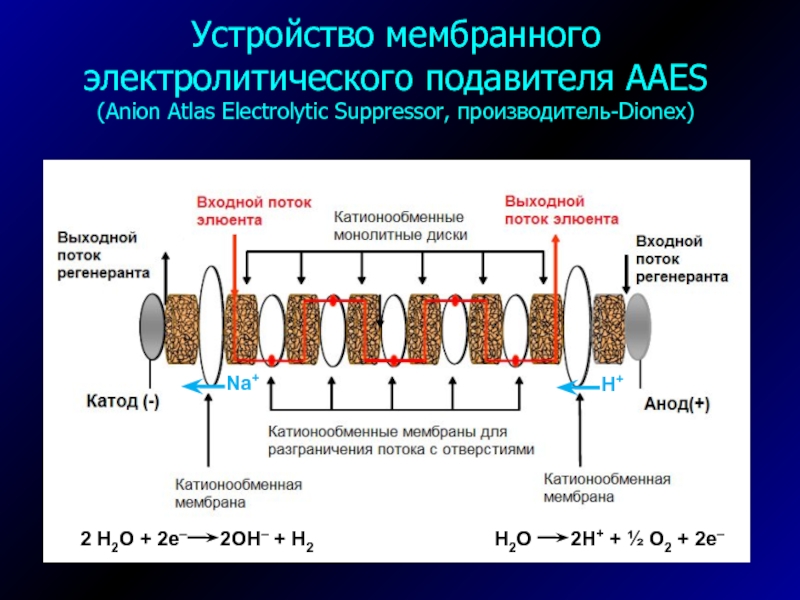
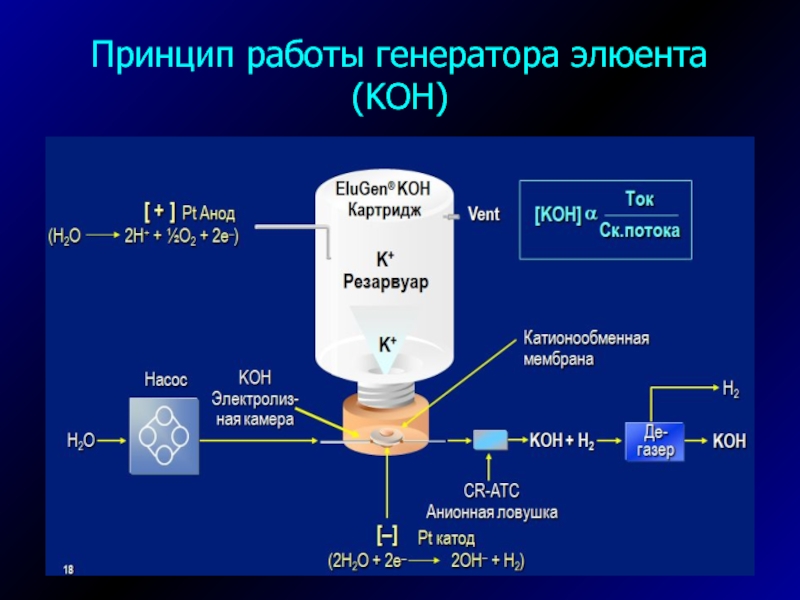
Слайд 21Устройство мембранного электролитического подавителя AAES
(Anion Atlas Electrolytic Suppressor, производитель-Dionex)
H2O
2H+ + ½ O2 + 2e–
2 H2O +
2e– 2OH– + H2H+
Na+
Слайд 22Мертвый объем систем подавления
Колоночная:
2 мл
Мембранная: 0.2
млМикромембранная: 0.05 мл
Рост эффективности
Слайд 24Улучшение характеристик определения следовых количеств анионов в режиме безреагентной ИХ
Колонка: IonPac®
AG11, AS11, 2 mm
Элюент: (A) NaOH
(B) KOH (EGC-KOH cartridge)
0.5 мМ до
2.5 мин, к 5.0 мМ на 6 мин,к 26 мМ на 20 мин
Скорость подачи элюента: 0.5 мл/мин
Объем пробы: 1.0 mL
Подавитель: ASRS®
Детектирование: кондуктометрическое с
подавлением фоновой электропроводности
Пики: 1. Фторид 0.37 мкг/л (ppb)
2. Ацетат 1.0
3. Формиат 0.93
4. Хлорид 0.44
5. Нитрит 0.27
6. Бромид 1.0
7. Нитрат 0.33
8. Карбонат –
9. Сульфат 0.64
10. Оксалат 0.39
11. Фосфат 1.1
Слайд 27Сравнение двухколоночной (ДК)
и одноколоночной (ОК) ионной хроматографии
Пределы обнаружения
в ДК ниже на 1-2
порядка
Эффективность разделения выше
в ОКВ ОК шире выбор элюентов и сорбентов
Слайд 29Детектирование в ионной хроматографии
Кондуктометрическое
Спектрофотометрическое
Электрохимическое
Рефрактометрическое (в
ионоэксклюзионной хр-фии)
Другие
Слайд 32
Нитрофенолы, аминофенолы
Гидразин, метилгидразин, диметилгидразин,
Цианид, роданид
Основные типы сахаров
Бромид, гидросульфид, арсенит, иодид, тиосульфат,
сульфит, нитрит на уровне мкг/лБиогенные амины (тирамин)
Основные соединения,
определяемые амперометрическим детектором
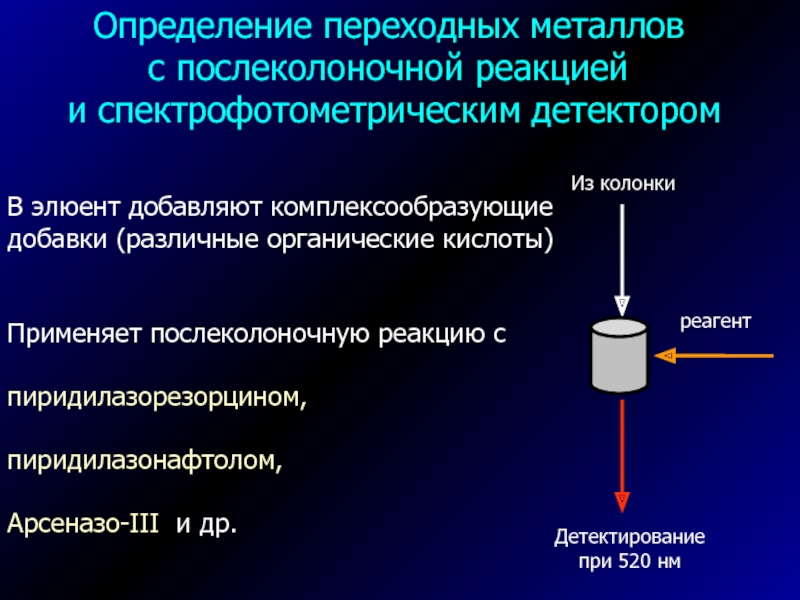
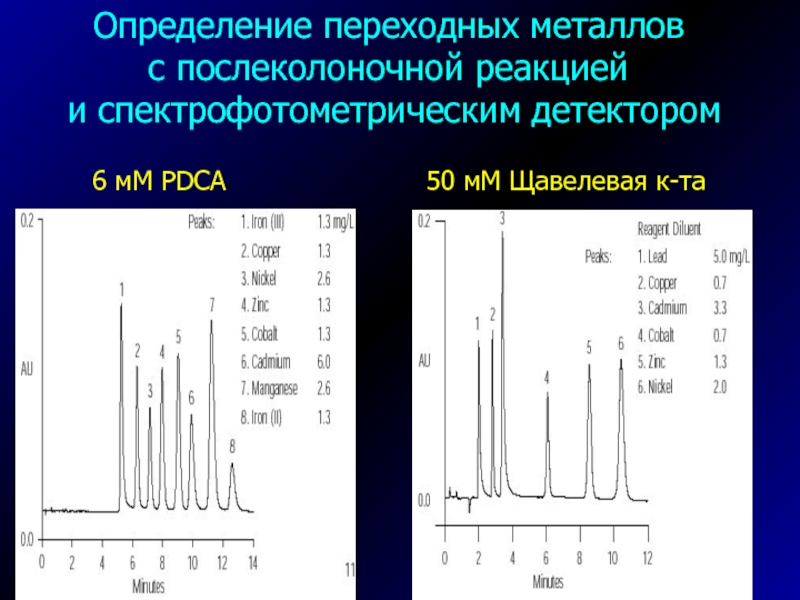
Слайд 35Определение переходных металлов
с послеколоночной реакцией
и спектрофотометрическим детектором
В элюент
добавляют комплексообразующие
добавки (различные органические кислоты)
Применяет послеколоночную реакцию с
пиридилазорезорцином,
пиридилазонафтолом,
Арсеназо-III
и др.Слайд 36Определение переходных металлов
с послеколоночной реакцией
и спектрофотометрическим детектором
6 мМ
PDCA
50 мМ Щавелевая к-та
Слайд 39Характеристики сорбента
Сорбент: сульфированный СДВБ
Степень сшивки: 4 и
8%
Формы: Ca2+, Na+, K+, Ag2+, Pb2+, H+
Размер частиц:
8 мкм Геометрические размеры: 300х7,8; 200х10; 250х4,6; 100х7,8;
Емкость: 1 мэкв/г
Слайд 40Закономерности удерживания органических кислот
1. Увеличение рКа ведет к возрастанию удерживания
2.
Для кислот равной силы удерживание увеличивается с возрастанием гидрофобности молекулы
(уменьшением растворимости в воде)3. Двухосновные кислоты удерживаются слабее одноосновных
4. Кислоты изомерного строения удерживаются слабее соответствующих кислот нормального строения
5. Наличие двойных связей или бензольных колец в молекуле кислоты увеличивает удерживание
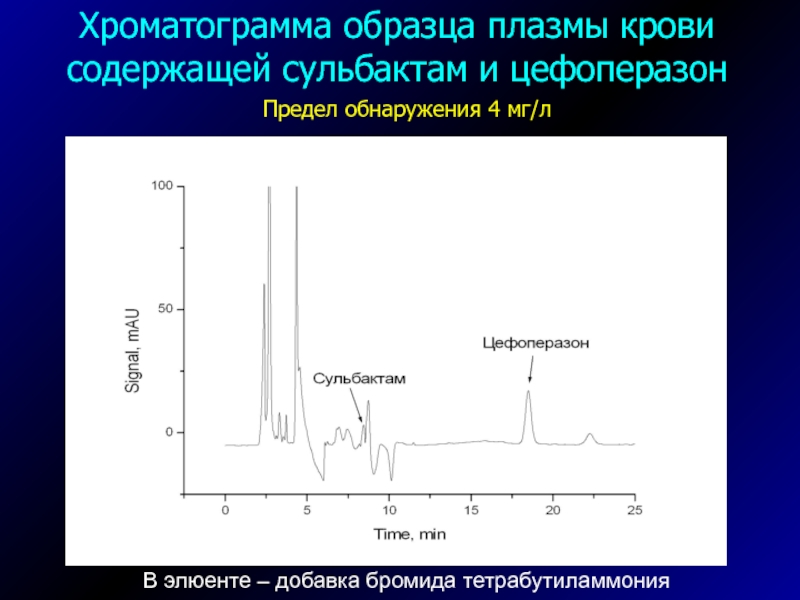
Слайд 46В элюенте – добавка бромида тетрабутиламмония
Хроматограмма образца плазмы крови
содержащей сульбактам и цефоперазон
Предел обнаружения 4 мг/л
Слайд 47Микроэмульсии – термодинамически стабильные, оптически прозрачные коллоидные системы, состоящие из
двух жидкостей с ограничнной взаимной растворимостью, стабилизированных пленкой молекул поверхностно-активного
вещества.Микроэмульсии состоят из сферических капель (диаметр ~ 20-100 нм) воды в «масле» либо «масла» в воде, в зависимости от количества отдельных компонентов и от природы ПАВ.
Нано (микроэмульсии)
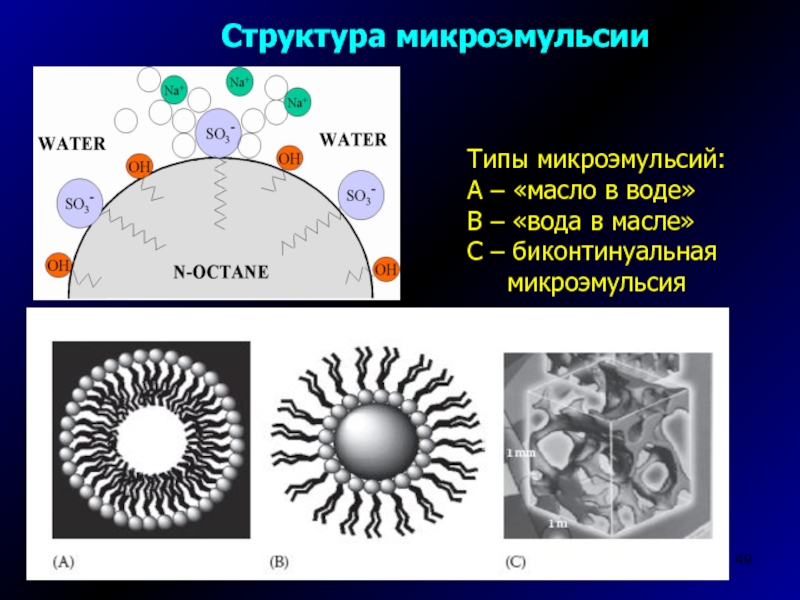
Слайд 49Структура микроэмульсии
Типы микроэмульсий:
А – «масло в воде»
В – «вода
в масле»
С – биконтинуальная
микроэмульсия
Слайд 50 Макрогомогенны
Оптически прозрачны и устойчивы
Большая площадь поверхности
Участки
с повышенной энергией
Каталитические и стабилизационные свойства
Размер, сопоставимый с
размером
клеточных органел и стенок
Относительно легко получаются
Приемлемая вязкость и биосовместимость
Много параметров варьирования (разнообразие свойств)
Достоинства микроэмульсий
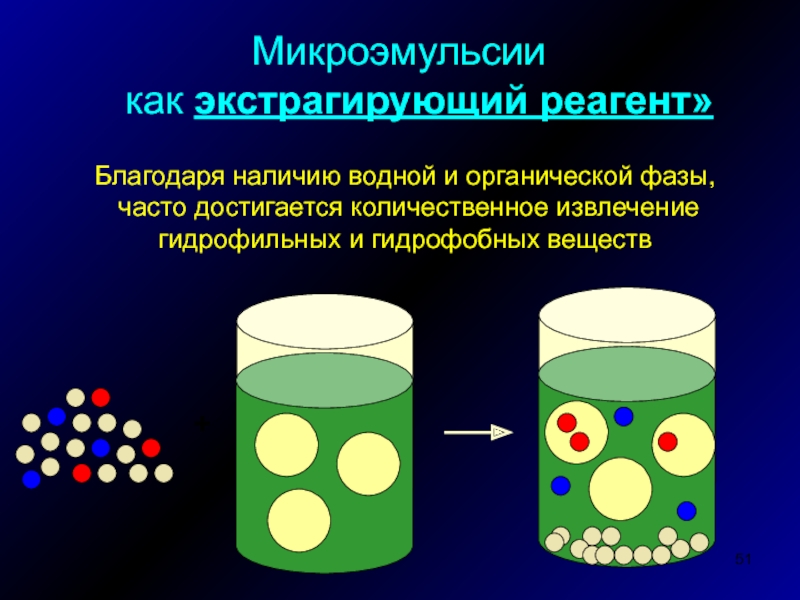
Слайд 51Микроэмульсии
как экстрагирующий реагент»
Благодаря наличию водной и органической фазы,
часто достигается количественное извлечение
гидрофильных и гидрофобных веществ
+
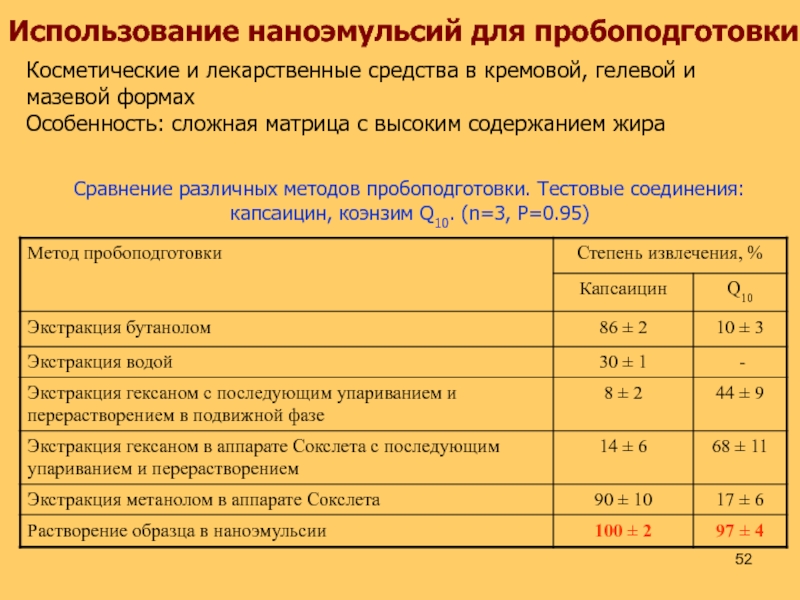
Слайд 52Использование наноэмульсий для пробоподготовки
Косметические и лекарственные средства в кремовой, гелевой
и
мазевой формах
Особенность: сложная матрица с высоким содержанием жира
Сравнение различных методов
пробоподготовки. Тестовые соединения: капсаицин, коэнзим Q10. (n=3, P=0.95)Слайд 53Микроэмульсии как «катализатор»
целевых процессов
Поверхность капли микроэмульсии постоянно обновляется.
Возникают области
с повышенной энергией, которые могут
играть роль катализационно-активных сайтов.
Возможное применение
– ускорение реакций,
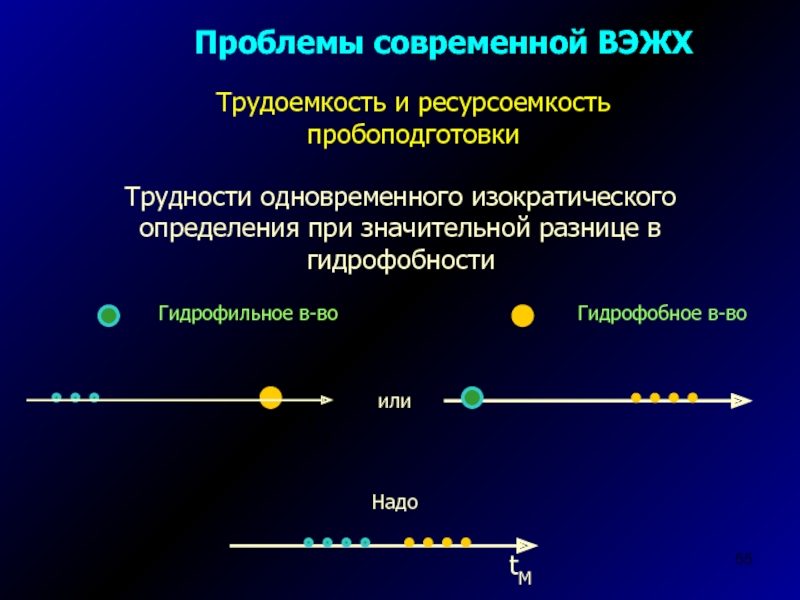
проведение реакций при комнатных температурах и т.п.Слайд 55Проблемы современной ВЭЖХ
Трудности одновременного изократического определения при значительной разнице в
гидрофобности
Трудоемкость и ресурсоемкость пробоподготовки
Слайд 56Возможные способы снижения давления
1. Снижение скорости потока подвижной фазы
2. Повышение
температуры элюента
3. Использование монолитных неподвижных фаз
Особенности при использовании микроэмульсий
в
качестве подвижных фаз в хроматографии Высокое давление в хроматографической
системе
Эмульсии типа «вода в масле» плохо
совместимы в градиентном режиме с водными
растворами
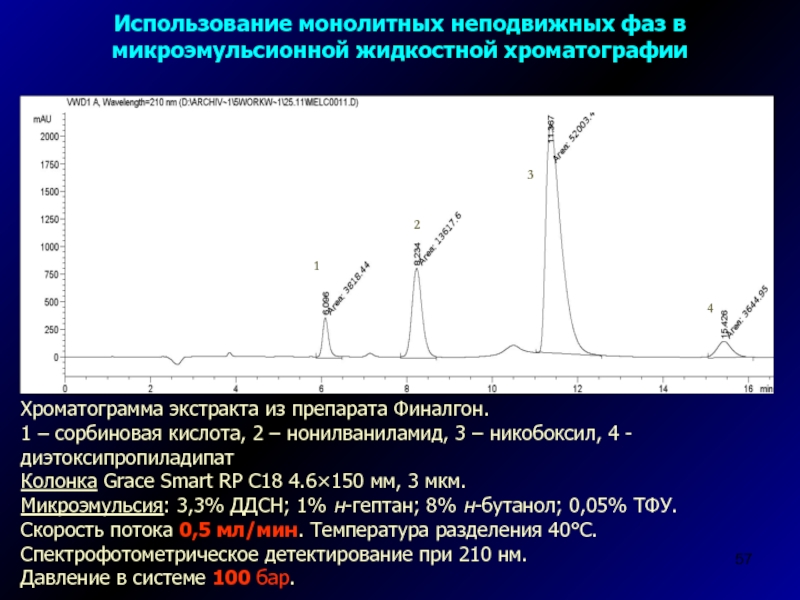
Слайд 57Хроматограмма экстракта из препарата Финалгон.
1 – сорбиновая кислота, 2 –
нонилваниламид, 3 – никобоксил, 4 - диэтоксипропиладипат
Колонка Grace Smart RP
C18 4.6×150 мм, 3 мкм.Микроэмульсия: 3,3% ДДСН; 1% н-гептан; 8% н-бутанол; 0,05% ТФУ. Скорость потока 0,5 мл/мин. Температура разделения 40С. Спектрофотометрическое детектирование при 210 нм.
Давление в системе 100 бар.
Использование монолитных неподвижных фаз в микроэмульсионной жидкостной хроматографии
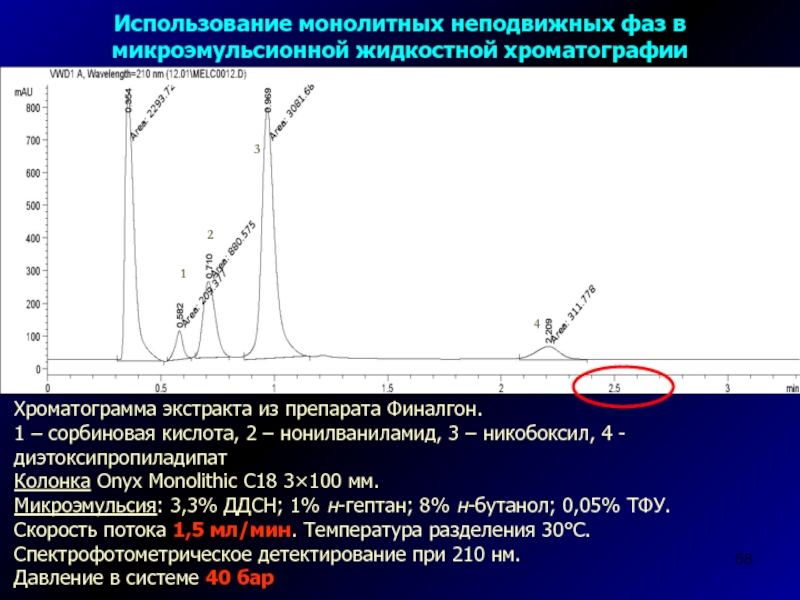
Слайд 58Хроматограмма экстракта из препарата Финалгон.
1 – сорбиновая кислота, 2 –
нонилваниламид, 3 – никобоксил, 4 - диэтоксипропиладипат
Колонка Onyx Monolithic C18
3×100 мм.Микроэмульсия: 3,3% ДДСН; 1% н-гептан; 8% н-бутанол; 0,05% ТФУ. Скорость потока 1,5 мл/мин. Температура разделения 30С. Спектрофотометрическое детектирование при 210 нм.
Давление в системе 40 бар
Использование монолитных неподвижных фаз в микроэмульсионной жидкостной хроматографии
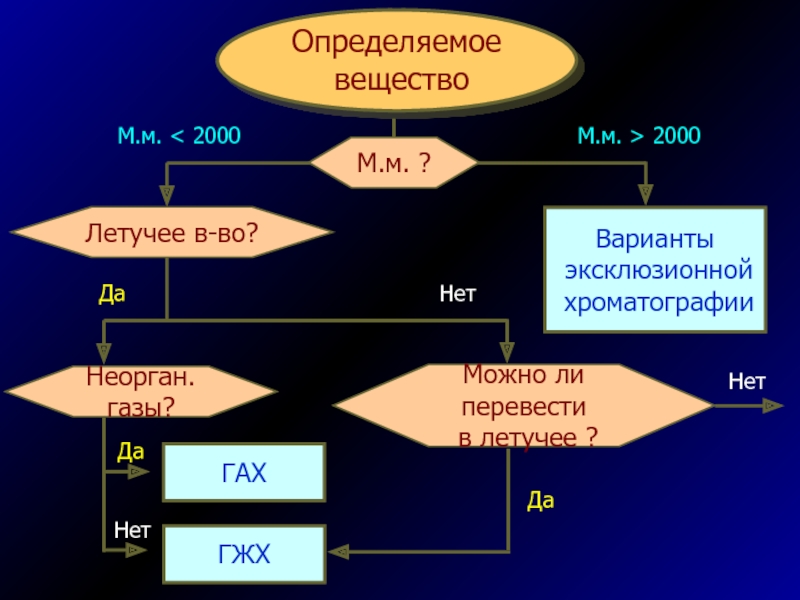
Слайд 60Определяемое
вещество
Варианты
эксклюзионной
хроматографии
Летучее в-во?
Можно ли перевести
в летучее ?
Неорган.
газы?
ГАХ
ГЖХ
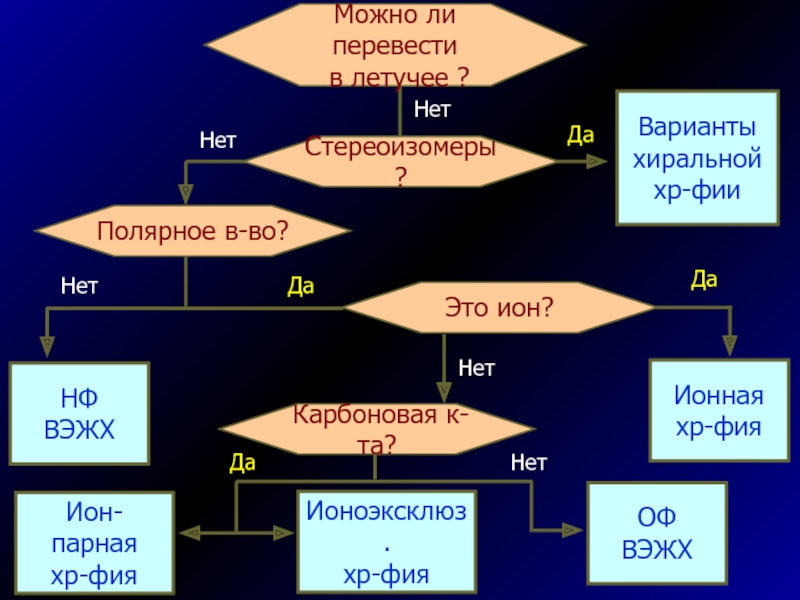
Слайд 61Полярное в-во?
Стереоизомеры?
Варианты
хиральной
хр-фии
НФ
ВЭЖХ
Это ион?
Карбоновая к-та?
Ионная
хр-фия
Слайд 62Основные преимущества хроматографии
Высочайшая селективность
Правильность и воспроизводимость
результатов химического анализа
Многокомпонентность анализа
Низкие
пределы обнаружения (0.1 мкг/л)
Широкий диапазон линейности (1-1000 мкг/л)
Малый расход пробы
(1 мл)Экспрессность анализа
Простота эксплуатации и возможность полной автоматизации