Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекарственные растения и сырье, содержащие сердечные гликозиды
Содержание
- 1. Лекарственные растения и сырье, содержащие сердечные гликозиды
- 2. 1. Понятие о сердечных гликозидах (СГ)
- 3. Сердечные гликозиды (СГ) гетерозиды растительного происхождения, производные
- 4. Свое название эти вещества получили
- 5. 2. Строение СГ
- 6. СГ состоят из 3 основных частей:Стероидный цикл.Лактонное кольцо.Углеводная цепь.
- 7. Молекулы СГ состоят из агликона и углеводной
- 8. циклопентанпергидрофенантрен
- 9. В ядре ЦППГФ:Кольца А/В имеют и цис-,
- 10. В стероидном ядре имеются постоянные заместители:В 17
- 11. В стероидном ядре имеются постоянные заместители:В 3 и 14 положениях присутствуют гидроксильные (-ОН) группы.
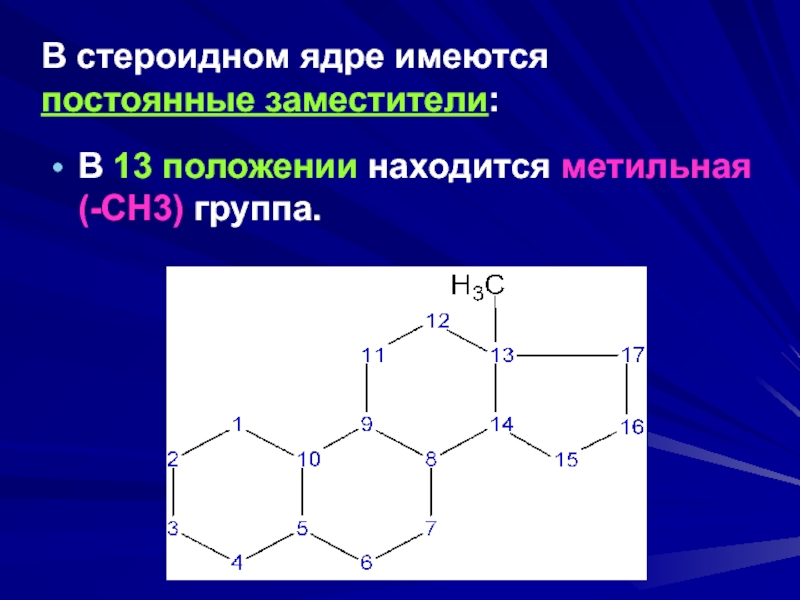
- 12. В стероидном ядре имеются постоянные заместители:В 13 положении находится метильная (-СН3) группа.
- 13. В стероидном ядре имеются переменные заместители:В 10
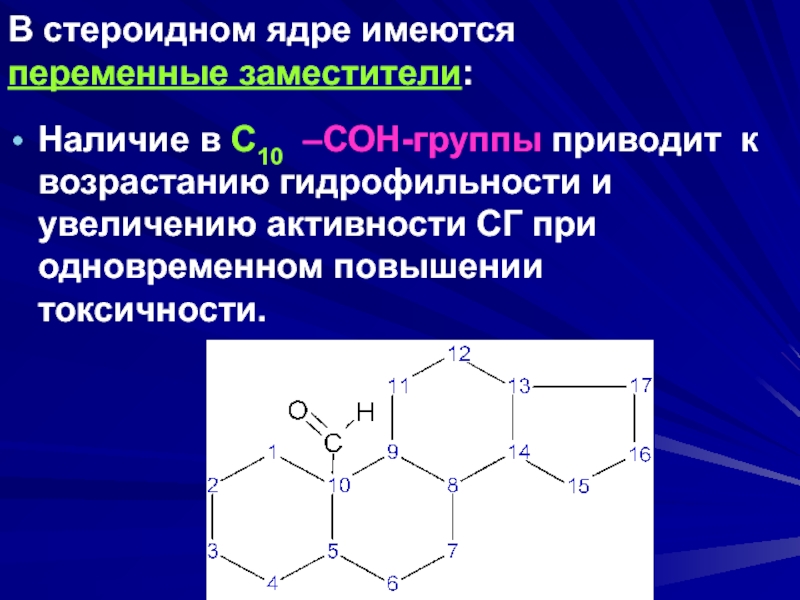
- 14. В стероидном ядре имеются переменные заместители:Наличие в
- 15. В стероидном ядре имеются переменные заместители:В 1,
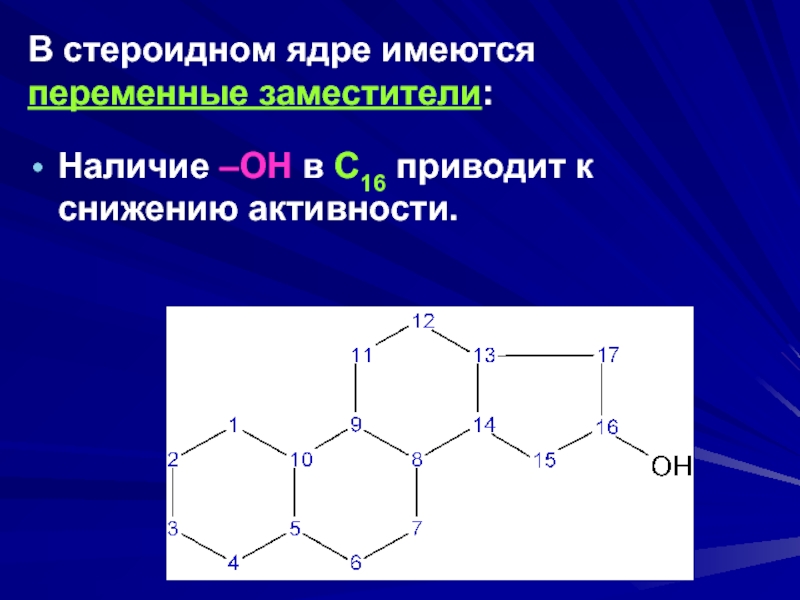
- 16. В стероидном ядре имеются переменные заместители:Наличие –ОН в С16 приводит к снижению активности.
- 17. В стероидном ядре имеются переменные заместители:–ОН в
- 18. Свободные агликоны СГ плохо удерживаются миокардом, поэтому
- 19. 6-дезоксисахараβ-D-фукоза
- 20. 2, 6-дезоксисахараβ-D-дигитоксоза
- 21. Метиловый эфир 2, 6-дезоксисахаровβ-D-цимароза
- 22. Общая формула СГ:R1= -CH3, -CH2OH, -COH, -COOHR2= -H, -OH
- 23. 3. Классификация СГ
- 24. СГ в зависимости от строения лактонного кольца
- 25. СГ в зависимости от строения лактонного кольца
- 26. Карденолиды
- 27. 1. Подгруппа наперстянкиВ С10 СН3-группа.Агликон дигитоксигенин.Оксипроизводные –
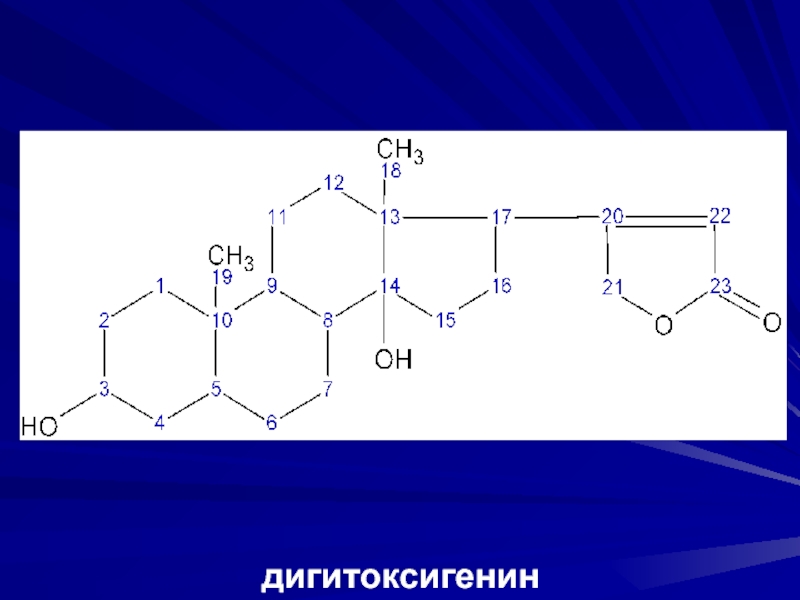
- 28. дигитоксигенин
- 29. гитоксигенин
- 30. дигоксигенин
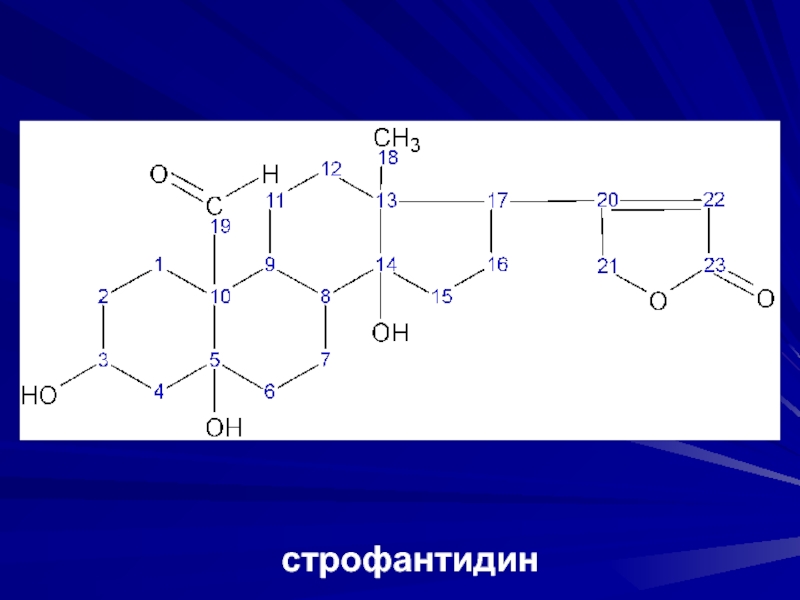
- 31. 2. Подгруппа строфантаВ С10 СОН-группа.Агликоны – строфантидин, адонитоксигенин.Триозиды – строфантозид.Биозиды – К-строфантин-β.Монозиды – цимарин, конваллотоксин, адонитоксин.
- 32. строфантидин
- 33. адонитоксигенин
- 34. Сырьевая база ЛР, содержащих СГ
- 35. Дикорастущие:Н. крупноцветковая.
- 36. Дикорастущие:Горицвет весенний.
- 37. Дикорастущие:Ландыш майский.
- 38. Культивируемые:Н. пурпуровая.
- 39. Культивируемые:Н. шерстистая.
- 40. Культивируемые:Желтушник раскидистый.
- 41. Импортируемые:Семена строфанта (Восточная Африка).
- 42. Физические, химические и биологические свойства СГ
- 43. Физические свойства СГ
- 44. Кристаллические вещества, реже аморфные, бесцветные, иногда беловатые
- 45. Растворяются в воде, этиловом, метиловом спирте, хлороформе.Не
- 46. Гидрофильные СГХорошо растворяются в воде.Мало растворяются в
- 47. Липофильные СГПлохо растворяются в воде.Легко растворяются в липидах.Липофильность обусловлена наличием СН3-группы в С10.СГ подгруппы наперстянки.
- 48. Биологические свойства СГ
- 49. СГ взаимодействуют с белками плазмы крови.Прочность связи
- 50. Химические свойства СГ
- 51. Обусловлены наличием стероидного ядра, лактонного кольца, углеводной
- 52. Схема гидролиза пурпуреагликозидов А и В:Первичные СГ
- 53. Схема гидролиза пурпуреагликозидов А и В:Первичные СГ
- 54. Схема гидролиза ланатозидов А, В, С и
- 55. Схема гидролиза ланатозидов А, В, С и
- 56. Схема гидролиза ланатозидов А, В, С и
- 57. Схема гидролиза ланатозидов А, В, С и
- 58. Методы анализа ЛРС
- 59. Выделение СГ из ЛРС
- 60. При выделении сердечных гликозидов используются органические растворители
- 61. Выделение сердечных гликозидов из растительного сырья можно
- 62. Качественный анализ
- 63. Реакции на СГ проводят с очищенным спиртовым
- 64. 1. Реакции на стероидную структуруОснованы на способности
- 65. 2. Реакции на ненасыщенное лактонное кольцоОснованы на
- 66. 3. Реакции на углеводную часть молекулыОснованы на
- 67. Количественное определение
- 68. В ГФ 11, вып.2 ОФС «БИОЛОГИЧЕСКИЕ
- 69. ГФ 12, ст.30. БИОЛОГИЧЕСКИЕ МЕТОДЫ ОЦЕНКИ
- 70. Скачать презентанцию
1. Понятие о сердечных гликозидах (СГ)
Слайды и текст этой презентации
Слайд 3Сердечные гликозиды (СГ)
гетерозиды растительного происхождения, производные циклопентанпергидрофенантрена, имеющие в
Слайд 4 Свое название эти вещества получили благодаря специфическому действию
на сердце.
В терапевтических дозах СГ:
ускоряют и усиливают систолу,
удлиняют диастолу,
замедляют ритм
сердечных сокращений, улучшают питание миокарда, понижают возбудимость проводящей системы сердца,т.е. оказывают кардиотоническое действие.
Слайд 7Молекулы СГ состоят из агликона и углеводной части.
Специфическим действием на
миокард обладает только агликон.
Сахарные остатки на миокард не влияют, но
в сочетании с агликоном, обусловливают растворимость гликозидов в воде и способствуют накоплению АТФ-азы.В основе агликона СГ лежит стероидное ядро циклопентанпергидрофенантрена (ЦППГФ):
Слайд 9В ядре ЦППГФ:
Кольца А/В имеют и цис-, и транс-сочленение.
Кольца В/С
имеют транс-положение (свойство всех природных стероидов).
Кольца С/D имеют цис-сочленение (отличие
от других природных стероидов).Слайд 10В стероидном ядре имеются
постоянные заместители:
В 17 положении всегда присоединяется 5-членное
или 6-членное ненасыщенное лактонное кольцо (отличительный признак СГ от других
природных стероидов).Наличие ненасыщенного лактонного кольца обусловливает специфическое действие на миокард.
Отсутствие, разрыв или изомеризация лактонного кольца приводит к полной потере активности СГ.
Слайд 11В стероидном ядре имеются
постоянные заместители:
В 3 и 14 положениях присутствуют
гидроксильные (-ОН) группы.
Слайд 12В стероидном ядре имеются
постоянные заместители:
В 13 положении находится метильная (-СН3)
группа.
Слайд 13В стероидном ядре имеются переменные заместители:
В 10 положении могут быть
метильная (-СН3), оксиметильная (-СН2ОН), альдегидная (-СОН), карбоксильная (-СООН) группы.
Слайд 14В стероидном ядре имеются переменные заместители:
Наличие в С10 –СОН-группы приводит
к возрастанию гидрофильности и увеличению активности СГ при одновременном повышении
токсичности.Слайд 15В стероидном ядре имеются переменные заместители:
В 1, 2, 5, 11,
12, 15, 16 положениях могут присутствовать гидроксильные (-ОН) группы.
Слайд 16В стероидном ядре имеются переменные заместители:
Наличие –ОН в С16 приводит
к снижению активности.
Слайд 17В стероидном ядре имеются переменные заместители:
–ОН в С16 могут быть
ацилированы муравьиной, уксусной, изовалериановой кислотами, что увеличивает токсичность.
Слайд 18Свободные агликоны СГ плохо удерживаются миокардом, поэтому их действие более
короткое и токсичное.
СГ являются О-гликозидами.
Образование гликозидной связи происходит за счет
атома кислорода полуацетального гидроксила сахара и атома водорода гидроксила у С3.В составе СГ присутствуют специфические углеводы, обедненные кислородом – дезоксисахара и их метиловые эфиры.
Слайд 24СГ в зависимости от строения лактонного кольца делят:
1. Карденолиды
(бутенолиды) – СГ, содержащие у С17 пятичленное ненасыщенное лактонное кольцо.
Слайд 25СГ в зависимости от строения лактонного кольца делят:
2. Буфадиенолиды
(кумалины) – СГ, содержащие у С17 шестичленное дважды ненасыщенное лактонное
кольцо.Слайд 271. Подгруппа наперстянки
В С10 СН3-группа.
Агликон дигитоксигенин.
Оксипроизводные – гитоксигенин, дигоксигенин.
Углеводная цепь
состоит из 3 молекул дигитоксозы и 1 молекулы глюкозы.
Пурпуреагликозиды А
и В.Ланатозиды (дигиланиды) А, В, С.
Слайд 312. Подгруппа строфанта
В С10 СОН-группа.
Агликоны – строфантидин, адонитоксигенин.
Триозиды – строфантозид.
Биозиды
– К-строфантин-β.
Монозиды – цимарин, конваллотоксин, адонитоксин.
Слайд 44Кристаллические вещества, реже аморфные, бесцветные, иногда беловатые или с кремоватым
оттенком, без запаха, горького вкуса.
Определенная t плавления.
Угол вращения.
Флюоресцируют в УФ-свете
оттенками желтого (дигитоксигенин), зеленого, голубого (гитоксигенин) цветов.Слайд 45Растворяются в воде, этиловом, метиловом спирте, хлороформе.
Не растворяются в других
органических растворителях.
Агликоны СГ растворяются в органических растворителях.
В зависимости от растворимости
в воде и липидах, СГ делят на:1) Гидрофильные (полярные) СГ;
2) Липофильные (неполярные) СГ.
Слайд 46Гидрофильные СГ
Хорошо растворяются в воде.
Мало растворяются в липидах.
Полярность обусловлена наличием
СОН-группы в С10, ОН-группы в структуре агликона.
СГ подгруппы строфанта.
Слайд 47Липофильные СГ
Плохо растворяются в воде.
Легко растворяются в липидах.
Липофильность обусловлена наличием
СН3-группы в С10.
СГ подгруппы наперстянки.
Слайд 49СГ взаимодействуют с белками плазмы крови.
Прочность связи прямопропорциональна растворимости в
липидах и обратнопропорциональна степени полярности СГ.
Прочные связи затрудняют ресорбцию СГ
из крови белками органов.В миокарде фиксируется ~10% СГ (в 20 раз больше, чем в других органах).
Действие СГ проявляется на каждое мышечное волокно миокарда.
Слайд 51Обусловлены наличием стероидного ядра, лактонного кольца, углеводной цепи и присутствием
гликозидной связи.
Самые нестойкие – лактонное кольцо и гликозидная связь.
Лактонное кольцо
легко изомеризуется под действием щелочей.СГ по гликозидной связи в присутствии воды подвергаются ступенчатому ферментативному гидролизу.
При кислотном и щелочном гидролизе сразу происходит глубокое расщепление до агликона и сахаров.
Слайд 52Схема гидролиза пурпуреагликозидов А и В:
Первичные СГ → вторичные СГ
→ агликоны
Пурпуреагликозид А → дигитоксин + глюкоза → дигитоксигенин +
3 дигитоксозыСлайд 53Схема гидролиза пурпуреагликозидов А и В:
Первичные СГ → вторичные СГ
→ агликоны
Пурпуреагликозид В → гитоксин + глюкоза → гитоксигенин +
3 дигитоксозыСлайд 54Схема гидролиза ланатозидов А, В, С и гликозидов подгруппы строфанта:
Первичные
СГ → вторичные СГ → третичные СГ → агликоны
Ланатозид А
→ ацетилдигитоксин + глюкоза → дигитоксин+СН3СООН → дигитоксигенин +3 дигитоксозыСлайд 55Схема гидролиза ланатозидов А, В, С и гликозидов подгруппы строфанта:
Первичные
СГ → вторичные СГ → третичные СГ → агликоны
Ланатозид В
→ ацетилгитоксин + глюкоза → гитоксин+СН3СООН → гитоксигенин +3 дигитоксозыСлайд 56Схема гидролиза ланатозидов А, В, С и гликозидов подгруппы строфанта:
Первичные
СГ → вторичные СГ → третичные СГ → агликоны
Ланатозид С
→ ацетилдигоксин + глюкоза → дигоксин+СН3СООН → дигоксигенин +3 дигитоксозыСлайд 57Схема гидролиза ланатозидов А, В, С и гликозидов подгруппы строфанта:
Первичные
СГ → вторичные СГ → третичные СГ → агликоны
К-строфантозид →
К-строфантин-β + α-глюкоза→ цимарин + β-глюкоза → строфантидин + цимарозаСлайд 60При выделении сердечных гликозидов используются органические растворители (этиловый, метиловый спирты),
которые не вызывают гидролиза сердечных гликозидов, а если нужно получать
не первичные, а вторичные гликозиды, то заранее проводят ферментативный гидролиз.Слайд 61Выделение сердечных гликозидов из растительного сырья можно разделить на следующие
этапы:
1) экстракция сердечных гликозидов из растительного сырья;
2) очистка полученного извлечения;
3)
разделение суммы сердечных гликозидов;4) перекристаллизация и выделение индивидуальных сердечных гликозидов.