Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кафедра физической химии Дисциплина Химия
Содержание
- 1. Кафедра физической химии Дисциплина Химия
- 2. План1. Общие свойства растворов.2. Давление насыщенного пара
- 3. 1. Общие свойства растворов.
- 4. Растворы – термодинамически устойчивые гомогенные системы переменного
- 5. По агрегатному состоянию растворы подразделяют нагазообразные, например воздухжидкие, например раствор солитвердые, например металлические и солевые сплавы.
- 6. Компоненты раствора с термодинамической точки зрения равноценны.
- 7. Свойства раствора существенно зависят от его состава.
- 8. Слайд 8
- 9. Слайд 9
- 10. Пример 1. 20 г хлорида калия растворили
- 11. б) Определяем число молей воды и хлорида
- 12. Для изучения растворов их подразделяют на идеальные
- 13. Коллигативными свойствами разбавленных растворов называются свойства растворов,
- 14. 2. Давление насыщенного пара над разбавленным раствором. Закон Рауля.
- 15. Представим, что в насыщенную систему жидкость —
- 16. Для идеальных растворов с нелетучим компонентом давление
- 17. Если растворенное вещество В нелетучее, то над
- 18. В разбавленном растворе nА >>nВ, следовательнороА -
- 19. Если растворенное вещество В летучее, тор1 =
- 20. 3. Понижение температуры замерзания и повышение температуры кипения раствора.
- 21. Сравним температуры замерзания и кипения раствора и чистого растворителя.
- 22. Температура кипения жидкости - это температура, при
- 23. Жидкость закипает при такой температуре, при которой
- 24. В присутствии растворенного вещества молекулам растворителя сложнее
- 25. В 1882 г. Рауль установил: повышение температуры
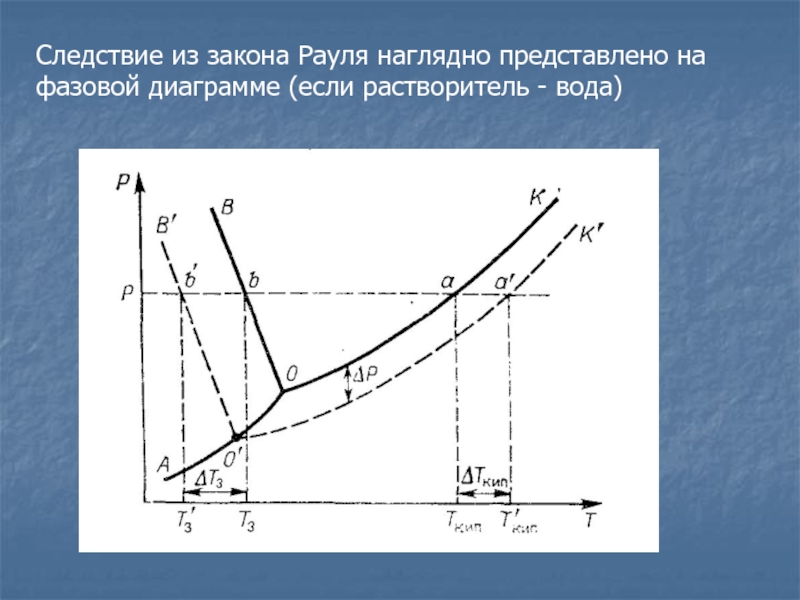
- 26. Следствие из закона Рауля наглядно представлено на фазовой диаграмме (если растворитель - вода)
- 27. Физический смысл эбулиоскопической и криоскопической констант. Если
- 28. Кэб и Ккр рассчитываются по формулам:
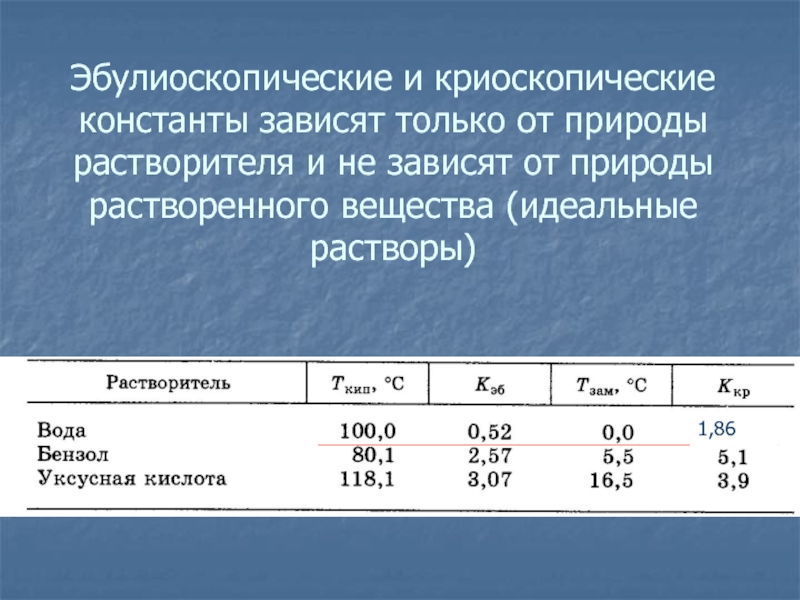
- 29. Эбулиоскопические и криоскопические константы зависят только от
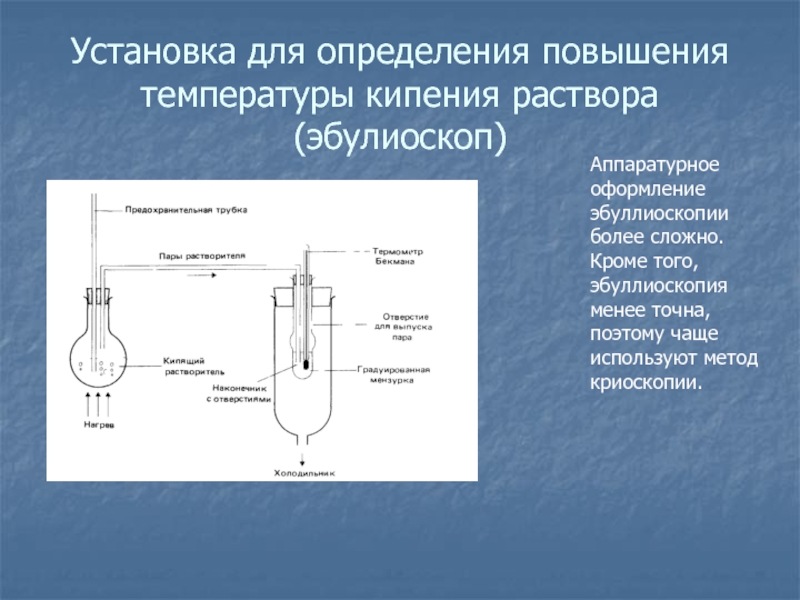
- 30. Установка для определения повышения температуры кипения раствора
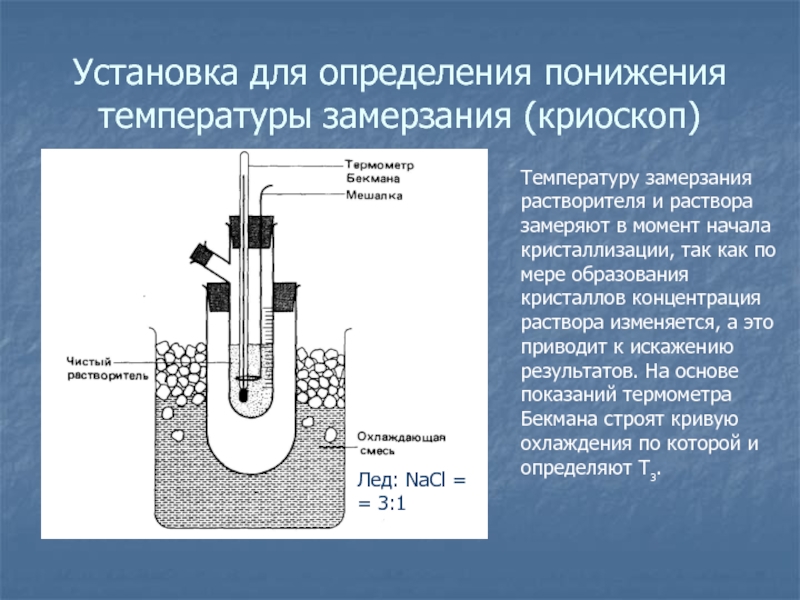
- 31. Установка для определения понижения температуры замерзания (криоскоп)Температуру
- 32. Молярные массы (кг/моль) растворенных веществ неэлектролитов могут
- 33. Применение:На понижении температуры замерзания жидкостей при растворении
- 34. 4. Осмотическое давление
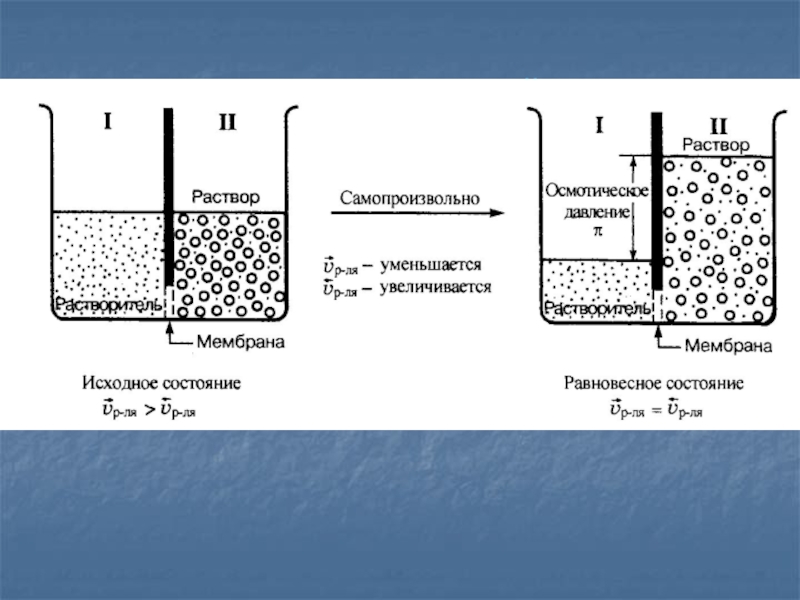
- 35. Осмос - самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью из растворителя в раствор.
- 36. Осмотическая ячейка
- 37. В начальный момент при осмосе скорости диффузии
- 38. Из-за этих различий через некоторое время, вследствие
- 39. Появляющееся избыточное гидростатическое давление в системе является
- 40. Вант-Гофф установил, что осмотическое давление разбавленных
- 41. ДЗ: термодинамический вывод закона Вант-Гоффа: с 86-87
- 42. Однако это уравнение Вант-Гоффа справедливо только для
- 43. Зная осмотическое давление можно рассчитать молярную массу вещества неэлектролитов.
- 44. Существуют два типа методов определения осмотического давления (осмометрии):Прямой методКосвенный метод
- 45. Прямой метод предполагает измерение осмотического давления при
- 46. Схема осмометра Беркели и Хартли 1 —
- 47. Часто применяют косвенные методы определения осмометрического давления – криометрический и метод плазмолиза.
- 48. Криометрический метод Для разбавленных растворов:где ρо- плотность растворителя, кг/л Тогда из следствия закона Рауля:
- 49. Подставив С(х) в уравнение Вант-Гоффа, получают выражение
- 50. Метод плазмолизаЕсли растительная клетка находится в контакте
- 51. В основе метода плазмолиза лежит подсчет процента
- 52. Действие слабительных средств - горькой соли MgS04
- 53. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Кафедра физической химии
Дисциплина «Химия»
Рягин Сергей Николаевич, д.п.н., профессор кафедры физической
химии, Почетный работник образования РФ
Слайд 2План
1. Общие свойства растворов.
2. Давление насыщенного пара над разбавленным раствором.
Первый Закон Рауля.
3. Понижение температуры замерзания и повышение температуры кипения
раствора. Второй закон Рауля4. Осмотическое давление.
Слайд 4Растворы – термодинамически устойчивые гомогенные системы переменного состава, состоящие их
двух и более компонентов.
Термодинамическая устойчивость заключается в том, что растворы
образуются самопроизвольно при Т,р = const (ΔG<0).Гомогенность обеспечивается равномерным распределением каждого компонента друг в друге в виде молекул, ионов, атомов.
Переменность состава означает, что состав раствора может непрерывно меняться в определенных пределах. От химических соединений растворы отличаются непостоянством состава и отсутствием кратных отношений.
Слайд 5По агрегатному состоянию растворы подразделяют на
газообразные, например воздух
жидкие, например раствор
соли
твердые, например металлические и солевые сплавы.
Слайд 6Компоненты раствора с термодинамической точки зрения равноценны. Компонент раствора, который
находится в избытке и имеет то же агрегатное состояние, что
и раствор называется растворителем, другой же компонент – растворенным веществом. Если один из компонентов – жидкость, а другой твердое вещество или газ, то растворителем считают жидкость.Слайд 7Свойства раствора существенно зависят от его состава. Поэтому важной количественной
величиной раствора является концентрация его компонентов.
Наиболее часто используются следующие способы
выражения концентрации:Массовая доля ω(х)
Молярная концентрация С(х)
Нормальная концентрация С(1/z х)
Молярная доля
Моляльность b(х)
Слайд 10Пример 1. 20 г хлорида калия растворили в 230 г
воды. Плотность раствора равна 1,05 г/см3. Выразить концентрацию раствора: а)
в процентах, б) в мольных долях, в) в моляльности, г) молярности.Решение, а) Процентный состав раствора будет равен:
Слайд 11б) Определяем число молей воды и хлорида калия (М(КСl)= 74,55)
в растворе: n(H2O)= 230 : 18 = 12,77 и n(КСl)
= 20 : 74,55 = 0,2682. Мольные доли находим по уравнению:;
в) В 230 г воды растворено 0,2682 моль КС1. Моляльность раствора (b) определяем по уравнению:
г) Объем 230 + 20 = 250 г раствора КС1 равен массе раствора, деленной на его плотность: V = 250 : 1,05 = 238,1 (мл).
Молярность раствора, т.е. число молей в одном литре раствора равна:
;
моль/л
Слайд 12Для изучения растворов их подразделяют на идеальные на основе которых
строят теоретические модели и реальные.
Идеальные – это растворы, при образовании
которых ΔН=0, ΔV=0, что возможно в случае одинаковых сил взаимодействия между частицами растворителя и раствора. Свойствами идеального раствора обладают лишь растворы оптически активных изомеров, смеси компонентов, различающиеся по изотопному составу. Из реальных растворов к идеальным близки предельно (бесконечно) разбавленные растворы - растворы, концентрация растворенного вещества которых б.м.
К ним относят
растворы газов в жидкости, с которыми они не взаимодействуют (азот в воде).
растворы, из веществ, молекулы которых сходны по полярности, строению и химическому составу (бензол - толуол, дибромэтилен-дибромпропилен и др.).
Слайд 13Коллигативными свойствами разбавленных растворов называются свойства растворов, не зависящие от
природы частиц растворенного вещества, а зависящие только от концентрации частиц
в растворе.К ним относят:
Понижение давления насыщенного пара растворителя над раствором;
Понижение температуры замерзания раствора;
Повышение температуры кипения раствора;
осмотическое давление.
Слайд 15Представим, что в насыщенную систему жидкость — пар введено нелетучее
вещество, переход которого в паровую фазу исключен . Растворение нелетучего
вещества будет затруднять испарение растворителя вследствие:уменьшения подвижности молекул растворителя за счет межмолекулярного взаимодействия растворитель - вещество;
уменьшения поверхности испарения, так как часть поверхности занята молекулами нелетучего вещества;
уменьшения концентрации молекул растворителя в растворе.
Следовательно, произойдет смещение равновесия в сторону жидкости, а давление насыщенного пара растворителя над раствором (р) всегда будет меньше давления насыщенного пара над чистым растворителем (р°).
Слайд 16Для идеальных растворов с нелетучим компонентом давление насыщенного пара определяется
законом Рауля (1886г):
парциальное давление компонента идеального раствора равно давлению чистого
компонента, умноженного на его мольную долю Слайд 17
Если растворенное вещество В нелетучее, то над раствором присутствуют только
пары растворителя А, а следовательно по закону Рауля: р =
роА χАТак как в растворе присутствует вещество В, то χА < 1, а следовательно рА< роА
Присутствие вещества В обуславливает: χА= 1- χВ
рА = роА ( 1- χВ) = роА - роА χВ
рА - роА = - роА χВ
роА - рА/ роА = χВ
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе.
Слайд 18В разбавленном растворе nА >>nВ, следовательно
роА - р / роА
= nВ/ nА = mВМА/ mАМВ
Если известны массы растворенного вещества
и растворителя, а также молярная масса растворителя, то можно рассчитать молярную массу растворенного вещества В. МВ= mВМА роА/mА (роА – рА)
Слайд 19Если растворенное вещество В летучее, то
р1 = р1о χ1 ;
р2
= р2о χ2 ;
р = р1+р2 = р1о χ1 +
р2о χ2 Графически зависимости
выражаются прямыми линиями. Зависимость общего давления насыщенного пара над раствором от концентрации (молярной доли) вещества выражается прямой линией, не проходящей через начало координат
Слайд 22Температура кипения жидкости - это температура, при которой давление насыщенного
пара над жидкостью становится равным внешнему давлению.
Температура замерзания жидкости -
это температура, при которой давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над кристаллами этой жидкости.Слайд 23Жидкость закипает при такой температуре, при которой давление насыщенного пара
выравнивается с внешним: р=рвнеш
Поскольку растворенное вещество снижает давление насыщенного пара
растворителя, требуется большая температура, чтобы это давление сравнялось с внешним, т.е. присутствие растворенного вещества повышает температуру кипения раствора. Слайд 24В присутствии растворенного вещества молекулам растворителя сложнее образовывать гомогенные кристаллы
твердой фазы, поэтому требуется более сильное понижение температуры. Т.о. присутствие
растворенного вещества понижает температуру замерзания раствора.Слайд 25В 1882 г. Рауль установил:
повышение температуры начала кипения ∆Ткип
и понижение температуры начала кристаллизации ∆Тз раствора пропорциональна моляльности раствора
(b(х))где Кэб и Ккр – эбулиоскопическая (эбулиометрическая) и криоскопическая (криометрическая) константы, значения которых зависят только от природы растворителя.
Слайд 26Следствие из закона Рауля наглядно представлено на фазовой диаграмме (если
растворитель - вода)
Слайд 27Физический смысл эбулиоскопической и криоскопической констант. Если принять b(х)=1 моль/1000г,
то Кэб =∆Ткип и Ккр =∆Тзам , т.е. константы численно
равны повышению температуры кипения или, соответственно, понижению температуры замерзания одномоляльного идеального раствора (1 моль вещества в 1000 г растворителя) нелетучего вещества по сравнению с чистым растворителем.Слайд 29Эбулиоскопические и криоскопические константы зависят только от природы растворителя и
не зависят от природы растворенного вещества (идеальные растворы)
1,86
Слайд 30Установка для определения повышения температуры кипения раствора (эбулиоскоп)
Аппаратурное оформление эбуллиоскопии
более сложно. Кроме того, эбуллиоскопия менее точна, поэтому чаще используют
метод криоскопии.Слайд 31Установка для определения понижения температуры замерзания (криоскоп)
Температуру замерзания растворителя и
раствора замеряют в момент начала кристаллизации, так как по мере
образования кристаллов концентрация раствора изменяется, а это приводит к искажению результатов. На основе показаний термометра Бекмана строят кривую охлаждения по которой и определяют Тз.Лед: NaCl = = 3:1
Слайд 32Молярные массы (кг/моль) растворенных веществ неэлектролитов могут быть рассчитаны по
следующим формулам:
М= Кэб mрв/ ∆Тк m р-ль
М= Ккр mрв/ ∆Тз
m р-льгде m рв — масса растворенного вещества, г; m р-ль — масса растворителя, г; ∆Тз — понижение температуры замерзания и ∆Тк — повышение температуры кипения, определенные экспериментально, К;
Слайд 33Применение:
На понижении температуры замерзания жидкостей при растворении в них нелетучих
веществ основано действие антифризов – веществ, добавление которых к охлажденной
воде в радиаторах автомобилей снижает температуру ее замерзания и предотвращает возможность «замораживания» двигателей. Хладагенты, применяемые в фарм. технологии для доставки «холода» к теплообменникам, - обычно растворы каких-либо солей в воде, фреоны, хладоны, тасолы и т.д.В лабораторной практике фармации измерение температур кипения и замерзания растворов лежит в основе эбулиометрического и криометрического методов определения
молярных масс веществ неэлектролитов (эбулиометрия и криометрия);
концентрацию растворенного вещества при известной его молярной массе;
чистоту органического соединения.
Слайд 35Осмос - самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной
проницаемостью из растворителя в раствор.
Слайд 37В начальный момент при осмосе скорости диффузии молекул растворителя через
мембрану от растворителя к раствору и от раствора к растворителю
будут различными вследствие:неодинаковой концентрации растворителя в разделенных частях системы, ;
большей площади поверхности мембраны, свободной от частиц растворенного вещества со стороны чистого растворителя sI , чем со стороны раствора s II, где часть поверхности мембраны занята частицами растворенного вещества, т. е. sI > sII;
большей подвижности молекул растворителя в чистом растворителе, чем в растворе, где есть межмолекулярное взаимодействие между веществом и растворителем, уменьшающее подвижность молекул растворителя.
Слайд 38Из-за этих различий через некоторое время, вследствие уменьшения разности концентрации
растворителя в разделенных частях системы и появления избыточного гидростатического давления
со стороны раствора, скорости диффузии растворителя будут изменяться по-разному: уменьшаться и увеличиваться. Это обстоятельство обязательно приведет к наступлению в системе состояния динамического физико-химического равновесия, характеризующегося равенством скоростей диффузии молекул растворителя через мембрану .Слайд 39Появляющееся избыточное гидростатическое давление в системе является следствием осмоса, поэтому
это давление называется осмотическим.
Осмотическим давлением
называют избыточное гидростатическое давление, возникающее
в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.Слайд 40 Вант-Гофф установил, что осмотическое давление разбавленных растворов подчиняется законам
идеальных газов.
Эмпирический закон Вант-Гофа: осмотическое давление разбавленного раствора численно
равно тому давлению, которое производило бы данное количество растворенного вещества, если бы оно находилось в газообразном состоянии при заданной температуре и занимало объем, равный объему раствора. Из этого уравнения видно, что осмотическое давление не зависит от природы растворенного вещества, а зависит только от числа частиц в растворе и от температуры.
Слайд 42Однако это уравнение Вант-Гоффа справедливо только для растворов, в которых
отсутствует взаимодействие частиц, т. е. для идеальных растворов. В реальных
растворах имеют место межмолекулярные взаимодействия между молекулами вещества и растворителя, которые могут приводить или к диссоциации молекул растворенного вещества на ионы, или к ассоциации молекул растворенного вещества с образованием из них ассоциатов.Слайд 44Существуют два типа методов определения осмотического давления (осмометрии):
Прямой метод
Косвенный метод
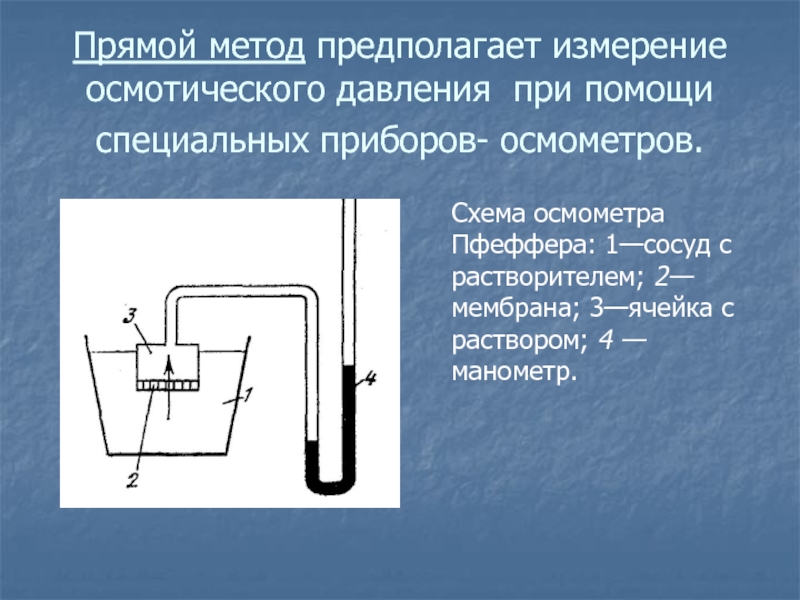
Слайд 45Прямой метод предполагает измерение осмотического давления при помощи специальных приборов-
осмометров.
Схема осмометра Пфеффера: 1—сосуд с растворителем; 2— мембрана; 3—ячейка
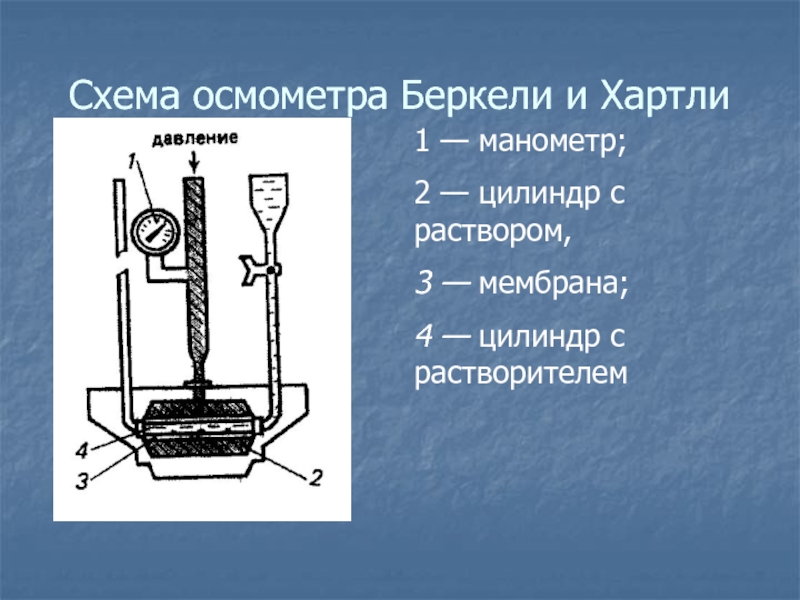
с раствором; 4 — манометр. Слайд 46Схема осмометра Беркели и Хартли
1 — манометр;
2 —
цилиндр с раствором,
3 — мембрана;
4 — цилиндр с
растворителемСлайд 47Часто применяют косвенные методы определения осмометрического давления – криометрический и
метод плазмолиза.
Слайд 48Криометрический метод
Для разбавленных растворов:
где ρо- плотность растворителя, кг/л
Тогда из следствия закона Рауля:
Слайд 49Подставив С(х) в уравнение Вант-Гоффа, получают выражение для расчета осмотического
давления по понижению температуры замерзания раствора:
Приведенные расчеты свидетельствуют о тесной
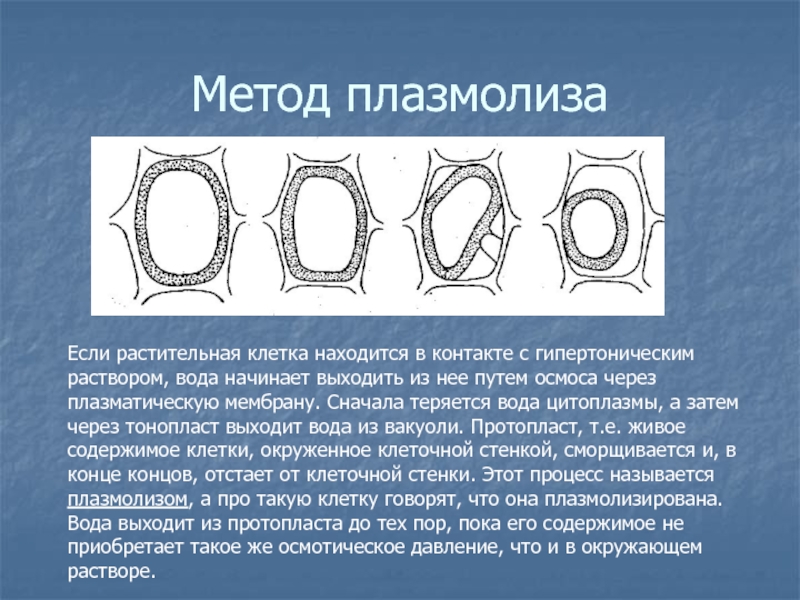
взаимосвязи коллигативных свойств Слайд 50Метод плазмолиза
Если растительная клетка находится в контакте с гипертоническим раствором,
вода начинает выходить из нее путем осмоса через плазматическую мембрану.
Сначала теряется вода цитоплазмы, а затем через тонопласт выходит вода из вакуоли. Протопласт, т.е. живое содержимое клетки, окруженное клеточной стенкой, сморщивается и, в конце концов, отстает от клеточной стенки. Этот процесс называется плазмолизом, а про такую клетку говорят, что она плазмолизирована. Вода выходит из протопласта до тех пор, пока его содержимое не приобретает такое же осмотическое давление, что и в окружающем растворе.Слайд 51В основе метода плазмолиза лежит подсчет процента плазмолизированных клеток в
растворах с разной молярной концентрацией. Строится график, отложив по вертикальной
оси процент плазмолизированных клеток, а по горизонтальной – молярная концентрация раствора. По графику определите молярную концентрацию раствора, при котором плазмолизируется 50% клеток. Определив температуру в лаборатории при помощи термометра. По формуле определить среднее осмотическое давление в растительной клетки.Росм = См RТ,