Слайд 1КАФЕДРА ОХТ
Основы химической технологии
Химические процессы
Слайд 3Классификация химических процессов
Тип химической реакции: некаталитические и
каталитические.
Гомогенные реакции (однофазный процесс)
Гетерогенные реакции (многофазный процесс)
Состояние фаз: газ, жидкость,
твердое.
Тепловой эффект: экзотермические и эндотермические
Обратимость: необратимые и обратимые.
Схема превращения:
- простая реакция
- сложная реакция: параллельная схема
последовательная схема
комбинированная схема
Слайд 4 Одна из основных задач химической технологии – выбор условий
проведения процесса с целью получения максимального выхода продукта. При этом
приходится учитывать два момента:
выбор условий получения максимально возможного теоретического выхода продукта, что определяется термодинамическими закономерностями;
выбор условий увеличения скорости процесса с целью его приближения к состоянию равновесия, а это зависит от кинетических закономерностей.
Слайд 5 Условием равновесия при постоянных Т и р
служит минимум энергии Гиббса dG= 0.
В случае отсутствия табличных значений
ΔG их рассчитывают, используя уравнение
ΔG° =ΔH° -TΔS° ,
где ΔН°, ΔS° — стандартные изменения энтальпии и энтропии.
Для протекания реакции слева направо благоприятны большие отрицательные значения Н° (т. е. значительный тепловой эффект и большие положительные значения So (возрастание энтропии).
ТЕРМОДИНАМИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
Слайд 6 Стандартная энергия Гиббса является характерной для реакции
постоянной величиной.
Она связана с константой равновесия Кр уравнением:
G° = -RTlnKр. (1)
Уравнение (1) называется уравнением изотермы Вант-Гоффа.
Порядок и знак величины ΔG° позволяют качественно предвидеть положение равновесия реакции.
Если ΔG° О, равновесие сдвинуто вправо, выход продукта велик, а константа равновесия имеет большое числовое значение.
Если ΔG° 0, равновесие сдвинуто влево, выход продукта мал, Кр< 1.
Слайд 7Определение состава реакционной смеси при химическом равновесии.
Для газовой реакции типа
А ↔ 2R.
После установления равновесия на 1 моль
введенного вещества реакционная смесь будет содержать (1 — хАе) моль реагента А и 2 хАе моль продукта R. Всего в равновесном состоянии будет находиться 1 — хАе + 2 хА е = 1 + хА е моль. Если общее давление системы в момент равновесия равно р, тогда:
Поскольку не существует уравнений непосредственно связывающих равновесную степень превращения и технологические параметры процесса (Т,Р,С), рассматривают влияние этих параметров на константу равновесия, помня, что с ростом константы равновесия будет расти и равновесная степень превращения и наоборот.
Слайд 8Способы смещения равновесия
Положение равновесия всегда зависит от внешних условий, а
так как внешние условия не могут сохраняться неизменными, то равновесие
рано или поздно нарушается (смещается).
Влияние изменения внешних условий на положение равновесия — принцип смещения равновесия или принцип Ле Шателье, можно сформулировать следующим образом:
если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое нибудь из условий, определяющих положение равновесия, тогда в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
Слайд 9Зависимость константы равновесия от температуры
Функциональная зависимость константы равновесия от температуры
при постоянном давлении передается уравнением изобары Вант-Гоффа
(2)
где ΔН° — изменение энтальпии при стандартном состоянии.
После интегрирования данного уравнения получаем:
(3)
Изменение константы равновесия, а, следовательно, и равновесной степени превращения зависит от энтальпии реакции.
1) ΔН >0 (эндотермическая реакция) Т↑, Кр↑, хАе↑
2) ΔН <0 (экзотермическая реакция) Т↑, Кр ↓, хАе ↓
Слайд 10Влияние давления. Чувствительность положения равновесия к изменениям давления тем больше,
чем большим изменением объема ΔV (или Δn) сопровождается тот или
иной процесс. Значительные изменения объема могут происходить только в реакциях, в которых участвуют газы, или в тех случаях, когда хотя бы один из компонентов находится в газообразном состоянии. Количественная оценка влияния давления на состояние равновесия дается уравнением (4).
После интегрирования получим:
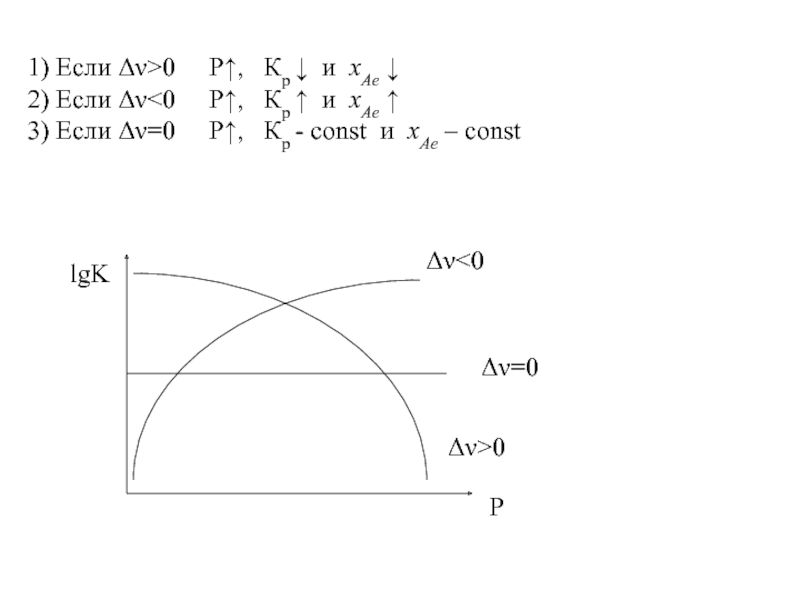
Слайд 111) Если Δν>0 Р, Кр и
хАе ↓
2) Если Δν0 Р, Кр и хАе
3) Если Δν=0 Р, Кр - const и хАе – const
Δν<0
Δν=0
Δν>0
lgK
P
Слайд 12Влияние инертного газа.
Влияние концентрации.
Слайд 13КИНЕТИЧЕСКИЕ ЗАКОНОМЕРТОСТИ
Скорость гомогенных химических реакций
Скорость превращения вещества wi определяется количеством
вещества, превратившегося в единицу времени в единице реакционного пространства.
(V =
const)
или
Скорости реакции, определенные по изменению количества различных реагентов количественно различаются между собой.
Слайд 14Зависимость скорости химических реакций от концентрации реагентов.
Законы химической кинетики
основаны на двух простых принципах (постулатах):
скорость химической реакции пропорциональна
концентрациям реагентов;
суммарная скорость нескольких последовательных превращений, значительно различающихся по скорости, определяется скоростью наиболее медленной стадии.
Слайд 15Простая необратимая реакция
Зависимость скорости реакции от концентрации для необратимой реакции типа
А R имеет вид где ( п - порядок реакции; С - концентрация исходного вещества.), рис.а
От порядка реакции зависит темп возрастания скорости с концентрацией (выше для реакции более высокого порядка).
Если концентрацию компонента А выразить через степень его превращения х = (Со – С)/Cо, получим зависимость
Рис б.
Слайд 16
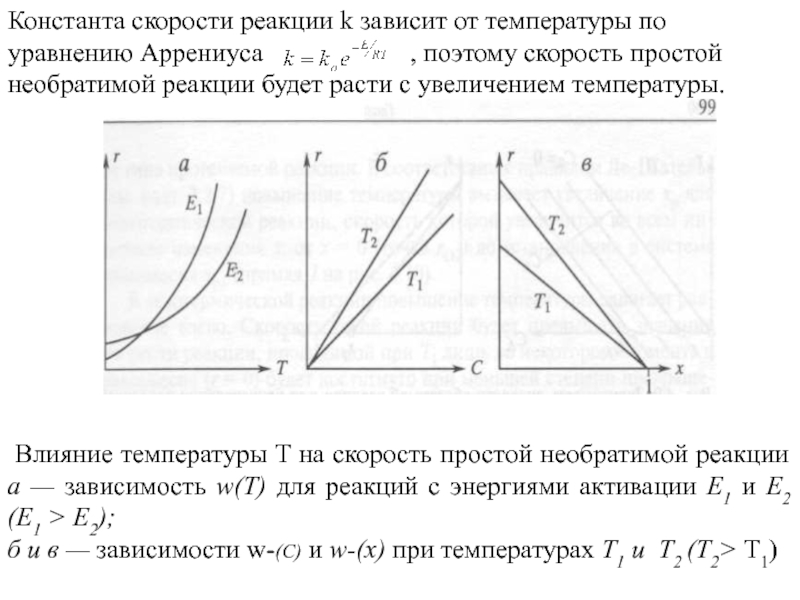
Константа скорости реакции k зависит от температуры по уравнению Аррениуса
, поэтому скорость простой необратимой реакции будет расти с увеличением температуры.
Влияние температуры T на скорость простой необратимой реакции а — зависимость w(T) для реакций с энергиями активации Е1 и Е2 (Е1 > Е2);
б и в — зависимости w-(C) и w-(х) при температурах Т1 и Т2 (Т2> Т1)
Слайд 17 Повышение температуры обуславливает интенсификацию процесса
(увеличение скорости) для необратимой реакции.
Слайд 18
Обратимая реакция
А R
где r1 и r2 скорости прямой
и обратной реакции.
Скорости обеих элементарных стадий растут с ростом температуры, но с разной скоростью, в результате скорость обратимых реакций проходит через максимум.
На графиках приведено влияние температуры на скорость обратимой экзотермической реакции
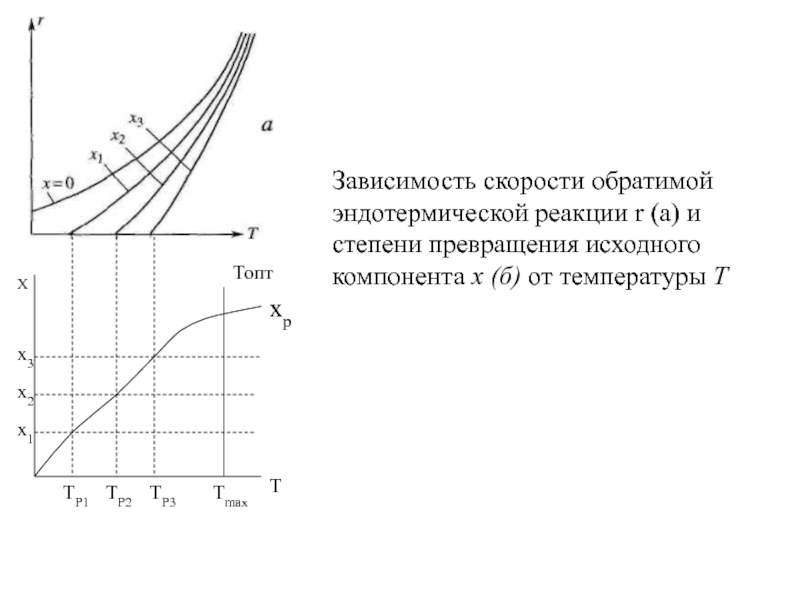
Слайд 19Х
Топт
Тmax
ТР3
ТР2
ТР1
хр
х3
х2
х1
Т
Зависимость скорости обратимой эндотермической реакции r (а) и степени превращения
исходного компонента х (б) от температуры Т
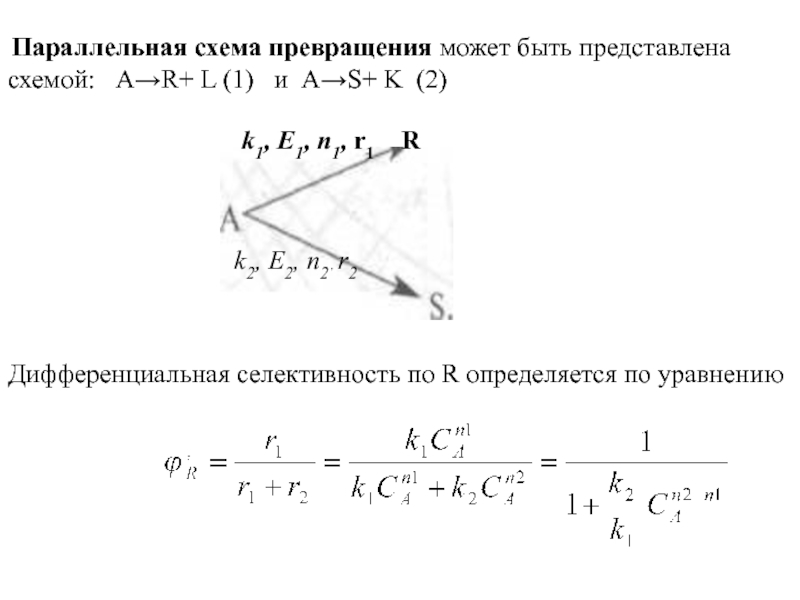
Слайд 20 Параллельная схема превращения может быть представлена схемой: АR+
L (1) и АS+ K (2)
k1, E1, n1, r1 R
k2, Е2, п2 , r2
Дифференциальная селективность по R определяется по уравнению
Слайд 213) Если n1 < п2. Тогда, п2 — n1 >
0, и с ростом концентрации СА увеличивается CAn2-n1, а, следовательно,
будет уменьшаться и φ 'R, асимптотически приближаясь к нулю (кривая n2< n1 на рис). В этом случае с увеличением СА доля образования R в общем превращения исходного вещества уменьшается.
Если порядок частных реакций одинаков (п1 = п2),
то φ'R = k1/(k1 + k2) и φ"R не зависит от концентрации А
(прямая пх — п2 на рис.).
2) Если п1 > п2. Поскольку п1 - п2 > 0, то с ростом концентрации СA, СAn2-n1 уменьшается и, соответственно, дифференциальная селективность по R растет, асимптотически приближаясь к единице (кривая п1 > п2 на рис.).
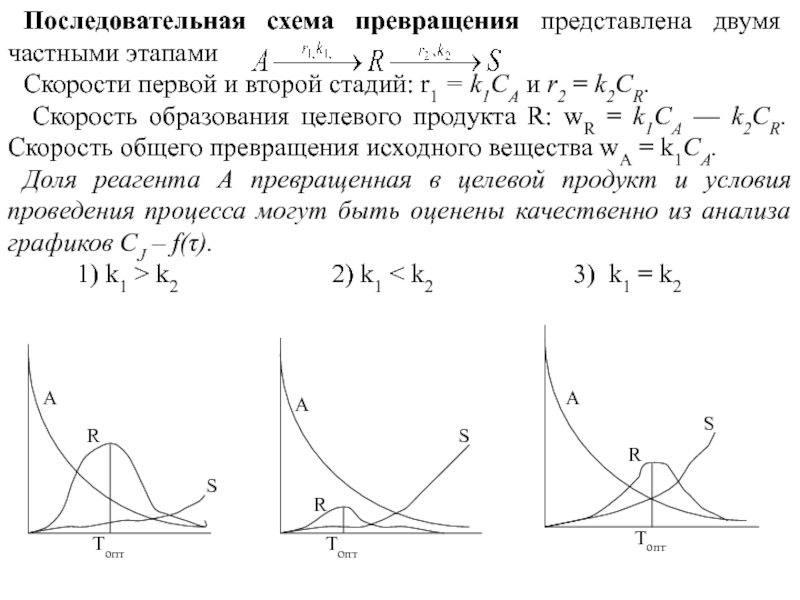
Слайд 22Последовательная схема превращения представлена двумя частными этапами
Скорости первой и
второй стадий: r1 = k1СА и r2 = k2CR.
Скорость
образования целевого продукта R: wR = k1СА — k2CR. Скорость общего превращения исходного вещества wA = k1СА.
Доля реагента А превращенная в целевой продукт и условия проведения процесса могут быть оценены качественно из анализа графиков CJ – f(τ).
1) k1 > k2 2) k1 < k2 3) k1 = k2
S
А
А
А
R
R
R
S
S
Топт
Топт
Топт
Слайд 24Большинство химических реакций, используемых в химико-технологических процессах, протекают с участием
веществ, находящихся в разных фазах. Такие процессы называются гетерогенными.
Характерной
чертой гетерогенного процесса является его многостадийность, то есть наряду с одной или несколькими стадиями химических реакций протекают диффузионные стадии, связанные с подводом реагентов в зону реакции и отводом продуктов в результате диффузии.
ОБЩАЯ ХАРАКТЕРИСТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ
Слайд 25По виду участвующих в процессе фаз различают следующие гетерогенные системы:
а)
«газ-твердое» (к этому типу процессов относятся адсорбция и десорбция газов,
обжиг руд, окисление металлов, восстановление твердых оксидов, горение твердых топлив);
б) «жидкость-твердое» (адсорбция, растворение, выщелачивание, экстракция, кристаллизация);
в) «газ-жидкость» (абсорбция, конденсация, перегонка жидких смесей, дистилляция и ректификация);
г) «жидкость-жидкость» - несмешивающиеся жидкости (жидкостная экстракция);
д) система «твердое-твердое» (спекание, процессы получения цемента и керамики, высокотемпературный синтез неорганических материалов);
е) многофазные системы – «газ-жидкость-твердое».
Слайд 26Под скоростью гетерогенного химического процесса понимают количество в молях NJ
одного из реагентов или продуктов реакции, которое прореагировало или образовалось
в единицу времени отнесенное к единице поверхности раздела фаз.
Слайд 27ПОНЯТИЕ ЛИМИТИРУЮЩЕЙ СТАДИИ
Рассмотрим в общем виде максимально упрощенную модель какого-то
гетерогенного процесса.
Он протекает как минимум в две стадии, одна
их которых – массоперенос распределяемого вещества А (например газ) из одной фазы в другую (например жидкость или твердое) , а вторая стадия - химическая реакция:
Аг + Втв = Сг.
Слайд 28Скорость диффузионной стадии
wм=β(САо -САi) ,
где САо и САi
– концентрации распределяемого реагента А в потоке (начальная) и на
поверхности второго вещества
Скорость химической реакции на поверхности реагента В
wx.p.= k САi ,
так как концентрация вещества Втв будет постоянна, пока есть твердая частица.
Хотя скорости каждой элементарной стадии процесса могут быть различны, при протекании процесса в стационарном состоянии они, очевидно, должны быть равны.
Тогда wx.p= wпроцесса .
β (САо -САi) .= k САi, откуда САi = β САо /(β +k)
Слайд 29САо – движущая сила процесса
Если k β , то
kгет.= β, а
- скорость процесса – f(β) – говорят, что процесс лежит в диффузионной области.
Если β k , то kгет.= k , а - скорость процесса – f(k) – говорят, что процесс лежит в кинетической области.
Если скорости всех стадий соизмеримы, между собой, т.е. k β, то - гетерогенный процесс протекает в переходной области.
, где
Слайд 30Лимитирующая стадия
– это стадия определяющая скорость всего гетерогенного процесса,
характеризующаяся максимальной движущей силой и минимальным коэффициентом интенсивности.
Можно встретить определение
лимитирующей стадии как самой медленной стадии. Но в стационарном режиме скорости всех стадий равны.
Слайд 31ГЕТЕРОГЕННЫЕ НЕКАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ
ВЕЩЕСТВО»
Наиболее общим случаем является гетерогенная реакция, в которой и
среди реагентов, и среди продуктов есть и газообразные, и твердые вещества:
аA(газ) + вB(тв) = rR(тв) + sS(газ).
К такому типу реакций относится, например, процесс обжига железного колчедана:
11O2 + 4FeS2 = 2Fe2O3 + 8SO2.
Возможны также реакции, в которых отсутствует или газообразный продукт: а A(газ) + вB(тв) = RR(тв),
например O2 + 2Zn = 2ZnO,
или твердый продукт: а A(газ) + вB(тв) = sS(газ),
например O2 + C = CO2,
или газообразный реагент вB(тв) = rR(тв) + sS(газ),
например CaCO3 = CaO + CO2.
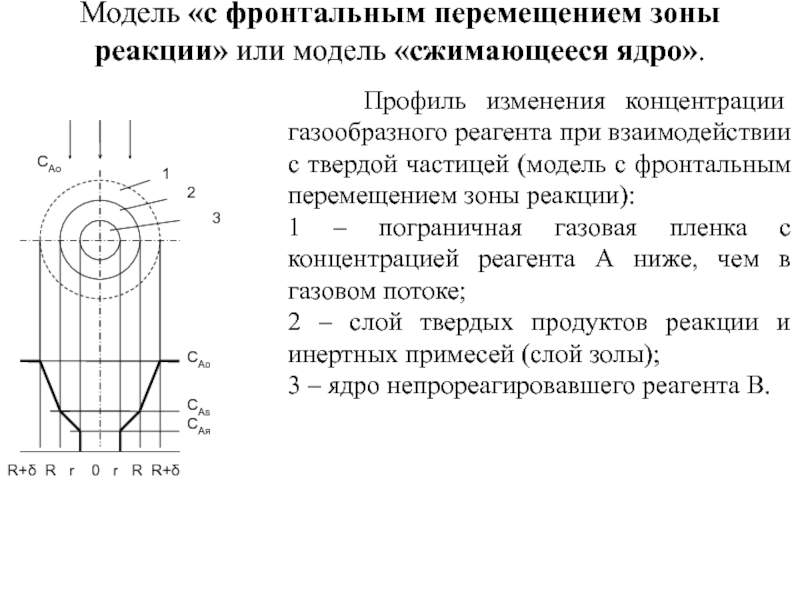
Слайд 32Модель «с фронтальным перемещением зоны реакции» или модель «сжимающееся ядро».
R+δ
R r 0 r R R+δ
CAо
1
2
3
СAo
CAs
CAя
Профиль изменения концентрации газообразного реагента при взаимодействии с твердой частицей (модель с фронтальным перемещением зоны реакции):
1 – пограничная газовая пленка с концентрацией реагента А ниже, чем в газовом потоке;
2 – слой твердых продуктов реакции и инертных примесей (слой золы);
3 – ядро непрореагировавшего реагента В.
Слайд 33Гетерогенный процесс, описываемый моделью с фронтальным перемещением зоны реакции, можно
разделить на пять основных стадий:
1 – внешняя диффузия;
2 –
внутренняя диффузия;
3 – химическая реакция на поверхности непрореагировавшего ядра;
4 – обратная внутренняя диффузия газообразных продуктов реакции через слой твердых продуктов;
5 – обратная внешняя диффузия газообразных продуктов через пограничную газовую пленку в ядро газового потока.
Стадии 1,5 и 2,4 невозможно рассматривать отдельно одна от другой, поэтому реально надо рассматривать три стадии процесса
Слайд 34Скорости отдельных стадий имеют вид:
- для стадии внешней диффузии
- для стадии внутренней диффузии
- для стадии химическая реакция
После преобразования получим:
Почленно сложим левые, а затем правые части преобразованных уравнений и с учетом равенства скоростей всех стадий получим
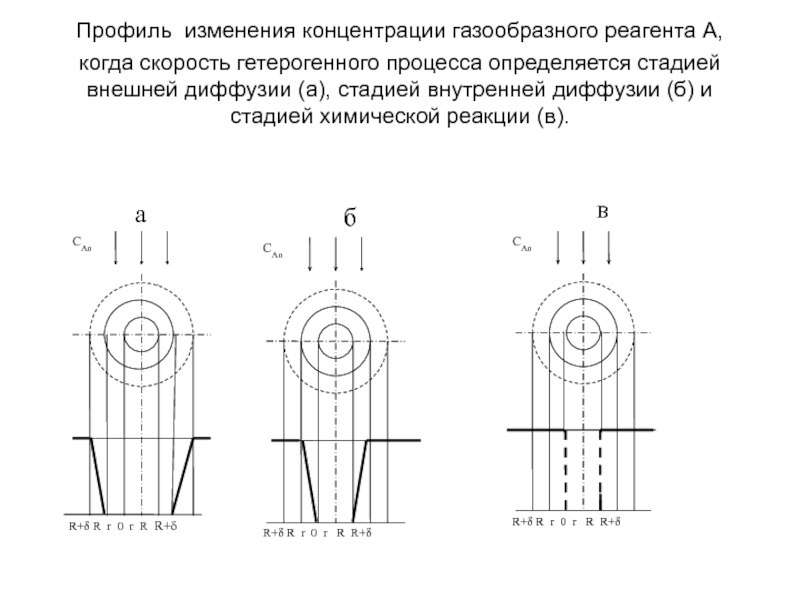
Слайд 35Профиль изменения концентрации газообразного реагента А, когда скорость гетерогенного процесса
определяется стадией внешней диффузии (а), стадией внутренней диффузии (б) и
стадией химической реакции (в).
в
б
а
Слайд 36МАТЕМАТИЧЕСКАЯ МОДЕЛЬ ПРОЦЕССА
C + CO2 = 2CO
ЛИМИТИРУЮЩАЯ СТАДИЯ – ВНЕШНЯЯ
ДИФФУЗИЯ
Слайд 37Но
Тогда
Для внутридиффузионной области
Для
кинетической области
Слайд 38СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ
СТАДИИ
Если известны коэффициенты массоотдачи β и β’и константа
скорости ks, то, сравнивая их числовые значения, можно определить, есть
ли в данных условиях проведения гетерогенного процесса лимитирующая стадия, и если она есть, то какая именно.
Слайд 391-ая группа. Методы, основанные на изучении влияния параметров гетерогенного процесса
на его скорость.
Лимитирующую стадию можно экспериментально определить, изучая зависимость
скорости гетерогенного процесса от температуры T, линейной скорости газового потока U и степени измельчания 1/R.
Константа скорости ks экспоненциально увеличивается с ростом температуры, в то время как коэффициенты массоотдачи на диффузионных стадиях β и β` зависят от температуры лишь очень слабо (~T1/2). Следовательно, если при постоянстве линейной скорости потока U и размера частиц R с увеличением температуры наблюдается резкий рост скорости процесса, то он очевидно протекает в кинетической области.
Слайд 40Зависимость скорости гетерогенного процесса от температуры можно охарактеризовать температурным коэффициентом
скорости Т, который показывает во сколько раз возрастет скорость процесса
при увеличении температуры на 10оС. Значение Т рассчитывается по формуле
,
где (WA)T2 и (WA)T1 – скорость процесса при температурах Т2 и Т1 соответственно, причем Т2Т1.
Зная величину Т, можно сделать вывод, в какой области, кинетической или диффузионной, протекает процесс.
Если Т находится в пределах 2 – 4, то есть соответствует температурному коэффициенту скорости химической реакции, то процесс протекает в кинетической области.
При Т = 1,4 – 2 будем считать, что процесс идет в переходной области, а
значение Т = 1,0 – 1,4 характерно для диффузионных процессов.
Слайд 412-ая группа.
Методы, основанные на сравнении экспериментальных и теоретических зависимостей ХВ().
Эта группа методов основана на сравнении экспериментально полученной кинетической зависимости
степени превращения твердого реагента от времени пребывания в реакторе Хв() и теоретических зависимостей Хв() для разных областей протекания гетерогенного процесса.
Теоретические зависимости Хв() имеют вид:
для внешнедиффузионной области
Хв = / п,
для внутреннедиффузионной области зависимость Хв() определяется функцией
1 – /п = 3(1 - Хв)2/3 – 2(1 - Хв),
для кинетической области
Хв = 1 - (1 – / п)3,
п – время полного превращения твердой частицы при(Хв=1).
Слайд 42ПУТИ ИНТЕНСИФИКАЦИИ ГЕТЕРОГЕННОГО ПРОЦЕССА ГАЗ-Тв. ПРИ НАЛИЧИИ ЛИМИТИРУЮЩЕЙ СТАДИИ
Если процесс
лежит во внешнедиффузионной области основными путями интенсификации являются: увеличение скорости
газового потока; увеличение концентрации компонента А в газе;
Если процесс лежит во внутридиффузионной области основными путями интенсификации являются: уменьшение размеров твердой частицы (интенсивное перемешивание твердых частиц с целью уменьшения слоя золы); увеличение концентрации компонента А в газе;
Если процесс лежит в кинетической области основными путями интенсификации являются: увеличение температуры процесса; увеличение концентрации компонента А в газе;
Слайд 44Катализаторы — это вещества, которые, многократно вступая в промежуточное взаимодействие
с участниками реакции, изменяют ее механизм и увеличивают скорость реакции.
Они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий
Ингибиторы – вещества замедляющие скорость химических реакций.
Инициаторы – вещества, добавляемые в небольшом количестве для начала химической реакции (часто используются для зарождения цепных реакций), расходуемые в процессе ее протекания.
Слайд 45- увеличивают скорость химических реакций
- позволяют осуществить реакции не
реализуемые без катализатора;
- позволяют увеличить скорость одной из не скольких
одновременно идущих реакций;
- позволяет понизить температуру
проведения процесса.
ПРЕИМУЩЕСТВА КАТАЛИТИЧЕСКИХ
ПРОЦЕССОВ
Слайд 46ВИДЫ КАТАЛИЗА
Гетерогенный катализ
Гомогенный катализ
Ферментативный катализ
Авто катализ
Слайд 47ОСОБЕННОСТИ ПРОВЕДЕНИЯ ГОМОГЕННО -КАТАЛИТИЧЕСКИХ РЕАКЦИЙ
А + В + КАТ =
R
WA = CA CB CКАТ
Пути управления и интенсификации гомогенно-каталитических процессов
те же самые, что и для некаталитических процессов
Слайд 48ОСОБЕННОСТИ ПРОВЕДЕНИЯ ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИХ РЕАКЦИЙ
Наибольшее распространение в промышленности получили гетерогенно-каталитические
процессы.
При протекании подавляющего большинства гетерогенно-каталитических процессов границей раздела фаз служит
поверхность твердого катализатора, находящегося в газообразной или жидкой реакционной среде.
Существенным преимуществом таких процессов является простота разделения продуктов реакции и частиц катализатора, что позволяет использовать его многократно.
Слайд 49Твердые катализаторы — это, как правило, высокопористые вещества с развитой
внутренней поверхностью, характеризующиеся определенной пористой и кристаллической структурой, активностью, селективностью
и рядом других технологических характеристик.
Слайд 50Некоторые характеристики твердых катализаторов
АКТИВНОСТЬ КАТАЛИЗАТОРА
Активность катализатора — мера ускоряющего воздействия
по отношению к данной реакции.
В связи с большим разнообразием каталитических
процессов не существует единого количественного критерия активности. Это связано с тем, что применение различных катализаторов даже для одной и той же химической реакции может по-разному изменить ее механизм. Как правило, применение катализатора приводит к изменению и порядка реакции, и энергии активации, и предэкспоненциального множителя.
Слайд 51ТЕМПЕРАТУРА ЗАЖИГАНИЯ
Температура зажигания — это минимальная температура, при которой технологический
процесс начинает идти с достаточной для практических целей скоростью.
Понятие «зажигание»
означает, что при возрастании температуры выше предельной происходит резкое, скачкообразное увеличение скорости реакции. С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания, что позволяет снизить энергетические затраты на предварительный нагрев реакционной смеси.
Слайд 52Селективность катализатора
Селективностью или избирательностью катализатора называют его способность избирательно ускорять
целевую реакцию при наличии нескольких побочных.
4NH3+ 5O2 = 4NO +
6H2O целевая реакция
4NH3+ 3O2 = 2N2 + 6H2O
4NH3+ 4O2 = 2N2O + 6H2O
Слайд 53ОТРАВЛЯЕМОСТЬ КАТАЛИЗАТОРА
Отравляемость катализатора - это потеря его активности под воздействием
химических веществ.
Отравляемость бывает обратимой и необратимой
При обратимом отравлении активность
катализатора постепенно восстанавливается, после удаления из реакционной смеси каталитического яда.
При необратимом отравлении активность восстановить не удается