формула
R C
ОН
О
Сn Н2n+1С
Или для предельных одноосновных кислот
О
ОН
?
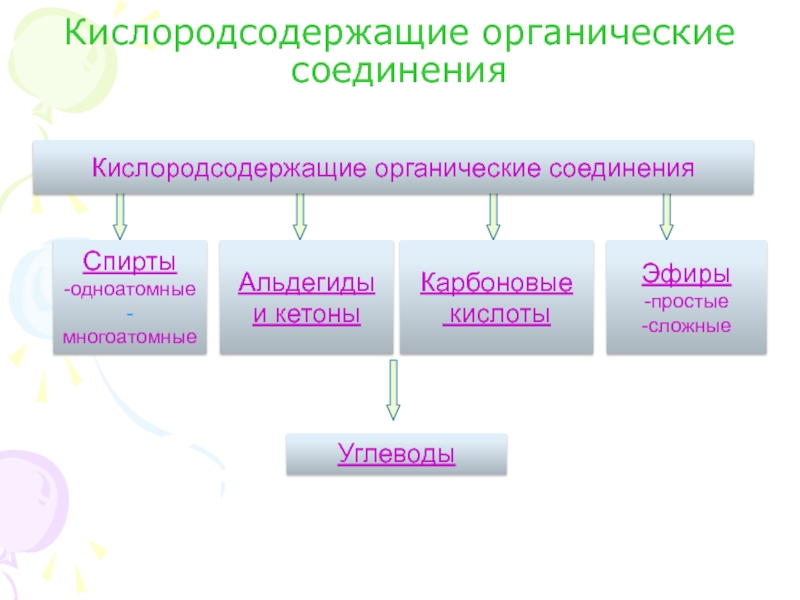
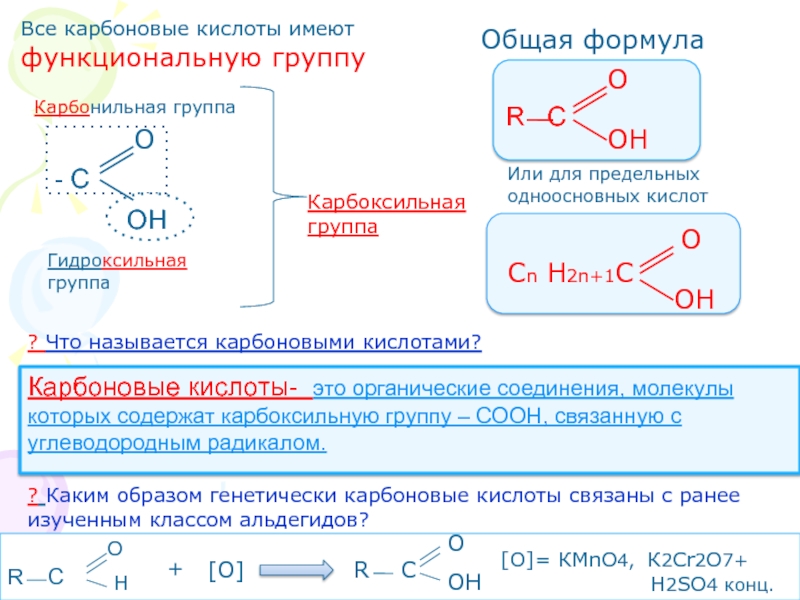
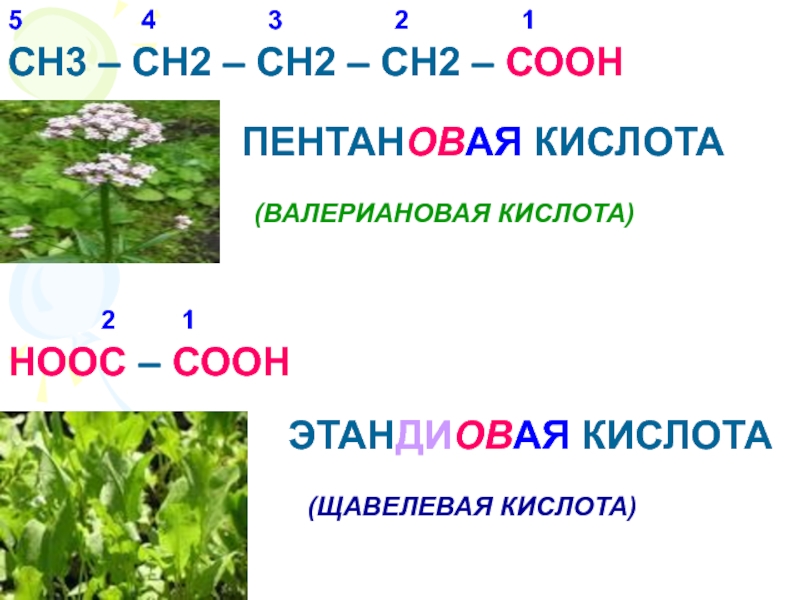
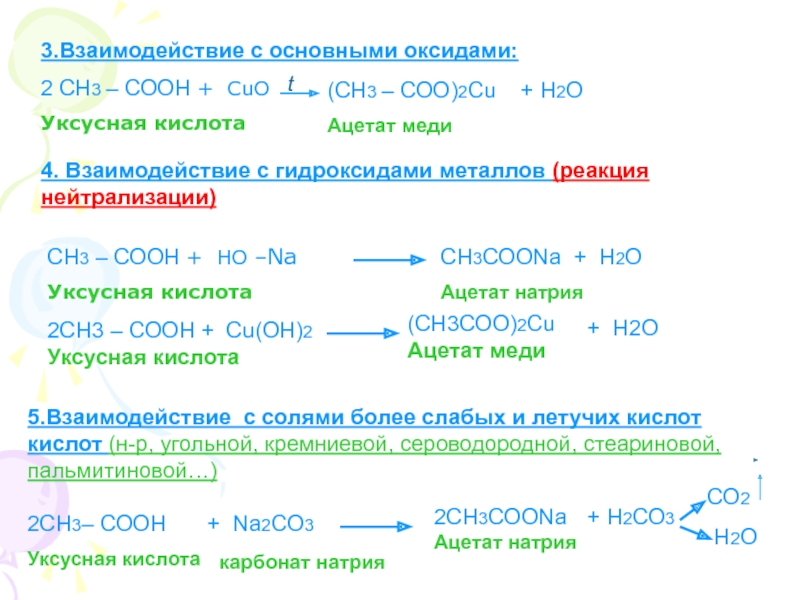
Что называется карбоновыми кислотами?Карбоновые кислоты- это органические соединения, молекулы которых содержат карбоксильную группу – СООН, связанную с углеводородным радикалом.
? Каким образом генетически карбоновые кислоты связаны с ранее изученным классом альдегидов?
R C
О
Н
+
[О]
R C
О
ОН
[О]= КМnO4, К2Cr2O7+
H2SO4 конц.