Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Катионы II (Ag +, Hg 2 2+, Pb 2+ ) и III (Ва 2+, Sr 2+, Са 2+ ) аналитических
Содержание
- 1. Катионы II (Ag +, Hg 2 2+, Pb 2+ ) и III (Ва 2+, Sr 2+, Са 2+ ) аналитических
- 2. Катионы II аналитической группы Ag+, Hg22+ ,
- 3. Катионы II аналитической группы Ag+, Hg22+ ,
- 4. Катионы II аналитической группы Ag+, Hg22+ ,
- 5. Катионы II аналитической группы Ag+, Hg22+ ,
- 6. Катионы II аналитической группы Ag+, Hg22+ ,
- 7. Катионы II аналитической группы Ag+, Hg22+ ,
- 8. Катионы II аналитической группы Ag+, Hg22+ ,
- 9. Катионы II аналитической группы Ag+, Hg22+ ,
- 10. Катионы II аналитической группы Ag+, Hg22+ ,
- 11. Катионы II аналитической группы Ag+, Hg22+ ,
- 12. Катионы II аналитической группы Ag+, Hg22+ ,
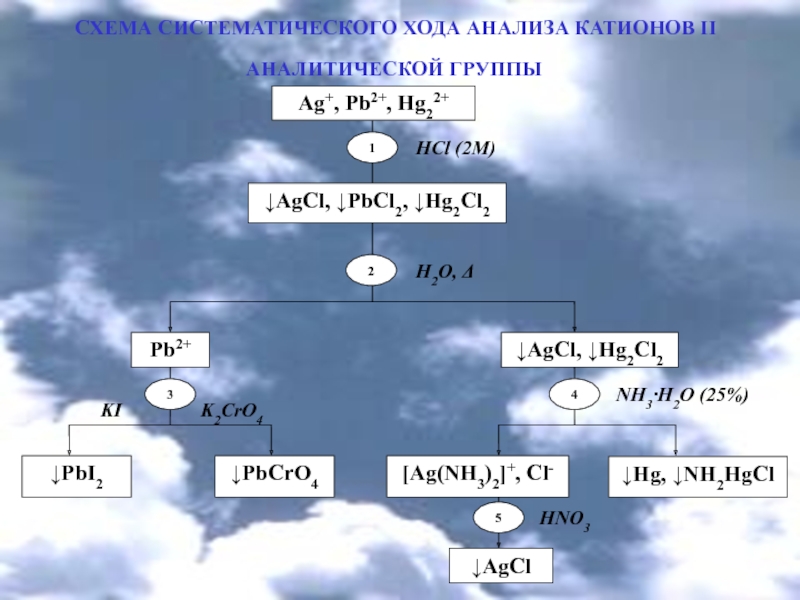
- 13. СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ ІI АНАЛИТИЧЕСКОЙ ГРУППЫ
- 14. Катионы III аналитической группы Ва2+, Sr2+, Са2+Действие
- 15. Катионы III аналитической группы Ва2+, Sr2+, Са2+Гипсовая
- 16. Катионы III аналитической группы Ва2+, Sr2+,
- 17. Катионы III аналитической группы Ва2+, Sr2+,
- 18. Катионы III аналитической группы Ва2+, Sr2+, Са2+Действие
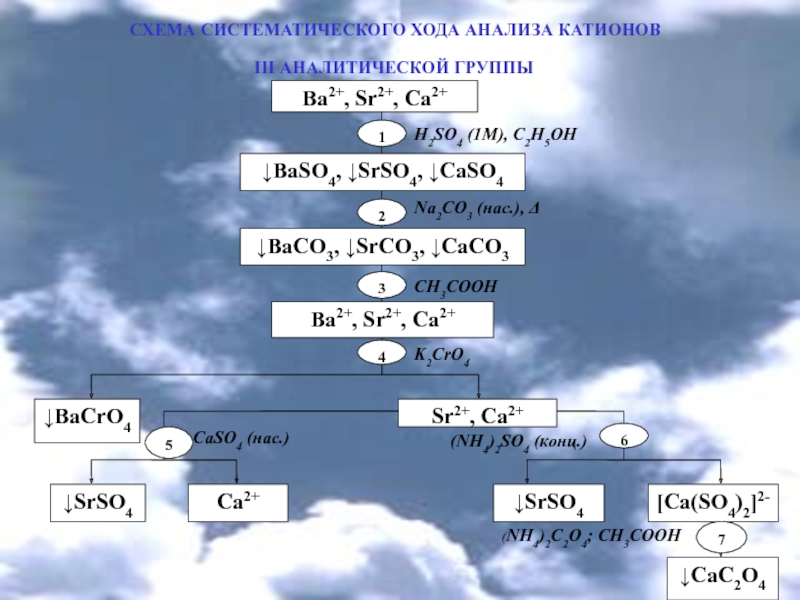
- 19. СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВІIІ АНАЛИТИЧЕСКОЙ ГРУППЫ
- 20. Скачать презентанцию
Катионы II аналитической группы Ag+, Hg22+ , Pb2+Действие группового реагента 2М раствора хлоридной кислоты:Pb(NO3)2 + 2HCl PbCl2 + 2HNO3 ПР = 1,6 10-5 AgNO3 + HCl
Слайды и текст этой презентации
Слайд 2Катионы II аналитической группы Ag+, Hg22+ , Pb2+
Действие группового реагента
2М раствора хлоридной кислоты:
Pb(NO3)2 + 2HCl PbCl2 + 2HNO3
ПР = 1,6 10-5 AgNO3 + HCl AgCl HNO3 ПР = 1,78 10-10
Hg2(NO3)2 + 2HCl Hg2Cl2+ 2HNO3 ПР = 1,3 10-18
При увеличении концентрации хлоридной кислоты осадки частично растворяются :
AgCl + HCl H[AgCl2]
Hg2Cl2 + HCl H[Hg2Cl3]
PbCl2 + HCl H[PbCl3]
Слайд 3Катионы II аналитической группы Ag+, Hg22+ , Pb2+
Серебра хлорид, в
отличие от ртути (I) хлорида, растворяется в растворе аммиака:
AgCl +
2NH3H2O [Ag(NH3)2]Cl + 2H2OБелый осадок ртути (I) хлорида в растворе аммиака чернеет:
Hg2Cl2+2NH3H2O [NH2Hg2]Cl+NH4Cl +2H2O
[NH2Hg2]Cl NH2HgCl + Hg
Слайд 4Катионы II аналитической группы Ag+, Hg22+ , Pb2+
Действие сульфид-ионов:
Pb(NO3)2 +
Na2S PbS + 2NaNO3
2AgNO3 + Na2S Ag2S +
2NaNO3Hg2(NO3)2 + Na2S Hg + HgS + 2NaNO3
Слайд 5Катионы II аналитической группы Ag+, Hg22+ , Pb2+
3PbS + 8HNO3
3Pb(NO3)2 + 3S + 2NO + 4H2O
PbS - 2е ↔ Pb2+ + S0 3NO3- + 4H+ + 3е ↔ NO + 2H2O 2
____________________________________________________________________________________________________________________________________
3PbS + 2NO3- + 8H+ 3Pb2+ + 3S + 2NO + 4H2O
3Ag2S + 8HNO3 6AgNO3 + 3S + 2NO + 4H2O
Ag2S - 2е ↔ 2Ag+ + S0 3
NO3- + 4H+ + 3е ↔ NO + 2H2O 2
____________________________________________________________________________________________________________________________________________________________
3Ag2S + 2NO3- + 8H+ 6Ag+ + 3S + 2NO + 4H2O
Слайд 6Катионы II аналитической группы Ag+, Hg22+ , Pb2+
Действие растворов щелочей:
AgNO3
+ NaOH AgOH + NaNO3
2AgOH Ag2O +
H2OPb(NO3)2 + NaОН Pb(ОН)2 + 2NaNO3
Pb(OH)2 + 2NaОН Na2[Pb(OH)4]
Hg2(NO3)2 + 2NaОН
HgO + Hg + 2NaNO3 + H2O
Слайд 7Катионы II аналитической группы Ag+, Hg22+ , Pb2+
Действие раствора калия
йодида:
AgNO3 + КI AgI + КNO3
желтыйPb(NO3)2 + 2КI PbI2 + 2КNO3
золотисто-желтый
Hg2(NO3)2 + 2КI Hg2I2 + 2КNO3
зеленый
Hg2I2 + 2КI K2[HgI4] + Hg↓
Слайд 8Катионы II аналитической группы Ag+, Hg22+ , Pb2+
Действие раствора аммиака:
AgNO3
+ NH3H2O AgOH + NH4NO3
2AgOH Ag2O + H2O
Ag2O
+ 4NH3H2O 2[Ag(NH3)2]OH + 3H2OPb(NO3)2 + 2NH3H2O Pb(OH)2 + 2NH4NO3
Слайд 9Катионы II аналитической группы Ag+, Hg22+ , Pb2+
При действии хромат-ионов
катионы II аналитической группы образуют окрашенные осадки:
2AgNO3 + К2CrO4
Ag2CrO4 + 2КNO3кирпично-красный
Hg2(NO3)2 + К2CrO4 Hg2CrO4 + 2КNO3
красный
Pb(NO3)2 + К2CrO4 PbCrO4 + 2КNO3
желтый
Слайд 10Катионы II аналитической группы Ag+, Hg22+ , Pb2+
Ag2CrO4 +4NH3∙H2O
[Ag(NH3)2]2CrO4 +4H2O
PbCrO4 + 4КOH K2[Pb(OH)4] + К2CrO4
Ag2CrO4 + 4HNO3
4AgNO3 + H2Cr2O7 + H2OСлайд 11Катионы II аналитической группы Ag+, Hg22+ , Pb2+
Катионы II аналитической
группы с сульфат-ионами образуют малорастворимые в воде соли белого цвета:
2AgNO3
+ Н2SO4 Ag2SO4 + 2HNO3 Hg2(NO3)2 + Н2SO4 Hg2SO4 + 2HNO3
Pb(NO3)2 + Н2SO4 PbSO4 + 2HNO3
Слайд 12Катионы II аналитической группы Ag+, Hg22+ , Pb2+
Свинца сульфат растворяется
в щелочах и 30% растворе аммония ацетата:
PbSO4 + 4NaOH
Na2[Pb(OH)4] + Na2SO42PbSO4 + 2CH3COONH4
[Pb(CH3COO)2·PbSO4] + (NH4)2SO4
Слайд 14Катионы III аналитической группы Ва2+, Sr2+, Са2+
Действие группового реагента 1М
раствора сульфатной кислоты:
BaCl2 + Н2SO4 BaSO4 + 2HCl
ПР = 1,1 10-10SrCl2 + Н2SO4 SrSO4 + 2HCl ПР = 3,2 10-7
CaCl2 + Н2SO4 CaSO4 + 2HCl ПР = 2,5 10-5
CaSO4 + (NH4)2SO4 (NH4)2[Ca(SO4)2]
Слайд 15Катионы III аналитической группы Ва2+, Sr2+, Са2+
Гипсовая вода (насыщенный раствор
CaSO4) осаждает ионы Вa2+ и Sr2+ в виде соответствующих сульфатов:
CaSO4
Ca2+ + SO42-BaCl2 + CaSO4 BaSO4 + CaCl2
SrCl2 + CaSO4 SrSO4 + CaCl2
Слайд 16 Катионы III аналитической группы Ва2+, Sr2+, Са2+
Действие карбонат-ионов:
BaCl2 +
Na2CO3 BaCO3 + 2NaCl ПР = 4,0
10-10SrCl2 + Na2CO3 SrCO3 + 2NaCl ПР = 1,0 10-10
CaCl2+Na2CO3 CaCO3 +2NaCl ПР = 3,68 10-9
Осадки карбонатов растворяются в минеральных (HCl, HNO3) и уксусной кислотах:
BaCO3 + 2HCl BaCl2 + H2O + CO2
BaCO3 + 2CH3COOH
(CH3COO)2Ba + H2O + CO2
Слайд 17 Катионы III аналитической группы Ва2+, Sr2+, Са2+
Действие хромат-ионов:
BaCl2+К2CrO4
BaCrO4 +2КCl ПР = 1,2 10-10
SrCl2 + К2CrO4
SrCrO4 + 2КCl ПР = 3,6 10-5Осадки BaCrO4 и SrCrO4 растворимы в минеральных кислотах:
2BaCrO4 + 4HCl 2BaCl2 + Н2Cr2O7 + H2O
Осадок SrCrO4 в отличие от осадка BaCrO4 растворяется и в уксусной кислоте:
SrCrO4 + 2CH3COOH
(CH3COO)2Sr + Н2CrO4
Слайд 18Катионы III аналитической группы Ва2+, Sr2+, Са2+
Действие оксалат-ионов:
BaCl2 + Na2C2O4
BaC2O4 + 2NaCl ПР = 1,1 10-7
SrCl2
+ Na2C2O4 SrC2O4 + 2NaCl ПР = 1,6 10-7CaCl2+Na2C2O4 CaC2O4 +2NaCl ПР = 2,3 10-9
Осадки растворяются в растворах минеральных кислот:
BaC2O4 + 2HCl BaCl2 + H2C2O4









![Катионы
II (Ag +, Hg 2 2+, Pb 2+ ) и
III (Ва 2+, Sr 2+, Са 2+ ) аналитических Катионы II аналитической группы Ag+, Hg22+ , Pb2+Ag2CrO4 +4NH3∙H2O [Ag(NH3)2]2CrO4 Катионы II аналитической группы Ag+, Hg22+ , Pb2+Ag2CrO4 +4NH3∙H2O [Ag(NH3)2]2CrO4 +4H2OPbCrO4 + 4КOH K2[Pb(OH)4] +](/img/thumbs/0ef2a6a64a14614d0813cb823ee2ba84-800x.jpg)